По современным представлениям тучные клетки (ТК) являются ключевым звеном воздействия на метаболические процессы организма. Они играют важную роль при многих физиологических и патологических состояниях, и функции их очень разнообразны. Так, цитокины ТК активируют неоангиогенез и могут стимулировать опухолевый рост [1–3]. Выявлено участие тучноклеточной популяции при стрессовых состояниях [4]. Популяции ТК являются неотъемлемым компонентом микроокружения паренхиматозных компонентов большинства органов, и при их повреждении за счет выделения большого спектра биологически активных веществ мастоциты участвуют в процессах регенерации и компенсаторно-приспособительных процессах [5–7]. Морфофункциональная активность ТК также может стимулировать гипоксия. Так, у крыс при острой массивной кровопотере реакция ТК различных тканей носит тотальный характер и проявляется возрастанием миграции и массивной дегрануляцией [8].
Но эти полифункциональные клетки не только играют значительную роль при различных физиологических и патологических состояниях организма, также они участвуют в его адаптации к действию экстремальных факторов, что позволяет некоторым авторам высказать гипотезу о возможности образования ими единой, самостоятельной регуляторной системы. Перераспределение подвижных ТК между тканями при стрессе, повреждении или гипоксии можно рассматривать в качестве важного компонента адаптационного синдрома [9].
В легких ТК имеют большое значение ввиду многообразных физиологических возможностей и обширных функциональных взаимодействий с клеточным окружением, а также в силу наличия прямых и обратных взаимосвязей с нервной, эндокринной и иммунной системами. Так, в частности, при массивном экзоцитозе гранул они выделяют большое количество гистамина, который вызывает спазм гладкой мускулатуры, в основном мелких бронхов, гиперсекрецию бокаловидных клеток и желез подслизистого слоя трахеобронхиальной системы, повышает проницаемость капилляров межальвеолярных перегородок (в результате чего возникают явления отека); они активирует фибробласты и макрофаги, вызывают миграцию лимфоцитов и нейтрофилов в легкие [10].
В то же время, несмотря на интенсивное изучение морфологии ТК в дыхательной системе в физиологических условиях и при патологии, их морфофункциональные характеристики при действии на легкие экстремальных факторов (и гипотермии в том числе) изучены недостаточно.
Целью исследования являлось изучение влияния одноразовой глубокой иммерсионной гипотермии на морфофункциональную активность тучноклеточной популяции легких крыс Вистар в эксперименте.
Материалы и методы исследования
Исследование было выполнено на 25 самцах крыс линии Вистар массой тела 200–240 граммов. Гипотермию моделировали путем помещения животных, находящихся в индивидуальных клетках, в воду температурой 5°С при температуре окружающего воздуха 7°С. Критерием прекращения воздействия служило достижение животными ректальной температуры 20–25°С, что соответствовало глубокой степени гипотермии. Время экспозиции было индивидуальным и в среднем составляло 40±5 мин. В ходе эксперимента крысы были разделены на 4 группы. Животные 1-й группы (n=5) выводились из эксперимента декапитацией сразу после прекращения охлаждения, животные 2-й группы (n=5) – через 2 суток, животные 3-й группы (n=5) – через 7 суток и животные 4-й группы (n=5) – через 14 суток. Контролем служили 5 животных, которых помещали в индивидуальных клетках в воду температурой 30°С при температуре окружающего воздуха 22–25°С. Время экспозиции соответствовало времени охлаждения животных опытной группы.
Для гистологического исследования образцы легких фиксировали в 10%-ном нейтральном формалине в течение 24–48 часов, затем материал проводили в автомате TISSUE-TEK VIPTM6 (Sakkura, Nagano Japan) и заливали в парафин Histomix (станция парафиновой заливки TISSUE-TEK TEC 5 (Sakkura, Nagano Japan). Срезы толщиной 5–7 мкм изготавливали на роторном микротоме Accu-Cut SRM (Sakkura, Китай), окрашивали гематоксилином и эозином в автомате TISSUE-TEK Prisma (Sakkura, Nagano Japan) и заключали под пленку в автомате TISSUE-TEK Film (Sakkura, Nagano Japan). Окрашивание ТК осуществляли с помощью набора «Толуидиновый синий для окраски тучных клеток» фирмы «Biovitrum» (Санкт-Петербург). Фотографировали препараты при помощи микроскопа Nikon Eclipse E200 (Китай) с цифровой видеокамерой VIDI CAM (Россия) при увеличении х 400. В программе Image Tool 3.0. высчитывали среднюю плотность распределения ТК в 5 полях зрения при увеличении микроскопа х 400. Площадь поля зрения микроскопа составляла 0,365 мм2. Оценивали индекс дегрануляции ТК (ИДТК) (процентное соотношение клеток в состоянии дегрануляции к общему числу анализируемых ТК). Морфометрию ТК проводили с помощью лицензионной морфометрической программы «ВидеоТест – Морфология 5.2». Статистическую обработку полученных данных осуществляли при помощи статистического пакета Statistica 6.0.
Результаты исследования и их обсуждение
При окраске толуидиновым синим в легких контрольной группы животных ТК были видны вокруг бронхиол, бронхов, сосудов и в плевре. Они имели округлую форму, небольшой размер и располагались поодиночке. Плотность распределения ТК в легких интактных животных составила в среднем 2,0±0,5 в поле зрения при увеличении х 400. Площадь клеток составила в среднем 82,5±3,6 мкм2. Число ТК компактных форм ТК было равно 87%±10,1, в состоянии дегрануляции было 23%±10,1.
Сразу после воздействия однократной иммерсионной глубокой гипотермии в ткани легких экспериментальных животных ТК определяли в перибронхиальной ткани. Они были крупными, бледно-фиолетового цвета, округлой или овальной формы (рис. 1).
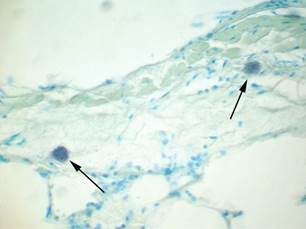
Рис. 1. Легкое крысы. Непосредственно после проведения глубокой гипертермии в перибронхиальной ткани располагается небольшое количество крупных ТК в состоянии гранулоцитолиза (показаны стрелками). Окраска толуидиновым синим. Ув. х400
Плотность распределения ТК сразу после гипотермии в среднем составила 2,7±0,8 в поле зрения, в среднем площадь клеток составила 184,5±14,9 мкм2. Большая часть ТК находилась в состоянии гранулоцитолиза, опустошения в результате секреции гранул. Число ТК в состоянии дегрануляции составило 75%±17,1. Форм ТК, в которых гранулы содержались компактно, было 25%±17,1 (таблица).
Количественная и морфометрическая характеристика тучных клеток легких крыс в зависимости от срока проведения экспериментальной однократной глубокой иммерсионной гипотермии
|
Параметры тучноклеточной инфильтрации |
Срок эксперимента |
|||
|
Сразу после гипотермии (1) |
Через 2 дня (2) |
Через 7 дней (3) |
Через 14 дней (4) |
|
|
Число ТК |
2,5±0,8 |
6,6±0,5 |
8,0±1,0 |
4,3±0,3 |
|
Число компактных ТК (%) |
25,0±17,1 |
52,0±8,9 |
76,7±8,6 |
70,7±12,2 |
|
Число дегранулирующих ТК (%) |
75,0±17,1 |
48,0±8,9 |
23,3±8,6 |
29,3±12,2 |
|
Площадь ТК (мкм2) |
184,5±14,9 |
84,2±3,5 |
107,9±7,3 |
90,8±6,2 |
Примечание: для числа ТК P1-2, P1-3, P1-4 < 0,01. P2-3, P2-4 < 0,04. P3-4 < 0,001. Для числа компактных ТК P1-2, P1-3, P1-4 < 0,001. P2-3 < 0,01. Для числа дегранулирующих ТК P1-2, P1-3, P1-4 < 0,03. P2-3 < 0,04. Для площади ТК P1-2, P1-3, P1-4 < 0,000005. P2-3 < 0,0004.
На 2-е сутки эксперимента в ткани легких ТК располагались группами в стенках межальвеолярных перегородок (рис. 2). ТК имели небольшие размеры и были округлой или овальной формы. Плотность распределения ТК на данном сроке исследования составила 6,6±0,5 в поле зрения, их площадь в среднем составила 84,2±3,5 мкм2. Число компактных форм ТК составило 52,0%±8,9, дегранулирующих форм было 48,0%±8,9 (таблица).
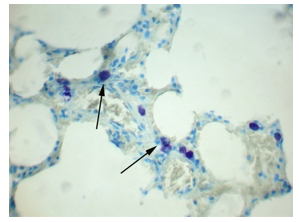
Рис. 2. Легкое крысы. Через 2 суток после гипотермии ТК расположены в капиллярах межальвеолярных перегородок (показаны стрелками). Окраска толуидиновым синим. Ув. х400
На 7-е сутки эксперимента отмечали передвижение ТК к бронхам и бронхиолам, где они располагались в перибронхиальной соединительной ткани, число ТК в межальвеолярных перегородках значительно уменьшалось (рис. 3).
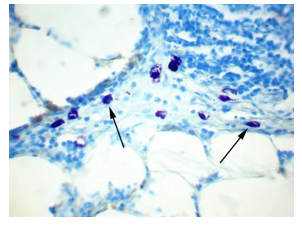
Рис. 3. Легкое крысы. Через 7 суток после гипотермии ТК мигрировали из межальвеолярных перегородок в перибронхиальную ткань (показаны стрелками). Окраска толуидиновым синим. Ув. х400
На данном сроке исследования по своим морфологическим характеристикам ТК отличались от клеток предыдущего срока исследования: они были более интенсивно окрашены, крупных размеров, преобладали клетки удлиненной и неправильной формы. Плотность распределения ТК на данном сроке исследования составила 8,0±1,0 в поле зрения, их средняя площадь увеличилась до 107,9±7,35 мкм2. Компактных форм ТК было 76,0%±8,6, ТК в состоянии дегрануляции – 23,3%±8,6 (таблица).
На 14-й день эксперимента ТК располагались преимущественно поодиночке вокруг бронхиол и бронхов. По сравнению с предыдущим сроком эксперимента ТК были малых размеров, преобладали клетки округлой формы (рис. 4).
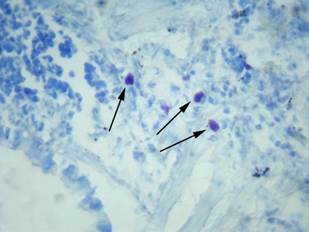
Рис. 4. Легкое крысы. Через 14 суток после гипотермии ТК уменьшались в размерах и были расположены преимущественно в перибронхиальной ткани (показаны стрелками). Окраска толуидиновым синим. Ув. х400
Плотность распределения ТК на данном сроке исследования составила 4,3±0,3 в поле зрения, площадь клеток в среднем была равна 90,8±6,2 мкм2. Количество компактных форм ТК составило 70,7%±13,2, в состоянии дегрануляции было 29,3%±12,2 (таблица).
Обсуждение
Таким образом, полученные данные свидетельствуют о том, что однократная глубокая иммерсионная гипотермия оказывала значительное влияние на морфофункциональную активность ТК легких крыс. Непосредственно сразу после воздействия гипотермии большинство ТК находились в состоянии гранулолизиса или тотальной дегрануляции, что может говорить об истощении системы данных клеток при воздействии холодового стресса. В постгипотермический период, на 2-й день после гипотермии, величина популяции ТК возрастала, большинство клеток было небольшого размера, они локализовались в капиллярах межальвеолярных перегородок, что может свидетельствовать о пополнении резерва популяции ТК за счет миграции в легкие их молодых форм из кровяного русла. На 7-й день эксперимента из альвеол ТК перемещались в перибронхиальную соединительную ткань, число дегранулирующих форм при этом уменьшалось, и на 14-й день содержание таких форм было наименьшим, а количество ТК было близко к норме.
Обнаруженная динамика изменений морфофункциональной активности тучноклеточной популяции при однократной глубокой иммерсионной гипотермии, по нашему мнению, была обусловлена адаптационными процессами. Как известно, в развитии адаптивных реакций выделяют два этапа: 1) этап срочной, но не совершенной адаптации; 2) этап долговременной устойчивой адаптации. Этап срочный адаптивной реакции развивается непосредственно после начала воздействия раздражителя и реализуется на основе готовых, ранее сформированных биологических механизмов. На этом этапе адаптационный эффект обеспечивается не в полной мере, а реакции организма осуществляются на предельных физиологических возможностях. Важнейшим компонентом срочной адаптивной реакции является стресс-реакция со всеми ее проявлениями: повреждением и предельной мобилизацией функциональных возможностей организма и в том числе популяции тучных клеток. Поэтому обнаруженные нами изменения морфофункциональной активности тучноклеточной популяции ТК можно отнести к проявлениям срочной адаптации на воздействие гипотермии, которые характеризовались гипертрофией ТК, гранулолизисом и активной миграцией активированных юных форм ТК из кровяного русла. Миграцию ТК в легкие и их перераспределение при гипотермии можно рассматривать в рамках адаптационного синдрома. Аналогичные данные получили О.С. Арташян и соавт. (2012) на крысах, подвергнутых иммобилизационному стрессу. При воздействии стресса авторы наблюдали перераспределение и миграцию ТК в органы: число их увеличивалось в коже, желудке, кишечнике, печени, надпочечниках, в то время как в тимусе и костном мозге их количество значительно уменьшалось [9].
Заключение
Таким образом, активация ТК под влиянием гипотермии – закономерный процесс, так как ТК экспрессируют множество биологически активных веществ, которые стимулируют регенерацию легочной ткани после повреждения. ТК являются важными факторами, которые обеспечивают устойчивость дыхательной системы к воздействию гипотермии. Реакция ТК определяет ход процессов регенерации, изменений микроциркуляторного русла, восстановления микроокружения, питания паренхиматозных элементов и выработки адаптационных механизмов при действии гипотермии.



