Для населения всего мира характерно, что большинство онкологических процессов чаще возникает на шестом или седьмом десятилетии жизни, чаще болеет городское население [1]. Заболеваемость меланомой у детей и подростков увеличивается в среднем на 2% в год [2]. Уровень заболеваемости меланомой в Австралии выше, чем в аналогичных европейской и азиатской популяциях [3]. Рост заболеваемости меланомой, чаще возникающей на коже у пожилых пациентов мужского пола, отражает характер общей клиники меланомы и свидетельствует о том, что ультрафиолетовое излучение является эпидемиологическим фактором. По мнению Hayward N.K. et al. (2017), меланомы на коже являются распространенным раком только у европейцев, тогда как обычно они возникают в слизистых оболочках внутренних органов и на руках и ногах у людей во всем мире [4]. Среди различных видов меланом злокачественная узловая меланома является одной из наиболее злокачественных опухолей, агрессивность которой не зависит от её размеров. Причины развития меланомы на современном этапе не известны, многочисленные концепции являются предметом острых дискуссий [5]. Лечение узловой меланомы является сложной хирургической задачей, имеет всегда неблагоприятный прогноз вследствие риска раннего метастазирования. Рекомендуемым методом лечения является полное хирургическое иссечение меланомы с запасом нормальной кожи, окружающей опухоль. Иссечение окружающей ткани в радиусе менее 5 мм связано с высокой частотой развития регионарных метастазов в лимфоузлах, или минуя их. Лечение фактически на любой стадии не приводит к увеличению выживаемости, не зависящей от степени инвазии опухоли. Поэтому особое значение приобретает вопрос о площади удаляемой ткани вокруг меланомы. Малигнизация в рамках меланомы кожи более изучена на экспериментальных моделях животных, но известно, что экспериментальная модель с использованием мышей не может быть экстраполирована на человека [6]. Это связано с тем, что меланоциты мыши располагаются в составе волосяных фолликулов. Также ограничением исследований на мышах являются особенности изменений их иммунной системы и механизмы повреждения кожи, что сопровождается развитием меланом, фенотипически сильно отличающихся от естественных. Решение вопроса о размерах объема ткани, удаляемой вокруг меланомы, может быть получено только при изучении морфологической картины в опухоли и в окружающих её основных компонентах микроокружения, таких как эпидермис, дерма, базальная мембрана, кровеносные сосуды и соединительная ткань. Высокую актуальность приобретают результаты, полученные на основе материала человека [7]. Несмотря на достигнутые успехи в диагностике меланомы кожи, по-прежнему не решён вопрос, является ли пролиферация безусловным морфологическим критерием малигнизации ткани. В доступной литературе отсутствуют данные, раскрывающие особенности пластичности кожи в патогенезе меланомы, так как на современном этапе не выяснены причины не заживления раны после экстирпации меланомы. Дополнения в понимании патогенеза меланомы на основе тщательного анализа морфологических особенностей опухоли и её окружения позволят идентифицировать и расширить спектр диагностики и прогнозирования меланоцитарных опухолей [8].
Цель исследования: установить морфологические особенности строения кожи в зоне сформированной меланомы и в окружающих опухоль тканях.
Материал и методы исследования. Исследования проведены на 27 пациентах онкологической поликлиники г. Владивостока с 2009 по 2017 год в возрасте от 45 до 70 лет в соответствии с требованиями Минздравмедпрома РФ от 29.04.94 № 82 и согласно номенклатуре клинических лабораторных исследований МЗ РФ (Приказ № 64 от 21.02.2000 г.) с учётом положений Хельсинкской декларации (2013). Также использованы 38 биоптатов трупного материала кожи пациентов с меланомой. С помощью кластерного анализа исследованы потенциальные однородные подгруппы дермальных меланом в соответствии с принципами доказательной медицины. Использован классический морфологический метод исследования с окрашиванием срезов гематоксилином и эозином с последующим анализом полученного иллюстративного материала. Ретроспективная оценка поражений проводилась по морфологическим признакам, наблюдавшимся при использовании микроскопа Olympus Bx 52. Исследование проведено с разрешения Этического комитета ФГБОУ ВО «ТГМУ» и ФГАОУ ВО «ДВФУ».
Результаты исследования и их обсуждение. Анализ морфологической картины меланомы проведён с использованием материала ткани в её реальной среде. Макроскопически у пациентов был выявлен вертикальный рост опухоли с серой поверхностью, изъязвлениями в центре и инфильтрацией вокруг зоны малигнизации. Гистопатологически также идентифицировали признаки злокачественной меланомы (уровень Кларка V, Breslow толщина 45 мм). Микроскопически во всех слоях кожи идентифицируются очаги деструкции, нарушены контакты между клетками, базальная мембрана эпидермиса отсутствует. Базальные эпителиоциты вытянуты параллельно поверхности кожи. Базальная мембрана не идентифицируется. К базальному слою прилежат клетки опухоли, сосочковый слой занят инфильтратом опухоли. Типичные для сосочкового слоя петлевидные капилляры отсутствуют. Ткань опухоли пронизана кровеносными сосудами. Шиповатый слой состоит из 4 слоёв клеток, истончён. Эпидермис не имеет тканевой полярности, на поверхности видны очаги некроза, роговой и зернистый слои отсутствуют (рисунок 1).
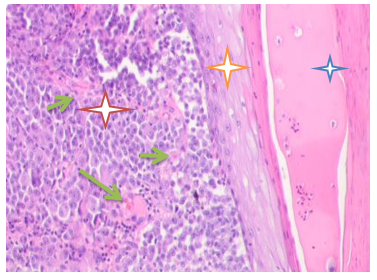
Рис. 1. Кожа женщины 58 лет. Узловая меланома. Окраска гематоксилином и эозином. Микрофото. Ув.: а) х100; б) х400. Деструкция эпидермиса. Отсутствие кожного рисунка на поверхности меланомы
Примечания: красная звёздочка указывает на опухоль кожи; оранжевая - на истончённый эпидермис; синяя - на патологически измененную поверхность эпидермиса; зелёные стрелки – на многочисленные сосуды в строме опухоли.
В зоне инфильтрации наблюдаются лимфоциты, с базофильными ядрами, узким ободком цитоплазмы. Крупные клетки с оксифильной цитоплазмой без пигментных включений и с цитоплазмой, заполненной меланиновыми гранулами, располагаются на участках, лишённых стромы и кровеносных сосудов (рисунок 2).
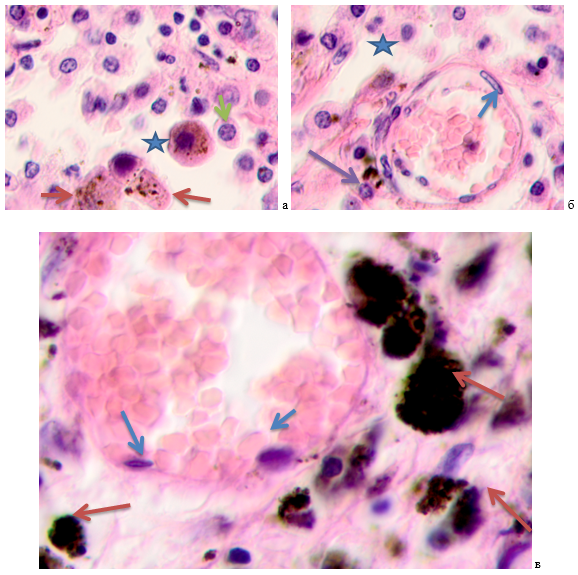
Рис. 2. Кожа женщины 58 лет. Узловая меланома: а) окружающая опухоль ткань на расстоянии 5 мм; б) окружающая опухоль ткань на расстоянии 7 мм; в) окружающая опухоль ткань на расстоянии более 7 мм. Окраска гематоксилином и эозином. Микрофото. Ув. х100
Примечания: синими звёздочками указаны инфильтраты; в их структуре располагаются плазмоциты, указанные зелёными стрелками; красными стрелками указаны меланоциты; фиолетовыми стрелками - апоптозирующие клетки; синяя стрелка указывает на эндотелиоциты. Межклеточное вещество отсутствует, клетки располагаются в экссудате.
Детальный анализ эпидермиса на границе с опухолью показал изменения в базальных слоях, апоптоз камбиальных клеток, разрушение базальной мембраны. Типичное строение шиповатого слоя нарушено, клетки приобрели округлую форму, границы между клетками шиповатого слоя не идентифицируются. В отличие от других авторов, базофилия в ядрах камбиальных слоёв была связана не с пролиферативной активностью, а с кариопикнозом и апоптозом. При этом в камбиальных слоях клетки располагались в несколько слоёв, между ними идентифицировались лимфоциты (рисунок 3).
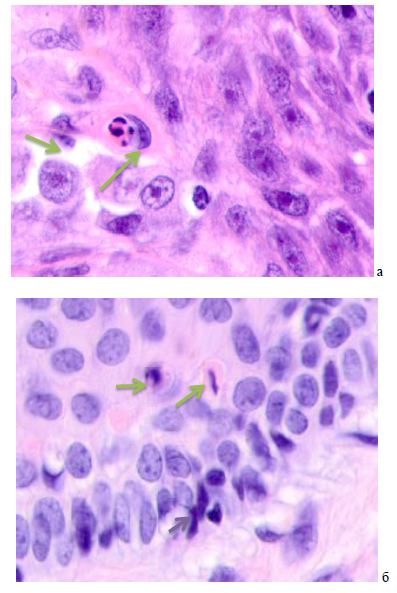
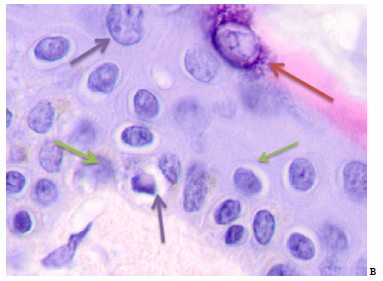
Рис. 3. Кожа женщины 58 лет. Узловая меланома: а) ткань на границе с опухолью; б) ткань на расстоянии менее 5 мм от опухоли; в) ткань на расстоянии более 7 мм. Окраска гематоксилином и эозином. Микрофото. Ув. х100
Примечания: зелёные стрелки указывают на апоптозирующие клетки шиповатого слоя, фиолетовая стрелка - на апоптозирующий базальный кератиноцит, красная стрелка указывает на клетку зернистого слоя.
Эпителиоидные и веретеновидные опухолевые клетки, содержащие пигмент меланин, наблюдались в состоянии активных митозов (от 3 до 5 митозов в поле зрения). Эпидермис кожи, расположенный на расстоянии более 5 см от опухоли, характеризовался наличием редких зернистых кератиноцитов, 2-3 слоями шиповатых клеток, иногда с хорошо выраженными границами. Количество апоптозирующих клеток в поле зрения достигало 14, что составляло 50% от общего количества (рисунок 2в). От 2 до 3 клеток содержали в цитоплазме меланин. Эти данные свидетельствуют, что в динамике удаления от эпицентра малигнизации развивается апоптоз кератиноцитов камбиальных слоев, эпидермис истончается, снижаются и исчезают его барьерные функции. Отсутствие базальной мембраны эпидермиса и зернистого слоя, исчезновение типичной структуры шиповатого слоя и апоптоз являются отражением отсутствия дифференцировки и созревания клеток. Морфологический анализ кровеносных сосудов опухоли и её стромы показал, что формирующиеся в паренхиме опухоли сосуды не имеют типичной сосудистой стенки. В просвете сосудов идентифицируются эритроциты и клетки с крупными слабо базофильными ядрами. Вокруг капилляров идентифицируется лимфоцитарная инфильтрация. Эндотелий частично разрушен, гипертрофирован. Некоторые ядра эндотелия фрагментированы, резко базофильны, носят признаки апоптоза (рисунок 4). Окружающая сосуд и вокруг клеток строма является гомогенной. Нами отмечены высокие ядерно-цитоплазматические отношения.
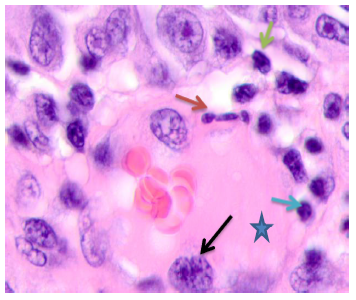
Рис. 4. Кожа женщины 58 лет. Узловая меланома. Ткань на границе с опухолью. Окраска гематоксилином и эозином. Микрофото. Ув. х100
Примечания: синей звёздочкой отмечен просвет сосуда; красной стрелкой - апоптозирующий эндотелиоцит; синей стрелкой – лимфоциты; зелёной стрелкой – апоптозирующая клетка; черной стрелкой - гипертрофированный эндотелиоцит.
Нарушение дифференцировки и апоптоз камбия кератиноцитов, как и эндотелия исходной ткани, ведут к миграции пришлых клеток, опухоль злокачественная не формируется из пролиферирующего собственного камбия. Более того, клетки, мигрирующие в зону перестройки ткани, не имеют возможности дифференцироваться, так как апоптозирующие кератиноциты не способны вырабатывать факторы дифференцировки для прогениторных клеток. На расстоянии от опухоли, превышающем 7 мм, в отличие от рядом расположенных участков, кровеносные сосуды сосочкового слоя сохраняют целостность сосудистых стенок, эндотелий плоский, просвет сосудов заполнен эритроцитами и изредка встречаются клетки крови (рисунок 5).
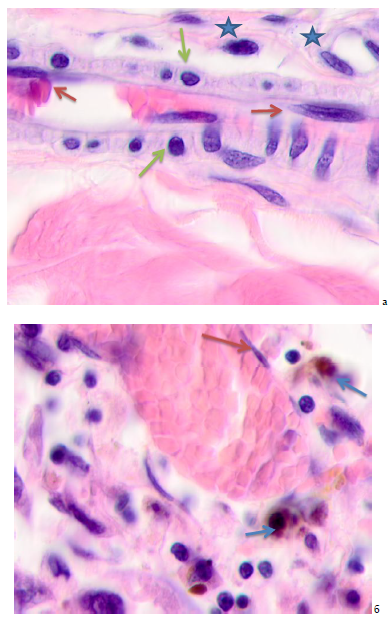
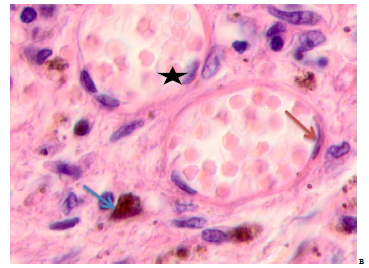
Рис. 5. Кожа женщины 58 лет. Узловая меланома. Ткань на границе с опухолью. Окраска гематоксилином и эозином. Микрофото. Ув. х100
Примечания: синими звёздочками отмечены апоптозирующие клетки; черными звёздочками отмечен гипертрофированный эндотелий; красными стрелками - плоский эндотелий, зелёными – кубические клетки в составе сосудистой стенки, синие стрелки - меланоциты.
На расстоянии более 5 мм от опухоли идентифицируются сосуды с типичными плоскими эндотелиоцитами, сохранившейся базальной мембраной, к которым прилежат клетки кубической формы, с округлыми базофильными ядрами (рисунок 5а). Микроокружение представлено гомогенным межклеточным веществом и апоптозирующими клетками. Отмечено, что на периферии опухоли на расстоянии от 5 до 7 мм от опухоли сосудистая стенка сохранна, выстлана плоским эндотелием, с внешней стороны прилежат единичные лимфоциты (рисунок 5б). В просвете сосудов идентифицируются эритроциты. Микроокружение сосуда представлено меланоцитами, фибробластоподобными клетками, лимфоцитами. Сосочковый слой кожи на расстоянии от опухоли более 7 мм содержит капилляры с неизмененными или слегка гипертрофированными эндотелиоцитами, окружены меланоцитами, лимфоидных мигрантов в поле зрения насчитывается до 3-4 (рисунок 5в). Просвет сосудов в межклеточном веществе идентифицируются коллагеновые волокна. Таким образом, по мере удаления от опухоли динамика изменений эпидермиса и дермы включает в себя апоптоз кератиноцитов, деструкцию межклеточного вещества, инфильтрацию лимфоцитов, гипертрофию и апоптоз эндотелиоцитов, увеличение количества меланоцитов.
Заключение. Kuzbicki L., Lange D., Stanek-Widera A., Chwirot B.W. (2017) считают, что толщина опухоли и уровень инфильтрации окружающей кожи, язва, высокий митотический индекс, более инвазивный гистологический тип, вертикальная фаза роста и метастазы лимфатических узлов положительно коррелируют с другими прогностическими факторами, громоздкими, трудно выполнимыми и дорогостоящими [9; 10]. Эти данные не позволяют объяснить, почему на фоне высокой пролиферативной активности при обычном иссечении опухоли на границе её со здоровой тканью на месте иссечения формируется рана, которая длительное время может не заживать. По нашим данным, это связано с отсутствием реституции в коже вследствие апоптоза, распространяющегося за пределы инфильтрата и границы макроскопически не измененной кожи. Однако, как показал морфологический анализ, зона малигнизации занимает реально большую площадь, о чём свидетельствуют апоптозирующие клетки. Риск присоединения инфекции обусловлен тем, что окружающая опухоль ткань не выполняет барьерных функций из-за нарушения процесса дифференцировки, а высокие риски рецидива возникают из-за неполного иссечения опухоли, так как экстирпация опухоли и окружающей её кожи с видимой зоной инфильтрации не соответствует площади реально поражённой ткани. Исследования свидетельствуют, что усиление противоопухолевого иммунитета путем регулирования иммунной супрессорной среды в окружении раковых клеток является важной задачей для развития иммунотерапии рака. Соответственно, в последние годы вектор исследований иммунологии рака сместился в сторону формирования иммуносупрессорной среды, изучения механизмов иммуносупрессии не только в зоне опухоли, но и в окружении раковой ткани, мониторинга клеточных ансамблей, вовлечённых в процесс малигнизации [11; 12]. Erdmann M., Sigler D., Uslu U. et al. (2017) в качестве прогностических признаков исхода меланомы указывают размеры опухоли, глубину её инвазии, язвы, возраст и наличие метастазов в регионарные лимфоузлы, как наиболее достоверные [13]. Однако следует учитывать, что довольно часто опухоль малых размеров на ранних сроках дает опухолевые спутники в окружающей ткани, рано метастазирует во все внутренние органы, минуя регионарные лимфоузлы. Поэтому часть меланом из-за особенностей патогенеза не вписывается в рамки критериев Breslow и Clark, которые не могут отражать полной истинной морфологической картины меланомы. В связи с этим интеграция конфокальной микроскопии с клиническими и гистологическими аспектами может помочь в выявлении и лечении различных опухолей [14].
Меланома не только характеризуется злокачественными меланоцитами, но также измененными взаимоотношениями между нормальными и неопластическими клетками, включая фиброциты, эндотелиальные и воспалительные клетки, а также со стромой тумора.
Инфильтрированные и окружающие фиброциты, также известные как рак-связанные фиброциты (CAFs), показывают и фенотипические, и физиологические отличия в сравнении с нормальными дермальными фиброцитами. Они приобретают свойства миофибробластов, реконструируют внеклеточный матрикс (ЕСМ) и изменяют структуру малигнизирующейся ткани, секретируют химические факторы и сигнальные молекулы, повышающие процесс роста опухоли, ангиогенез, воспаление, инфильтрацию и метастазирование. В отличие от Haridas P., Penington C.J., Mc Govern J.A. et al. (2017), не нашедших никаких явных доказательств каких-либо взаимодействий между клетками в опухоли, кроме контактов [15], мы считаем, что именно взаимодействия между клетками приводят к запуску малигнизации. Утрата межклеточных контактов и неспособность к реституции обусловлены процессами апоптоза кератиноцитов. Поскольку сохраняются оболочки клеток, отсутствуют сигналы, индуцирующие реституцию. Нарушенные барьерные свойства эпителия приводят к выходу в окружающую ткань воспалительного инфильтрата, с преобладанием в последующем прогениторных клеток, не способных к дифференцировке в связи с отсутствием индуцирующих к ней факторов. Морфологические изменения отражают патогенез процесса в окружающей опухоль среде. Очевидно, что стратегия комбинированной терапии, направленная на опухолевые клетки и опухолевое окружение, может обеспечить перспективное преодоление резистентности меланомы к лечению. Актуальность решения этих вопросов также заключается в том, что объём хирургических мероприятий по удалению опухоли и окружающих её тканей на сегодня является предметом дискуссий. Наши данные свидетельствуют, что размер иссечения опухоли и её окружения должен решаться индивидуально, на основе принципов персонализированной медицины, исходя из объективных показателей морфологических особенностей кожи пациентов и клеточного состава в прилежащих к опухоли тканям.
Выводы. В целом полученные результаты свидетельствуют о том, что для получения прогностической информации у пациентов с меланомой кожи достаточно простого и объективного морфологического скоринга, предполагающего определение гистологической картины зоны первичной меланомы и ее окружения с воспалительным инфильтратом в радиусе более 10 мм, вне зависимости от размеров опухоли. Наши исследования будут способствовать не только развитию мишеневой иммунотерапии рака, но и прогнозированию исходов меланомы на основе контроля микроокружения опухоли. Знание чётких морфологических аспектов на границе опухоли и здоровой неизмененной ткани позволит решить вопрос выбора стратегии и объема хирургического вмешательства с определением оптимальной площади, подлежащей иссечению. По нашим данным, не отсутствие должного ухода за раной может спровоцировать развитие воспалительного процесса, что вызывает патогенная микрофлора, а нарушение барьерных функций окружающей опухоль ткани. Необходимость удаления с опухолью не только зоны инфильтрации, но и зоны апоптозирующих кератоцитов позволит иссечь реально соответствующую зоне малигнизации ткань.
Работа выполнена при поддержке Научного фонда ДВФУ, в рамках государственного задания 17.5740/2017/6.7.



