Клещевой энцефалит – природно-очаговая инфекция, вызываемая вирусом клещевого энцефалита, передающимся человеку через укусы клещей или при употреблении молока коз и коров, зараженных вирусом. Заболевание распространено в странах Восточной, Центральной и Северной Европы и в северных частях Китая, Монголии и России. Первое клиническое описание заболевания дал отечественный исследователь Панов А.Г. в 1935 г. В 1937 году в ходе экспедиции на Дальний Восток Зильбер Л.А. с сотрудниками установили природу заболевания, выделив возбудитель крови и ликвора больных людей, а также из мозга умерших. Инфицирование вирусом клещевого энцефалита (ВКЭ) характеризуется преимущественным поражением центральной нервной системы, отличается тяжестью течения и высоким уровнем инвалидизации.
ВКЭ относится к роду Flavivirus семейства Flaviviridae. Выделяют три подтипа возбудителя: дальневосточный подвид (известен также как вирус российского весенне-летнего клещевого энцефалита), западноевропейский и сибирский подвид. Ежегодно сообщается о 10–12 тыс. случаях клещевого энцефалита, однако считается, что данная цифра значительно ниже фактической [1]. Отмечается рост числа зарегистрированных случаев заболевания в большинстве стран.
Геном ВКЭ представлен однонитчатой РНK положительной полярности, кодирующей полипротеин, который ко- и посттрансляционно разрезается на отдельные три структурных белка: C, prM, E и 7 неструктурных белков: NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5. Вирионы ВКЭ имеют сферическую форму и состоят из нуклеокапсида (NC), окруженного наружной липопротеидной оболочкой, в которую в виде шипов погружены поверхностные гликопротеиды (Е) и мембранные белки (М). Последние образуются в процессе созревания вириона из белка-предшественника PrM, разрезающегося клеточными протеазами. Два белка М взаимодействуют с двумя Е белками, образуя на поверхности вириона гетеротетрамер. Функция белка М заключается в стабилизации структуры белка Е и предотвращении его преждевременного превращения в активную форму. Гликопротеин Е запускает вход вируса в клетку путём рецептор-опосредованного эндоцитоза. В дополнение к этому он содержит главные антигенные эпитопы для нейтрализующих антител [2].
Специфических противовирусных препаратов против ВКЭ не создано. В настоящее время вакцинация представляется наиболее эффективным методом профилактики клещевого энцефалита. Единственным рекомендованным средством для экстренной профилактики заболевания является введение высоких доз специфического иммуноглобулина в течение первых дней после инфицирования, но этот метод имеет ряд существенных недостатков и не во всех случаях эффективен. Таким образом, поиск ингибиторов ВКЭ является актуальной проблемой на сегодняшний день.
ВКЭ относится к биологическим агентам II группы патогенности (по Классификации патогенности, действующей на территории РФ), работа с которыми в лабораторных условиях сопряжена с необходимостью соблюдать специальные условия биобезопасности. Для изучения начальных стадий инфекции, а также поиска ингибиторов этапов инфекции, обусловленных поверхностными белками, активно используются псевдовирусы, получаемые in vitro в результате псевдотипирования – замены поверхностных белков одного вируса на поверхностные белки другого, чаще всего более высокопатогенного вируса. Начальные этапы инфекции псевдовирусов полностью определяются их поверхностными белками и, таким образом, являются полностью идентичными ранним этапам инфекции вируса, поверхностный белок которого использовался при псевдотипировании. В отличие от инфекционных вирусов работа с псевдовирусами безопасна, поскольку геном псевдовирусов отредактирован таким образом, чтобы их инфекция ограничивалась лишь одним циклом. В связи с чем псевдовирусы также называются «вирусами одного цикла инфекции». Используемый нами подход к конструированию псевдовирусов предполагает трансфекцию клеток геном поверхностных белков ВКЭ (ген Е+prM) с последующей трансдукцией рекомбинантным вирусом везикулярного стоматита (рВВС). В геноме используемого нами рВВС удален ген поверхностного белка, поэтому в результате инфекции образуются вирионы, не имеющие поверхностных белков, а следовательно, не являющиеся инфекционными. При инфекции же таким вирусом клеток, экспрессирующих вирусные поверхностные белки (собственный поверхностный белок G ВВС или поверхностные белки чужеродного вируса), образуются частицы, способные воспроизводить лишь один цикл инфекции.
Псевдовирусы сегодня с успехом используются, например, для поиска противовирусных препаратов высокопатогенных вирусов, в частности коронавирусов, вирусов, вызывающих геморрагические лихорадки, грипп и т.д. [3-5].
Полученный нами рВВС вместо собственных поверхностных белков несет функционально активные молекулы поверхностных белков ВКЭ штамма Софьин. Для того чтобы была возможность количественно оценивать эффективность инфекции клеток-мишеней, в геном рВВС встроен репортерный ген – люцифераза светлячка.
Создание псевдовируса ВКЭ (пВКЭ) позволит проводить исследования поверхностных белков ВКЭ, не располагая специальными условиями биологической защиты, необходимой для работы с полноценным инфекционным вирусом.
Цель исследования заключается в создании системы для поиска ингибиторов ВКЭ.
Материалы и методы исследования
Плазмиды. Плазмида pCAGGS-ВКЭ, экспрессирующая гены поверхностных белков ВКЭ штамма Софьин, встроенных в сайты рестрикции EcoR1 и Xho1 вектора pCAGGS, были любезно предоставлены проф. Давей Р.А. (prof. Davey R.A.) (Texas Biomedical Research Institute).
Плазмида peGFP-N1, кодирующая зеленый флуоресцентный белок (GFP) (Clontech, США), использовалась как маркер эффективности трансфекции.
Плазмида pCMV-beta-gal (Addgene, США), не кодирующая никакого вирусного белка, использовалась для отрицательного контроля.
Клеточные линии. Клетки линии HEK293 культивировались на среде DMEM (Dulbecco's Modified Eagle's Medium) с добавлением 10% FBS (эмбриональная телячья сыворотка) (ThermoScientific, США), смеси антибиотиков пенициллина и стрептомицина в концентрациях 100 Ед/мл и 100 мкг/мл соответственно, 6 ммоль/л L-глутамина («Биолот», Россия) во влажной атмосфере в CO2 -инкубаторе при температуре 37 °С и c 5% содержанием CO2.
Получение псевдовирусов пВКЭ. Для экспрессии поверхностных белков ВКЭ выполнялась трансфекция эукариотических клеток плазмидой, кодирующей поверхностный белок ВКЭ. Затем, через 24 часа после трансфекции, клетки заражали рекомбинантным вирусом везикулярного стоматита (рВВС), несущим на поверхности гликопротеин G вируса везикулярного стоматита ВВС. рВВС является репликационно дефектным, так как в его геноме удален ген поверхностного гликопротеина G, который замещен на репортерный ген люциферазы светлячка, использующийся для количественной оценки трансдуцирующей активности рВВС. рВВС также был любезно предоставлены проф. Давей Р.А. Далее такой рВВС будем обозначать как rVSV-ΔG-Luc-G [6].
Оптимизация количества плазмид и rVSV-ΔG-Luc-G, достаточных для получения пВКЭ. Трансфекция выполнялась кальций-фосфатным методом. Клетки рассаживали за 5 часов до трансфекции так, чтобы плотность монослоя была 70-80%. Трансфекции выполнялись в двух сериях чашек следующими сочетаниями плазмид:
(1) 2,5 мкг pCAGGS-ВКЭ + 12,5 мкг pβGal + 0,1 мкг peGFP-N1
(2) 5 мкг pCAGGS-ВКЭ + 10 мкг pβGal + 0,1 мкг peGFP-N1
(3) 7,5 мкг pCAGGS-ВКЭ + 7,5 мкг pβGal + 0,1 мкг peGFP-N1
(4) 10 мкг pCAGGS-ВКЭ + 5 мкг pβGal + 0,1 мкг peGFP-N1
(5) 15 мкг pCAGGS- ВКЭ + 0,1 мкг peGFP-N1
Количество плазмид указано из расчета на 10-см чашку.
Успешность трансфекции можно оценить визуально через 12 часов по количеству светящихся зеленым цветом клеток при флуоресцентной микроскопии. В качестве отрицательного контроля, характеризующего трансдуцирующую способность непсевдотипированного капсида, использовали псевдовирусный препарат, полученный при трансфекции плазмидой pCMV-beta-Gal, не кодирующей никакого поверхностного белка, с последующей инфекцией тем же количеством rVSV-ΔG-Luc-G.
На следующий день клетки отмывались от остатков трансфектанта культуральной средой. Затем к ним добавляли rVSV-ΔG-Luc-G по 250 мл (соответствует 2 х 108 относительных люминесцентных единиц (ОЛЕ)) в первую серию и по 500 мкл (соответствует 5 х 108 ОЛЕ) во вторую серию чашек. Через 6 часов каждую чашку дважды промывали средой и далее культивировали в свежей среде. Сбор вируса осуществляли через 48 часов после трансфекции. Псевдовирусные препараты очищали от клеточных останков низкоскоростным центрифугированием при 3000 об/мин в течение 2 минут с последующим фильтрованием через 0,45 мкм фильтр. Аликвоты псевдовирусного препарата хранили при температуре 70 °С.
Определение трансдуцирующей способности псевдовируса. Для определения трансдуцирующей способности псевдовируса использовали клетки, рассаженные в 24-луночный планшет при плотности монослоя 80-90%. Клетки заражали различным количеством вирусного препарата в тройных повторах (с последующим центрифугированием/осаждением псевдовируса при 3000 об/мин и температуре 4 °С в течение 60 мин). Измерение люциферазного сигнала производили через 24 часа после инфекции, люминометрия осуществлялась на приборе Glomax plate reader (Promega, Швейцария). Трансдуцирующей способностью псевдовируса, псевдотипированного поверхностными белками ВКЭ rVSV-ΔG-Luc-(ВКЭ), считали разность сигналов люциферазы, полученных при инфекции одинаковыми количествами псевдотипированного вируса и отрицательного контроля (непсевдотипированного капсида).
Нейтрализация антителами. Для проведения нейтрализации псевдовируса использовали серию последовательных десятикратных разведений антител. Псевдовирус (100 мкл) инкубировали с сыворотками реконвалесцентов острого клещевого энцефалита в течение 30 мин при постоянном покачивании на ротационной платформе при комнатной температуре. Затем псевдовирус со связанными антителами добавляли к клеткам-мишеням. Нейтрализацию псевдовируса, псевдотипированного гомологичным поверхностным гликопротеином G (rVSV-ΔG-Luc-G), использовали в качестве контроля неспецифического ингибирования антителами и проводили в аналогичных условиях.
Статистический анализ результатов. Для статистического анализа данных, построения графиков и диаграмм использовалась программа Microsoft Excel 2013.
Результаты исследования и их обсуждение
Псевдовирусы могут служить заменой инфекционным вирусам в решении ряда фундаментальных и прикладных задач, касающихся изучения свойств отдельных вирусных белков, поиска противовирусных средств и оценки титра нейтрализующих антител [5; 7].
Нами получен псевдовирусный препарат на основе капсида ВВС, имеющего на своей поверхности вместо собственного поверхностного гликопротеина G поверхностные белки ВКЭ. Впервые возможность встройки ВВС в свою оболочку белков ВКЭ была обнаружена при совместной инфекции клеток ВВС и ВКЭ [8]. Однако предложенный здесь способ получения пВКЭ, насколько нам известно, применен впервые.
В первую очередь, нами подобрано оптимальное количество плазмиды, кодирующей поверхностные белки ВКЭ и рВВС, которого достаточно для получения пВКЭ с оптимальным трансдуцирующим титром. На рисунке 1 приведена трансдуцирующая активность полученных препаратов в результате использования различного количества плазмиды и вируса рВВС.
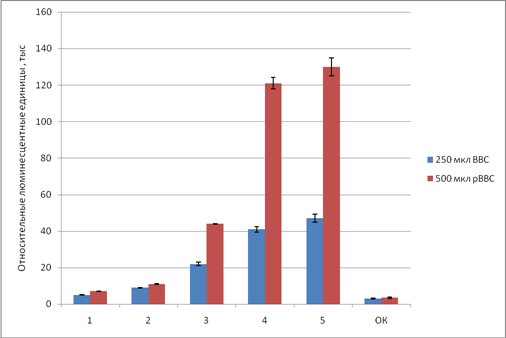
Рис. 1. Трансдуцирующая активность пВКЭ
Примечание: 1-5) – псевдовирусы, полученные в результате трансфекции клеток-продуцентов различным количеством плазмиды pCAGGS-ВКЭ: 1) 2,5 мкг на чашку, 2) 5 мкг, 3) 7,5 мкг, 4) 10 мкг, 5) 15 мкг на 10-см чашку. Псевдовирусы, соответствующие синим и красным столбцам, различаются по количеству рВВС, использованного для их получения (250 и 500 мкл). ОК – отрицательный контроль. По оси ординат – трансдуцирующая активность псевдовируса вируса клещевого энцефалита (пВКЭ), выраженная в тысячах относительных люминесцентных единиц. ВВС - вирус везикулярного стоматита, рВВС – рекомбинантный вирус везикулярного стоматита.
Для дальнейшей работы нами выбран пВКЭ, полученный в результате трансфекции 10 мкг pCAGGS-ВКЭ и 5 мкг pβGal при внесении 500 мкл рВВС и обладающий трансдуцирующей активностью, в 20 раз превышающей отрицательный контроль.
Ранние стадии вирусной инфекции, опосредованные функцией поверхностных белков вируса, являются наиболее привлекательной точкой приложения для противовирусных средств. Это связано с тем, что подавление входа вируса в клетку-мишень нивелирует цитопатический эффект, вызываемый репликацией вируса, снижает риск возникновения лекарственной устойчивости и, кроме того, может применяться для профилактики вирусной инфекции [9].
Чтобы оценить возможность использования пВКЭ для количественного описания активности ингибиторов, нами был определен диапазон линейности сигнала. Результаты представлены на рисунке 2.
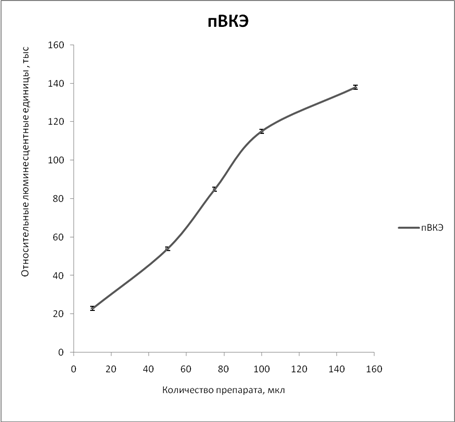
Рис. 2. Линейность люциферазного сигнала при добавлении различного количества пВКЭ
Примечание: пВКЭ - псевдовирус вируса клещевого энцефалита.
Люциферазный сигнал в инфицированных пВКЭ клетках возрастет линейно с увеличением количества псевдовируса. Таким образом, предложенная система подходит для количественной оценки инфекционности псвдовирусного препарата и ингибирующего эффекта веществ, обладающих активностью против поверхностных белков ВКЭ.
Для подтверждения того, что инфекция клеток сконструированным псевдовирусным препаратом определяется именно поверхностным белком ВКЭ, а не другими факторами (например, инфекцией непсевдотипированным ВВС), выполнена нейтрализация пВКЭ специфической поликлональной сывороткой в серии 10-кратных разведений. Результаты нейтрализации полученного псевдовируса представлены на рисунке 3.
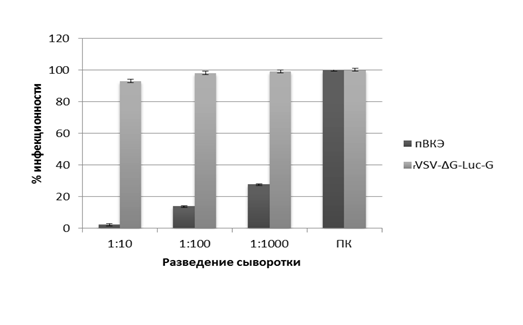
Рис. 3. Подавление трансдуцирующей активности пВКЭ и rVSV-ΔG-Luc-G с использованием различных разведений поликлональных антител
Примечание: ПК – поликлональная сыворотка; пВКЭ - псевдовирус вируса клещевого энцефалита; rVSV-ΔG-Luc-G - псевдовирус, несущий поверхностный белок G вируса везикулярного стоматита.
Поликлональная сыворотка дозозависимым образом подавляла инфекционность псевдовирусного препарата ВКЭ. В то же время инфекционность псевдовируса, несущего поверхностный белок G ВВС (rVSV-ΔG-Luc-G), используемого нами в качестве контроля, оставалась практически неизменной при нейтрализации максимальной концентрацией антител (95.3%). Таким образом, нейтрализация псевдовирусной инфекции поликлональными антителами к ВКЭ подтверждает специфичность Е-зависимой инфекции пВКЭ.
Основным направлением использования полученного пВКЭ является возможность выявления противовирусной активности низкомолекулярных химических препаратов или нейтрализующих антител, а также изучения процессов вирус-клеточного взаимодействия без использования средств максимальной биологической защиты, необходимых для работы с инфекционным ВКЭ.
Заключение
Нами сконструированы псевдовирусы вируса клещевого энцефалита на основе штамма Софьин. Нейтрализация полученных псевдовирусов специфическими сыворотками подтверждает соответствие их инфекционных свойств, определяемых его поверхностными белками, инфекционным свойствам ВКЭ. Таким образом, можно сделать вывод, что данный псевдовирус представляет собой адекватную модель для поиска ингибиторов входа ВКЭ в клетку, кроме того, данная система может быть использована в качестве теста для детекции нейтрализующих антител в крови пациентов с инфекцией ВКЭ или субъектов, проходивших иммунизацию против ВКЭ.



