Колоректальный рак занимает 4-е место по показателю смертности в мире: ежегодно регистрируют более 1 миллиона новых случаев этого заболевания и около 715 000 смертей от него [1, 2]. В России за последнее десятилетие распространенность колоректального рака увеличилась на 49,5%. При этом летальность достигает 40% в течение года, по большей части из-за поздней диагностики [3]. По данным некоторых авторов, частота метастазов при колоректальном раке превышает 50%, а пятилетняя выживаемость без специфического лечения составляет не более 2%. Такие показатели свидетельствуют об острой необходимости применения новых высокоспецифичных диагностических и прогностических молекулярных маркеров колоректального рака. Из известных опухолевых антигенов преимуществом в этом плане обладают раково-тестикулярные антигены (РТА, Cancer Testis Antigens (СТА)), экспрессирующиеся в опухолях различного гистологического происхождения и практически не экспрессирующиеся в нормальных тканях человека (кроме семенников, плаценты и мозга) [4].
Известные в настоящее время 276 раково-тестикулярных антигена объединены в 138 семейств, семь из которых охарактеризованы наиболее полно (MAGE-А, -B, BAGE, GAGE, SSX, LAGE, MAGE-C) [5]. Полипептиды РТА в сочетании с HLA1 (Human Leukocyte Antigens 1, Молекулы главного комплекса гистосовместимости 1-го класса) или HLA2 (Human Leukocyte Antigens 2, Молекулы главного комплекса гистосовместимости 2-го класса) презентируются иммунной системе, что вызывает цитотоксический и гуморальный иммунные ответы [6]. Каждый тип опухолевой ткани имеет высокоспецифичный профиль экспрессии РТ-генов, и для применения РТА в качестве молекулярного онкомаркера или мишени для иммунотерапии необходимы анализ соответствующих баз данных либо молекулярно-генетические исследования для выявления наиболее специфичных РТА [1, 7].
При раке толстой кишки экспрессия РТ-генов охарактеризована недостаточно полно, особенно это касается пациентов российской популяции [8]. Первые исследования генов РТА при колоректальном раке, проведенные в 1996 г. у 54 больных (исследовали экспрессию мРНК MAGEA-1; -2; -3), показали гиперэкспрессию MAGEA-1 в 30%, MAGEA-2 – в 28% и MAGEA-3 в 20% случаев. Экспрессия мРНК РТА чаще была повышена у больных колоректальным раком с метастазами [1]. Вероятно, агрессивные формы рака толстой кишки более сильно экспрессируют гены семейства MAGE, что может способствовать метастатическому процессу. При этом степень совместной экспрессии данных генов или экспрессии по крайней мере одного гена семейства в первичных опухолях толстой кишки исследована не очень хорошо по сравнению с экспрессией в метастазах в печень, что накладывает определенные ограничения на выводы, которые можно сделать на основании этих данных [1, 9].
Данные литературы по экспрессии РТА в опухолях толстой кишки свидетельствуют, что отдельные представители 138 семейств РТА имеют значительный потенциал в диагностике и прогнозировании метастазирования опухолей кишечника [1].
Целью нашего исследования стало изучение транскрипционных профилей РТ-генов для выявления РТА, высокоспецифичных для опухолевой ткани толстой кишки больных с наличием (T1-3N1-2M0) и отсутствием (T1-3N0M0) регионарных метастазов.
Материалы и методы
В исследовании использовали операционные биоптаты нормальных и опухолевых тканей толстой кишки 24 пациентов (48 образцов), проходивших лечение в ФГБУ РНИОИ МЗ РФ в 2016–2018 гг. Исследование одобрено этическим комитетом ФГБУ РНИОИ МЗ РФ; от каждого больного было получено информированное согласие на включение его в данное исследование. Образцы тканей для доставки в лабораторию мгновенно замораживали в жидком азоте [7].
Фрагменты ткани гомогенизировали в лизирующем буфере, содержащем гуанидин тиоцианат, цитрат натрия, саркозил и меркаптоэтанол. Выделение суммарной РНК из лизата тканей проводили методом фенол-хлороформной экстракции [4, 10]. Для очистки от геномной ДНК образцы суммарной РНК обрабатывали препаратами ДНК-азы-1[4, 11]. Для оценки качества полученного препарата РНК проводили электрофорез в 2%-ном агарозном геле (интенсивность полос 18S и 28S в соотношении 1:1 свидетельствовала о приемлемом для дальнейшей работы качестве РНК) [12]. Синтез кДНК проводили с использованием коммерческих наборов «Reverta-L» («Интерлабсервис», Россия) по инструкции производителя [4, 7, 11]. Методом количественной ПЦР в режиме реального времени (RT-qPCR) определяли величины относительной экспрессии 16 генетических локусов: MAGE-A1, -A2, -A3, -A4, -B1, -B2, GAGE-1, -3, -4, MAGEC1, BAGE, XAGE3, NY-ESO1, SSX2, SCP1 и PRAME1. В качестве референсных использовали два генетических локуса GAPDH и GUSB. В исследовании использовали специфичные олигонуклеотидные праймеры (таблица), разработанные Д.И. Водолажским и соавт. [4, 7].
Полученную кДНК амплифицировали в 20 мкл смеси, содержащей 12 нг матрицы кДНК, 0,2 мМ dNTPs, 2,5 мМ MgCl2, 1х-ый ПЦР-буфер и 2 ед. акт. SynTaq ДНК-полимеразы, краситель EVA-Green и по 612 нМ прямого и обратного праймеров для референсных генов или гена-мишени. RT-PCR-амплификацию проводили на термоциклере «Bio-Rad CFX96» («Bio-Rad», USA) по следующей программе: первичная денатурация: t=950С в течение 240 с; 40 циклов: t=950С в течение 10 с, t=580С в течение 30 с, t=720С в течение 30 с. Относительную экспрессию (RЕ) рассчитывали по формуле RЕ=2-ΔΔCt [4, 11, 12]. Нормализацию результатов проводили по двум референсным генам (GAPDH и GUSB) и уровню экспрессии соответствующих генов-мишеней в образцах нормальной ткани, последовательно по схеме, приведенной ниже.
1. Нормализация по среднему референсных генов: ΔC(t) = C(t)target – C(t)reference.
2. Расчет медианы ΔC(t) по каждому гену для контрольной (условно нормальной) и опытной (опухолевой) групп.
3. Нормализация по контрольной группе: ΔΔC(t) = ΔC(t) Медиана опытной группы – ΔC(t) Медиана контрольной группы.
4. Окончательный результат (кратное различие (Fold difference)): 2-ΔΔC(t).[4].
Статистический анализ результатов выполняли с использованием прикладных статистических программ «Microsoft Excel 2013» («Microsoft Corporation», США) и STATISTICA 8.0 (StatSoft Inc., США). Для проведения статистического анализа пациенты были разбиты на две независимые группы: группа А – с наличием регионарных метастазов (10 пациентов) и группа Б – без регионарных метастазов (14 пациентов). Статистическую значимость различий определяли с помощью непараметрического критерия Манна–Уитни. Нулевую статистическую гипотезу об отсутствии различий отвергали при p<0,05.
Панель праймеров для определения относительной экспрессии генов [4, 7]
|
№ |
Название генетического локуса |
Последовательности праймеров |
|
|
Прямой |
Обратный |
||
|
1 |
GAPDH |
GTCAAGGCTGAGAACGGGAA |
TCGCCCCACTTGATTTTGGA |
|
2 |
GUSB |
CAGGACCTGCGCACAAGAC |
CTAGCGTGTCGACCCCATTG |
|
3 |
MAGEA1 |
GAAGGAACCTGATCCAGGC |
AGGGAATTCTGTCCTCTGGG |
|
4 |
MAGEA2 |
CGAAGGCTCCGTGAGGA |
CTGTATTGACCTGAGTCACC |
|
5 |
MAGEA3 |
TGAGCAAAGAGCGACGG |
TCAGACTGTCCCCTCAGAA |
|
6 |
MAGEB1 |
TTCAGTGTGGTGTCCAGCAA |
CGAGTTGTACTCCTGGATGATCA |
|
7 |
MAGEB2 |
AGCCAGGGGTGAATTCTCTG |
GGCACGGAGCTTACTCTCCT |
|
8 |
GAGE1 |
CTGATGGGCACGAGATGGAC |
CCAGTCTCGGCAACATAGTGA |
|
9 |
GAGE3 |
TCACACAGCTGAGTTGGCGA |
CTGTGTGAAATATGAGTTGGCGC |
|
10 |
GAGE4 |
GAGGAGGTGAAAACGCCTGG |
GCATCATTTCAACGTGCCTTCG |
|
11 |
MAGEC1 |
ACGAGGATCGTCTCAGGTCC |
CCAGGTCTTCAACTCCTGCC |
|
12 |
MAGEA4 |
CTGACCAGCAGCTTGGGATC |
TCCAGGGAATCCTGTCCTCCT |
|
13 |
BAGE |
GCCGGCTCCTTTCAGGATTT |
ACATCTTTCAGGAGCTTGGTCAC |
|
14 |
XAGE3 |
ACTTGCCCTGAGACTTAGTT |
ACTTGCCCTGAGACTTAGTTT |
|
15 |
NY-ESO1 |
GAGTTCACTGTGTCCGGCAC |
TGGAGACAGGAGCTGATGGA |
|
16 |
SSX2 |
TACGGTTGGTGCTCAAATACC |
CCGAGGCTTTCATCTTTTCCT |
|
17 |
SCP1 |
AGGTGAAACCTCAGACCCT |
AGTCTTTGCAAATGGAAACTCAAT |
|
18 |
PRAME1 |
GCTGAGCCATTGTCTCGTTACT |
AGGTCTCAGTCACTTGTTGCC |
Результаты и обсуждение
В нашем исследовании в объединенной выборке, состоящей из 24 пациентов с наличием (T1-3N1-2M0) и без (T1-3N0M0) регионарных метастазов, обнаружено статистически значимое (р<0,05) увеличение экспрессии двух РТ-генов SSX2 и PRAME1 в 1,8 (у 25% пациентов) и 2,9 (у 50% пациентов) раза соответственно в опухолевой ткани относительно нормальной ткани и снижение экспрессии одного РТ-гена BAGE в 2,4 раза (у 20% пациентов) в опухолевой ткани относительно нормальной ткани толстой кишки (рис. 1). Экспрессия 13 других генетических локусов MAGEA1, MAGEA2, MAGEA3, MAGEB1, MAGEB2, GAGE1, GAGE3, GAGE4, MAGEC1, MAGEA4, XAGE3, NY-ESO1 и SCP1 в ткани опухоли статистически значимо не отличается от уровня экспрессии в нормальной ткани толстой кишки (р>0,05).
У больных колоректальным раком без регионарных метастазов (T1-3N0M0) обнаружено статистически значимое (р<0,05) увеличение экспрессии РТ-генов MAGEB1 (у 40% пациентов), SSX2 (у 60% пациентов) и SCP1 (у 50% пациентов) в 2,2 раза, 2,2 раза и 2,7 раза соответственно в опухолевой ткани толстой кишки относительно нормальной, а также снижение экспрессии гена BAGE в 1,9 раза (у 40% пациентов) в опухолевой ткани относительно нормальной ткани толстой кишки (рис. 2).
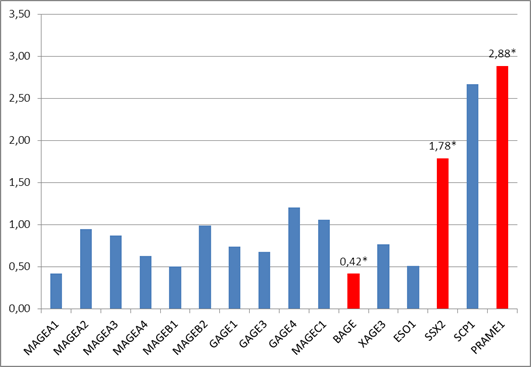
Рис. 1. Соотношение экспрессии РТ-генов в опухолевой ткани толстой кишки относительно нормальной (объединенная выборка, n=24), * – статистически значимые отличия (р<0,05) между опухолевой и нормальной тканью
У пациентов с наличием регионарных метастазов (группа T1-3N1-2M0) обнаружено статистически значимое (р<0,05) увеличение экспрессии генов GAGE1 (у 40% пациентов), SCP1 (у 70% пациентов) и PRAME1 (у 40% пациентов) в 2,5 раза, 9,1 раза и 1,9 раза соответственно в опухолевой ткани толстой кишки относительно нормальной, а также снижение экспрессии генов MAGEA2 (у 40% пациентов), MAGEB1 (у 50% пациентов), MAGEB2 (у 70% пациентов), GAGE4 (у 40% пациентов) и NY-ESO1 (у 40% пациентов) в 2,7, 3,0, 5,9, 3,1 и 3,3 раза соответственно в опухолевой ткани толстой кишки относительно нормальной ткани (рис. 2).
Следует отметить, что в группе пациентов с метастазами (T1-3N1-2M0) в опухолевой ткани экспрессия генов GAGE1 и SCP1 в 3,4 раза выше (р<0,05) уровня экспрессии этих генов в группе пациентов без метастазов (T1-3N0M0). При этом в группе пациентов с метастазами экспрессия таких генов, как MAGEA2, MAGEB1, MAGEB2, GAGE3, GAGE4, NY-ESO1 и SSX2, в опухолевой ткани статистически значимо (р<0,05) ниже в 2,6; 6,8; 5,9; 2,2; 3,1; 4,5 и 3,2 раза соответственно, чем в группе пациентов без метастазов (рис. 2).
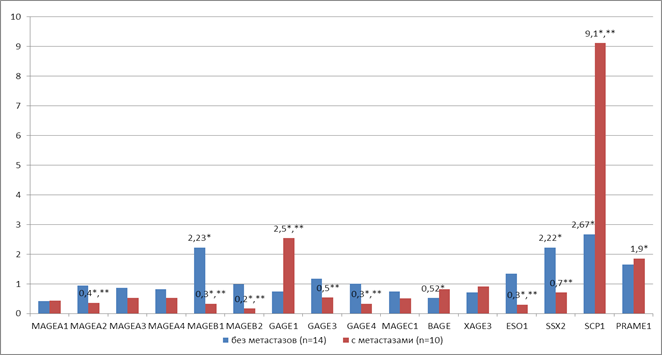
Рис. 2. Уровень транскрипционной активности РТ-генов в опухолевой ткани толстой кишки относительно нормальной у пациентов с регионарными метастазами (n=10) и без (n=14).
* – статистически значимые отличия (р<0,05) между опухолевой и нормальной тканью,
** – статистически значимые отличия (р<0,05) между пациентами с регионарными метастазами и без
Как видно из полученных нами данных, у пациентов с метастатическим и неметастатическим колоректальным раком транскрипционные профили раково-тестикулярных антигенов значительно отличаются. В обеих группах наблюдается повышенная экспрессия ряда генов РТА, относящихся к разным классам: CT-X (MAGEB1, SSX2, GAGE1) и non-X(SCP1, PRAME1), тестикулярно-селективным (SSX2, GAGE1, SCP1) и тестикулярно-ограниченным (MAGEB1, PRAME1). Однако только в опухолевой ткани пациентов с метастазами наблюдается значительное снижение экспрессии ряда генов РТА как относительно опухолевой ткани пациентов без метастазов, так и относительно нормальной ткани.
Повышение экспрессии генов SSX2 и GAGE1, а также снижение экспрессии генов MAGEB1, MAGEB2, GAGE3, GAGE4 и NY-ESO1 согласуется с данными других исследований [1, 9]. В отличие от данных литературы [13, 14] для генов РТА из семейства MAGEA в нашем исследовании не обнаружено статистически значимого увеличения транскрипционной активности.
Заключение
В результате проведенного исследования обнаружена дифференциальная транскрипционная активность раково-тестикулярных генов при метастатическом и неметастатическом колоректальном раке, проявляющаяся в изменении экспрессии генетических локусов MAGEB1, SSX2, BAGE и SCP1 (для неметастатического колоректального рака) и GAGE1, SCP1, MAGEA2, MAGEB1, MAGEB2, GAGE4 и NY-ESO1 (для метастатического колоректального рака). Полученные данные являются предпосылкой для будущих исследований экспрессии раково-тестикулярных генов на более крупных выборках для формирования панели эффективных иммунотерапевтических мишеней колоректального рака дифференциально для двух групп пациентов: с регионарными метастазами (T1-3N1-2M0) и без метастазов (T1-3N0M0). Генетические локусы MAGEB1, MAGEB2, SSX2, BAGE, SCP1, GAGE1, 3, 4, MAGEA2 и NY-ESO согласно результатам данного исследования обладают большим потенциалом в прогнозировании региональных метастазов при данном заболевании.



