Рассеянный склероз – хроническое аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся недостаточно изученным этиопатогенезом, вариабельностью неврологической картины и малопредсказуемым прогнозом. Весомый вклад в понимание природы РС внес метод магнитно-резонансной томографии (МРТ), позволяющий проследить in vivo динамику повреждения головного и спинного мозга. Стало ясно, что очаги в белом веществе – это только часть всего спектра нейровизуализационных проявлений РС. Данные МР-спектроскопии подтвердили более ранние наблюдения о том, что не только миелиновая оболочка, но и аксоны и нейроны поражаются при РС [1]. Новые сведения о нейродегенеративном компоненте первично демиелинизирующего заболевания способствовали поиску новых клинико-радиологических взаимосвязей. Было показано, что развитие необратимой инвалидизации связано с дегенеративным процессом [2-4]. Eshanghi A. и соавт. в своем исследовании пришли к выводу, что уменьшение объема глубокого (а не коркового) серого вещества связано с нарастанием степени инвалидизации, оцениваемой по шкале EDSS [5]. В настоящее время церебральная атрофия считается суррогатным маркером прогрессирования РС и отражает деструктивный необратимый процесс. Основу атрофии мозга при РС предположительно составляют как потеря миелина, олигодендроцитов, так и дегенерация аксонов и нейронов [6, 7].
Различают общую (увеличение желудочков мозга и субарахноидальных пространств) и регионарную (уменьшение отдельных структур мозга) церебральную атрофию. Для оценки атрофического процесса используют планиметрические (линейные измерения) и волюметрические (измерение объемов) подходы. В повседневной клинической практике дифференцированно оценить поражение серого и белого вещества затруднительно в силу материальных, временных и технических причин. По мнению F. Barkhof и соавт., оценка общей атрофии головного мозга является одним из наиболее перспективных направлений для клинических исследований нейропротективных и репаративных стратегий при рассеянном склерозе, мишенью которых является нейродегенеративный компонент заболевания [8]. Таким образом, необходимость оценки атрофии ЦНС продиктована ее прогностической значимостью. Однако оценке церебральной атрофии в рутинной клинической практике отводится недостаточное внимание.
Цель исследования – изучить взаимосвязь атрофического процесса головного мозга и степени инвалидизации пациентов с рассеянным склерозом.
Материал и методы
В исследование были включены 135 пациентов с установленным диагнозом РС согласно критериям MAGNIMS 2016 и 55 здоровых добровольцев. Оценка клинического статуса у больных рассеянным склерозом проводилась по общепринятой методике с использованием шкалы неврологического дефицита Курцке для оценки нарушений основных неврологических функций. Степень инвалидизации определена по шкале EDSS (expanded disability status scalе). Пациенты, страдающие заболеваниями, сопровождающимися многоочаговым поражением ЦНС, исключались из исследования.
Магнитно-резонансная томография была выполнена на томографе EXСELART Vantage Atlas-X, Toshiba, с напряженностью магнитного поля 1,5 Тл с толщиной среза 5 мм. Для анализа томограмм использовались данные в DICOM 3.0 формате. Оценка изображений проводилась с использованием возможностей графической станции «e-Film Workstation 4.1», Merge. При обнаружении гадолинийнакапливающих очагов демиелинизации пациент исключался из дальнейшего исследования. Для оценки атрофического процесса головного мозга определялись следующие показатели на аксиальных МР-томограммах в режиме Т1-взвешенных изображений:
– ширина третьего желудочка (ШТЖ) в его середине;
– индекс третьего желудочка (ИТЖ) – отношение ШТЖ к расстоянию между наиболее удаленными внутренними поверхностями костей черепа;
– ширина передних рогов боковых желудочков (ШПР) на уровне хвостатых ядер;
– ширина боковых желудочков на уровне тел (ШТБЖ);
– индекс боковых желудочков (ИБЖ) – отношение расстояния между наружными стенками боковых желудочков к расстоянию между наиболее удаленными внутренними поверхностями костей черепа;
– межъядерный показатель (МП) – отношение наименьшего расстояния между медиальными границами хвостатых ядер к расстоянию между границами мозга вдоль той же линии.
Статистический анализ полученных данных выполнен с помощью пакета прикладных программ Statistica 6.0 («Statsoft») и возможностей Microsoft Office Excel. Характер распределения количественных признаков определялся с помощью критерия Шапиро–Уилка. Полученные данные представлены в виде медианы (Me) и верхнего и нижнего квартилей (Р25; Р75). Для сравнения двух независимых групп применялся непараметрический U-критерий Манна–Уитни. С целью выявления связи между исследуемыми признаками был применен корреляционный анализ с помощью непараметрического критерия Спирмена. Влияние одного фактора на другой оценивалось методом корреляционно-регрессионного анализа. Результаты считались статистически значимыми при р < 0,05.
Результаты и обсуждение
В основную группу были включены 38 (28,1%) мужчин и 97 (71,9%) женщин (соотношение м:ж = 1:2,6) в возрасте от 21 до 51 года. Медиана возраста 37 (30; 43) лет. У 65 (48,1%) пациентов был диагностирован ремиттирующий тип течения, у 70 (51,9%) – вторично-прогрессирующий. Возраст дебюта варьировал от 11 до 44 лет, медиана возраста дебюта РС составила 26,0 (20; 31) лет. Длительность заболевания варьировала от 1 года до 26 лет, медиана длительности заболевания 9 (6; 15) лет. Оценка по шкале EDSS варьировала от 1 до 7 баллов, медиана оценки по шкале EDSS в общей выборке составила 4,5 (2,5; 5,5) балла. В контрольной группе обследованы 16 (29%) мужчин и 39 (71%) женщин (соотношение м:ж = 1:2,4). Возраст обследуемых варьировал от 20 до 46 лет, медиана возраста дебюта 31 (29; 40) год.
По возрасту и половому составу группа контроля и группа больных РС были сопоставимы. Сравнительная характеристика пациентов с РС и здоровых добровольцев из группы контроля по изучаемым параметрам МР-картины головного мозга отражена в таблице 1.
Таблица 1
Характеристика атрофического процесса головного мозга в группе пациентов с РС и контрольной группе, Ме (Р25; Р75).
|
Параметры оценки |
Пациенты с РС (n=135) |
Контрольная группа (n= 55) |
U/p |
|
Возраст, годы |
37 (30; 43) |
33 (28,5; 39,5) |
613/ 0,16 |
|
ШТЖ, мм |
5,6 (4; 6,85) |
3,6 (2,9; 4,2) |
295/ 0,000* |
|
ИТЖ |
0,04 (0,03; 0,05) |
0,03 (0,02; 0,04) |
342/ 0,000* |
|
ШПР, мм – левый |
6,9 (6; 8,2) |
5,35 (4,25; 6,55) |
347/ 0,002* |
|
– правый |
6,7 (5,5;8) |
5,4 (4,45; 7) |
494/ 0,026* |
|
ШТБЖ, мм – левый |
12 (9,7; 14,5) |
8,45 (6,15; 10,5) |
320/ 0,000* |
|
– правый |
11 (9,5; 14) |
8,35 (6,6; 10,5) |
422/ 0,006* |
|
ИБЖ |
0,24 (0,22; 0,27) |
0,23 (0,21; 0,24) |
585/ 0,11 |
|
МП, % |
13,8 (11,9; 15,7) |
8,85 (7,9; 10,6) |
401/ 0,004* |
*– значения р, достигшие статистической значимости различий.
Примечание. ШТЖ – ширина третьего желудочка, ИТЖ – индекс третьего желудочка, ШПР – ширина передних рогов боковых желудочков, ШТБЖ – ширина боковых желудочков на уровне тел, ИБЖ – индекс боковых желудочков, МП – межъядерный показатель.
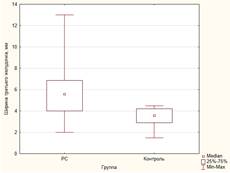
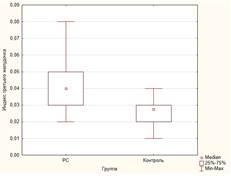
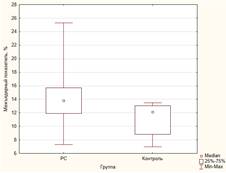
Как видно из таблицы 1, у пациентов с РС значения измеряемых показателей атрофии были значимо выше, чем в группе здоровых добровольцев (рис. 1). Различия в значениях индекса боковых желудочков не достигли статистической значимости, однако медианы и интерквартильный размах демонстрируют тенденцию к различию.
|
А) |
Б) |
|
В) |
|
Рис. 1. Некоторые показатели атрофического процесса головного мозга в группе больных РС и контрольной группе: А) ширина третьего желудочка; Б) индекс третьего желудочка; В) межъядерный показатель
С помощью метода ранговой корреляции Спирмена были проанализированы взаимосвязи между измеряемыми показателями общей атрофии головного мозга у больных РС и степенью неврологического дефицита, оцениваемой по шкале Курцке (табл. 2).
Таблица 2
Анализ взаимосвязей показателей атрофии и неврологического дефицита
по шкале Курцке, коэффициент Спирмена R/ p-value
|
Функциональные системы |
ШТЖ, мм |
ИТЖ |
ШПР, мм |
ШТБЖ, мм |
ИБЖ |
МП |
||
|
левый |
правый |
левый |
правый |
|
|
|||
|
ФС1 |
–0,07/ 0,4 |
–0,08/ 0,36 |
–0,1/ 0,26 |
–0,14/ 0,12 |
–0,05/ 0,54 |
–0,07/ 0,4 |
–0,15/ 0,08 |
0,007/ 0,93 |
|
ФС2 |
0,05/ 0,6 |
0,002/ 0,97 |
0,13/ 0,12 |
0,02/ 0,24 |
0,07/ 0,36 |
0,05/ 0,54 |
–0,05/ 0,56 |
0,16/ 0,07 |
|
ФС3 |
0,25/ 0,003* |
0,23/ 0,008* |
0,12/ 0,15 |
0,19/ 0,02* |
0,16/ 0,07 |
0,18/ 0,04* |
0,08/ 0,33 |
0,27/ 0,001* |
|
ФС4 |
0,35/ 0,000* |
0,33/ 0,000* |
0,31/ 0,000* |
0,26/ 0,002* |
0,25/ 0,003* |
0,24/ 0,006* |
0,102/ 0,23 |
0,36/ 0,000* |
|
ФС5 |
–0,22/ 0,000* |
–0,24/ 0,006* |
–0,14/ 0,11 |
–0,19/ 0,03* |
–0,15/ 0,09 |
–0,23/ 0,007* |
0,01/ 0,87 |
–0,1/ 0,25 |
|
ФС6 |
0,25/ 0,004* |
0,23/ 0,008* |
0,17/ 0,05* |
0,21/ 0,01* |
0,06/ 0,47 |
0,11/ 0,2 |
0,04/ 0,66 |
0,32/ 0,000* |
|
ФС7 |
0,32/ 0,000* |
0,31/ 0,000* |
0,30/ 0,001* |
0,30/ 0,000* |
0,23/ 0,007* |
0,29/ 0,000* |
0,18/ 0,04* |
0,40/ 0,000* |
|
EDSS |
0,31/ 0,002* |
0,22/ 0,01* |
0,18/ 0,03* |
0,18/ 0,03* |
0,19/ 0,03* |
0,20/ 0,02* |
–0,01/ 0,87 |
0,34/ 0,000* |
*– значения р, достигшие статистической значимости различий, полужирным выделены умеренной силы корреляционные связи.
Примечание. ФС1 – зрительные функции, ФС2 – стволовые функции, ФС3 – пирамидные функции, ФС4 – мозжечковые функции, ФС5 – чувствительная сфера, ФС6 – функции тазовых органов, ФС7 – высшие мозговые функции, EDSS – expanded disability status scalе.
Как видно из таблицы 2, между показателями атрофического процесса головного мозга и оценкой неврологического дефицита по ФС1 (зрительные функции) и ФС2 (стволовые функции) корреляционных связей не выявлено. Для остальных функциональных систем и оценки EDSS многие корреляционные связи с показателями атрофии достигли уровня статистической значимости. Наиболее убедительные связи с клиническими симптомами установлены для ШТЖ, ИТЖ и МП. Нарушения высших мозговых функций (ФС7), мозжечковые нарушения (ФС4) и степень инвалидизации показали умеренной силы прямые корреляционные связи с атрофическим процессом головного мозга. ИТЖ продемонстрировал несколько более слабые взаимосвязи с неврологическим дефицитом, чем абсолютное значение ШТЖ. Межъядерный показатель выявил наибольшее количество корреляционных связей с параметрами неврологического дефицита. Следует отметить, что все выявленные умеренной силы корреляционные связи имели достаточно высокий уровень статистической значимости – р=0,002 и менее. В целом наиболее выраженную взаимосвязь с неврологическим дефицитом демонстрируют МП и ШТЖ.
Планиметрические измерения ШТЖ по МРТ показывают сильнейшую связь с объемом третьего желудочка (R=0,74, p<0,01), но при этом ШТЖ измерить проще и быстрее, чем объем [9]. Поэтому ШТЖ рекомендуется исследователями как наиболее эффективный и надежный биомаркер при количественной оценке атрофии головного мозга у больных РС [10]. Межъядерный показатель (МП) используется для оценки степени субкортикальной атрофии головного мозга у пациентов с РС [11; 12]. Вычисление МП не требует специального программного обеспечения, легко воспроизводимо при адекватной МР-визуализации хвостатых ядер и передних рогов боковых желудочков. При рассеянном склерозе величина МП выше у пациентов с быстро прогрессирующим течением, что свидетельствует о более выраженной степени атрофии головного мозга в сравнении с мягким вариантом течения [12].
Обнаружены прямые корреляционные связи нарушений высших мозговых функций (ФС7) практически со всеми показателями атрофии, за исключением ШТБЖ и ИБЖ (табл. 2). Ряд зарубежных и отечественных исследований выявил связь когнитивных нарушений при РС с общей атрофией головного мозга, что, возможно, является отражением нейродегенеративного компонента заболевания [10, 13]. Когнитивные тесты в рамках настоящего исследования не проводились, но выявленные взаимосвязи могут стать ориентиром дальнейшего научного поиска.
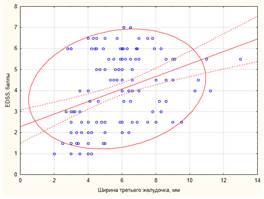
Выявлены корреляционные связи степени инвалидизации больных РС по шкале EDSS практически со всеми параметрами атрофического процесса, но только для ШТЖ и МП эти взаимосвязи достигли умеренной силы (табл. 2). Чем тяжелее была степень инвалидизации пациентов, тем более выражены были признаки общей атрофии головного мозга (рис. 2).
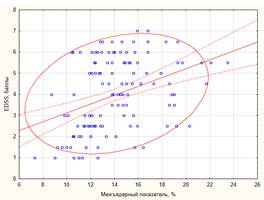
А) Б)
Рис. 2. Корреляционно-регрессионный анализ зависимости степени инвалидизации пациентов по шкале EDSS от ширины третьего желудочка (А, y = 2,26 + 0,31*x; r = 0,31;
p < 0,01; r2 = 0,10) и величины межъядерного показателя (Б, y = 1,29 + 0,2*x; r = 0,34;
p < 0,01; r2 =0,12) Примечание. EDSS – expanded disability status scalе
Ряд исследований показал, что у пациентов со стойким прогрессированием нетрудоспособности по шкале EDSS скорость атрофического процесса в ЦНС значительно выше, чем у пациентов со стабильным течением РС [5, 14]. Нейровизуализационные данные, описывающие атрофический процесс головного мозга (атрофический нейродегенеративный компонент заболевания), необходимы для выявления особенностей течения рассеянного склероза и должны учитываться при оценке эффекта проводимого лечения.
Таким образом, в проведенном исследовании показаны более выраженные признаки общей церебральной атрофии у больных РС по сравнению с группой контроля. Показатели церебральной атрофии коррелируют с мозжечковыми нарушениями, нарушениями высших мозговых функций и степенью инвалидизации пациентов. Наиболее выраженные взаимосвязи с неврологическим дефицитом в нашем исследовании демонстрируют ШТЖ и МП. Последние являются простыми линейными способами оценки атрофического процесса головного мозга, не требующими специального программного обеспечения, и могут быть использованы в клинической практике.