Острый панкреатит (ОП) является одним из наиболее частых хирургических заболеваний. На его долю приходится более 10% ургентной патологии органов брюшной полости. Частота ОП во всем мире составляет от 4,9 до 73,4 случаев на 100 000 человек. При этом летальность при ОП остается высокой (10–20%), что объясняется отсутствием специфических диагностических и терапевтических методов [1].
Показано, что при ОП активируются как клеточные, так и гуморальные факторы системы комплемента, система гемостаза и калликреин-кининовая система, вызывая освобождение оксида азота (NOS). NOS в свою очередь усиливает перекисное окисление мембранных липидов различных клеток, повышает проницаемость микроциркуляторного русла, вызывает ишемию органов, стимулирует апоптоз клеток эндотелия [2]. По данным генетического исследования показано, что при деструкции NOS3 активизируются факторы, ассоциированные с повреждением железы, в частности повышается активность интрапанкреатического трипсина. При селективном разрушении NOS3 в начальной фазе острого индуцированного панкреатита отмечено повышение активности панкреатического трипсина и сывороточной липазы. Показано, что оксид азота, индуцированный эндотелиальной NO-синтазой, оказывает протективный эффект через активацию, вероятнее всего, эндотелиальных клеток, что способствует лучшему интрапанкреатическому кровотоку [3].
Наиболее патогенетически значимые изменения острого панкреатита происходят на уровне микроциркуляторного русла. Им свойственны замедление линейной скорости кровотока, агрегация и застой сформированных элементов крови, повышенная проницаемость сосудов. Микроциркуляторные расстройства, являющиеся генерализованными, имеют определенную стадийность и обычно детерминированы формой панкреатита и тяжестью деструктивных изменений в поджелудочной железе. Значительные нарушения микроциркуляции, приводящие к гипоксии тканей и извращению тканевого метаболизма, являются одной из причин прогрессирования заболевания и развития полиорганной недостаточности [4].
Цель исследования. Определить роль нарушений микроциркуляции и процессов, определяющих структурно-функциональное состояние микроциркуляторного русла, в прогрессировании острого панкреатита.
Материал и методы исследования. В настоящее исследование включены 150 пациентов ОП различной степени тяжести и 20 здоровых лиц. Получено добровольное информированное согласие об участии в исследовании. Пациенты были рандомизированы по полу, возрасту, выраженности заболевания и разделены на 3 группы: I группа (n=50) – легкой степени тяжести; II группа (n=50) – средней степени тяжести; III группа (n=50) – тяжелой степени. Больные были обоего пола в возрасте 21–55 лет. Пациентам проводилась комплексная стандартизированная терапия, включающая антиферментный, инфузионный, антибактериальный, обезболивающий, спазмолитический компоненты. Следует отметить, что у 12 (24,0%) больных тяжелым ОП потребовалось проведение и хирургических вмешательств.
Оценка состояния микроциркуляции проводилась с помощью аппарата ЛАКК-02 (НПП «Лазма», Россия) с соблюдением базовых требований методики допплеровской флоуметрии. В качестве точки для оценки параметров состояния сосудов микроциркуляторного русла была использована точка Захарьина–Геда.
Геномная ДНК выделялась из периферической венозной крови с помощью наборов DNA-Extran-1 при использовании протокола производителя (ЗАО «Синтол», Москва). Исследуемые локусы генов анализировали с помощью амплификации (полимеразно-цепной реакции). Для этого использовали CFX96 Touch™ Real-Time PCR Detection System (Bio-Rad Laboratories, United States).
Перекисное окисление липидов (ПОЛ) было определено по уровню в плазме крови малонового диальдегида (МДА) в реакции с 2-тиобарбитуровой кислотой (ТБК). Содержание диеновых коньюгатов (ДК) установлено спектрофотометрическим методом. Определение активности фосфолипазы А2 произведено титрометрическим методом (Ганстон Ф.Д., 1986).
Статистическая обработка данных результатов было выполнена с помощью программы Statistica 7,0. и калькулятора для расчета статистики в исследованиях «случай – контроль». Для сравнения разных групп пациентов с острым панкреатитом и определения их статистической значимости различий средних величин использовали t-критерий Стьюдента. С целью оценки соответствия наблюдаемого распределения ожидаемому, исходя из равновесия Харди–Вайнберга. Установление ассоциации генетического полиморфизма с предрасположенным фенотипом, характеризующим степени тяжести развития острого панкреатита, было выполнено с помощью расчета величины отношения шансов (ОR). Соотношение фактических частот генотипов к теоретически ожидаемым определяли по критерию χ2.
Результаты исследования и их обсуждение. При госпитализации больных в клинику диагноз «острый панкреатит» подтвержден с помощью клинических, лабораторных и инструментальных методов обследования. Оценка степени тяжести острого панкреатита проведена по шкале APACHE II. Оказалось, что при рассмотрении признаков заболевания сумма баллов у пациентов I группы составила 3,205±0,081, во II группе – 8,724±0,359, а у лиц III группы – 14,994±1,276. Известно, что, если сумма превышает 10 баллов, развитие панкреатита носит преимущественно деструктивный характер [5].
Нами установлено, что ранний период больных острым панкреатитом сопровождался существенными микроциркуляторными нарушениями. Об этом свидетельствовали изменения фактически всех исследованных показателей микроциркуляции.
При исследовании микроциркуляции установлено, что уровень параметра М (характеризующий увеличение или снижение перфузии) у пациентов группы I в первые 2 суток был ниже нормы – на 31,44% и 17,24% (p<0,05) соответственно. К 3-м суткам показатель М значительно повысился, но оставался ниже нормы на 8,4% (p<0,05). На 4-е, 5-е и 6-е сутки исследования показатель М был в пределах нормы (p>0,05). Параметр М у исследуемых пациентов ОП средней степени тяжести было ниже значения нормы в первые 4 суток на 54,78%, 43,91%, 32,75% и 22,6 (p<0,05) соответственно. К 5-м суткам показатель М заметно повысился, но при этом сохранялся ниже нормы на 10,86% (p<0,05). На 6-е сутки уровень М соответствовал норме. Содержание параметра М у больных группы III на всех сроках исследования было ниже нормы на 60,28–13,3% (p<0,05) (рис. 1).
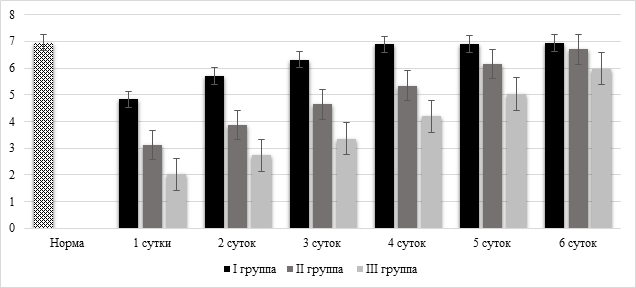
Рис. 1. Динамика показателя М в плазме крови больных острым панкреатитом разной степени тяжести. Здесь и далее в рисунках: I – пациенты с легким острым панкреатитом, II – пациенты с острым панкреатитом средней степени тяжести, III – пациенты с тяжелым острым панкреатитом; * – достоверность отличия от установленной нормы при p<0,05
Показано, что значение параметра Кv (коэффициент вариации) у пациентов группы I было ниже нормы в 1-е сутки на 10,92%. Ко 2-м и 3-м суткам исследования показатель Кv заметно повышался, но оставался ниже значений нормы на 6,05% и 3,22% (p<0,05) соответственно. На 4-е, 5-е и 6-е сутки уровень Кv приближался к норме (p>0,05). У пациентов группы II параметр Кv гемостазиограммы в первые 3 суток был ниже нормы на 31,84%, 26,64% и 18,75% соответственно. К 4-м и 5-м суткам показатель Кv повышался, но оставался ниже нормы на 11,1% и 4,93% (p<0,05). На 6-е сутки исследования параметр Кv был в пределах нормальных величин. У пациентов III группы параметр Кv в первые 5 суток было ниже нормы на 48,02%, 40,41%, 33,15%, 27,43% и 19,01% соответственно. К 6-м суткам уровень параметра Кv увеличивался, но оставался ниже нормы на 9,01% (p<0,05).
Проведенные исследования выявили, что значение показателя σ (среднеквадратичное отклонение, которое характеризует статистически значимые колебания скорости эритроцитов) у лиц группы I в первые 2 суток был ниже нормы на 12,5% и 6,25% (p<0,05). На 3-и, 4-е, 5-е и 6-е сутки наблюдения параметр σ был в пределах нормы (p>0,05). Значение показателя σ у пациентов группы II в первые 2 суток было ниже нормы на 30,0% и 21,25% (p<0,05). На 3-и сутки исследования значение параметра σ увеличилось, но оставалось ниже нормального уровня на 8,75% (p<0,05). К 4-м, 5-м и 6-м суткам исследования параметр σ приближался к значениям нормы. У пациентов группы III показатель σ в первые 5 суток был ниже нормы на 56,25%, 47,5%, 36,25%, 26,25% и 22,5% (p<0,05) соответственно. К 6-м суткам наблюдения за больными параметр σ вырос и вплотную приближался к норме.
При проведении генетического исследования частот аллелей и генотипов полиморфизма синтазы оксида азота у пациентов с острым панкреатитом разных форм и здоровых лиц получили следующие результаты (табл. 1).
Таблица 1
Распределение полиморфизма eNOS (C774T) у больных с острым панкреатитом разной степени тяжести и здоровых лиц
|
Исследуемые группы |
Генотип и его частота |
Аллель и его частота |
|||||||||
|
СС |
n (%) |
СТ |
n (%) |
ТТ |
n (%) |
С |
n (%) |
Т |
n (%) |
||
|
Норма(n=45) |
n % |
28 (62,2%) |
14 (31,1%) |
3 (6,6%) |
35 (77,8%) |
10 (22,2%) |
|||||
|
Легкий ОП (n=50) |
n % |
24 (48,0%) |
19 (38,0%) |
7 (14,0%) |
33,5 (67,0%) |
16,5 (33,0%) |
|||||
|
ОП средней степени тяжести (n=50) |
n % |
16 (32,0%) |
25 (50,0%) |
9 (18,0%) |
28,5 (57,0%) |
21,5 (43,0%) |
|||||
|
Тяжелый ОП (n=50) |
n % |
15 (30,0%) |
23 (46,0%) |
12 (24,0%) |
26,5 (53,0%) |
23,5 (47,0%) |
|||||
Частоты генотипов С/С, С/Т и Т/Т в выборке обследованных доноров составили 62,2%, 31,1% и 6,6% соответственно. У больных легким ОП частоты генотипов С/С, С/Т и Т/Т составили 48,0%, 38,0% и 14,0%. У больных ОП средней степени тяжести частоты генотипов С/С, С/Т и Т/Т составили 32,0%, 50,0% и 18,0%, а с тяжелым ОП – 30,0%, 46,0% и 24,0% (табл. 1).
Таблица 2
Распределение полиморфизма eNOS (C774T) у больных острым панкреатитом
средней степени тяжести и здоровых лиц
|
Генотипы |
Случаи |
Норма |
χ2 |
p |
OR |
|
|
n=50 |
n=45 |
знач. |
95% CI |
|||
|
Генотип С/С |
0,320 |
0,622 |
9,14 |
0.01 |
0,29 |
0,12–0,67 |
|
Генотип С/Т |
0,500 |
0,311 |
2,21 |
0,96–5,13 |
||
|
Генотип Т/Т |
0,180 |
0,067 |
3,07 |
0,78–12,16 |
||
|
Аллель С |
0,570 |
0,778 |
9,23 |
0.002 |
0,38 |
0,20–0,71 |
|
Аллель Т |
0,430 |
0,222 |
2,64 |
1,40–4,98 |
||
В выборке больных ОП средней степени тяжести частоты аллелей С и Т достоверно отличаются от частот соответствующих аллелей у доноров (χ2 = 9,14, p= 0,01). Также выявлена ассоциация аллеля Т с риском развития панкреонекроза (OR=2,64, 95% CI (1,4–4,98)) (табл. 2). При этом отмечается ассоциация генотипов С/Т и Т/Т у пациентов с ОП средней степени тяжести с развитием тромбоза панкреатических сосудов и нарушением микроциркуляции поджелудочной железы, что утяжеляет течение заболевания и способствует развитию осложнений ((χ2 – 9,14, p – 0,01), (OR = 2,21, 95% CI (0,96 – 5,13)) и (OR = 3,07, 95% CI (0,78 – 12,16))) соответственно (табл. 2).
Таблица 3
Распределение полиморфизма eNOS (C774T) у пациентов острым тяжелым панкреатитом
и здоровых лиц
|
Генотипы |
Случаи |
Норма |
χ2 |
p |
OR |
|
|
n=50 |
n=45 |
знач. |
95% CI |
|||
|
Генотип С/С |
0,300 |
0,622 |
11,29 |
0,004 |
0,26 |
0,11–0,61 |
|
Генотип С/Т |
0,460 |
0,311 |
1,89 |
0,81–4,37 |
||
|
Генотип Т/Т |
0,240 |
0,067 |
4,42 |
1,16–16,87 |
||
|
Аллель С |
0,530 |
0,778 |
12,74 |
0,0004 |
0,32 |
0,17–0,61 |
|
Аллель Т |
0,470 |
0,222 |
3,10 |
1,65–5,85 |
||
При распределении пациентов с тяжелым ОП выявлено, что аллель Т ассоциирован с повышением риска нарушения микроциркуляции и развитием тромбоза ((χ2 – 12,74, p – 0,0004), (OR = 3,1, 95% CI (1,65 – 5,85)). При изучении генотипов С/Т и Т/Т, доказано, что они ассоциированы с расстройством микроциркуляции и развитием тромбоза ((χ2 – 11,29, p – 0,004), (OR = 1,89, 95% CI (0,81 – 4,37)) и (OR = 4,42, 95% CI (11,6 – 16,87))) соответственно (табл. 3).
При изучении процессов ПОЛ выявлено, что содержание ДК в плазме крови у пациентов группы I было повышено в первые 4 суток наблюдения на
95,23%, 61,9%, 33,3% и 4,76% (p<0,05). Установлено, что уровень ДК к 5-м и 6-м суткам был в пределах нормы. У больных группы II концентрация ДК была выше нормы в первые 4 суток на 123,8%, 90,47%, 66,6%, 47,61% (p<0,05) соответственно. На 5-е сутки наблюдения показатель ДК уменьшался, но оставался выше нормы на 14,28% (p<0,05). Этот же показатель к последним суткам был в пределах нормы. Уровень ДК у пациентов группы с острым тяжелым панкреатитом достоверно превышал значения нормы на всех сроках исследования на 142,85%, 128,57%, 114,28%, 85,71%, 61,9% и 38,09% (p<0,05) соответственно.
При проведении исследования оказалось, что показатель МДА (ТБК-активные продукты) у больных острым панкреатитом легкой формы достоверно увеличивался в первые 4 суток наблюдения на 81,81%, 63,6%, 27,2% и 13,63% (p<0,05) соответственно, а к 5-м и 6-м суткам был в пределах нормы. Содержание ТБК-активных продуктов у лиц группы II было выше значений нормы в первые 3 суток на 115,0%, 85,0% и 65,5% (p<0,05) соответственно. На 4-е и 5-е сутки исследования содержание ТБК-активных продуктов было ниже первоначального, но выше нормы на 45,0% и 15,0% (p<0,05). При этом к 6-м суткам показатель вплотную приближался к норме. У пациентов группы III концентрация ТБК-активных продуктов достоверно превышала значения группы нормы на всех этапах периода исследования на 145,0%, 120,0%, 90,0%, 60,0%, 45,0% и 25,0% соответственно.
При легкой степени тяжести ОП (I группа) активность фосфолипазыА2 (ФЛ А2) у исследуемых лиц существенно изменялась. Так, на 1-е и 2-е сутки стандартного лечения активность ФЛ А2 была выше нормы на 221,1% и 144,4% (p<0,05). В последующие сутки (3-и и 4-е) наблюдалось заметное снижение активности фермента, однако значение оставалось выше нормы на 88,8% и 33,3% (p<0,05) (рис. 2). К последующим суткам наблюдения активность ФЛ А2 была в пределах значений нормы. Динамика показателя ФЛ А2 у пациентов ОП средней степени тяжести (II группа) была следующей. Отмечено достоверное ее повышение в течение первых 4 суток на 336,6%, 228,8%, 177,7% и 77,7% (p<0,05) соответственно. На 5-е сутки активность ФЛ А2 значительно снижалась, но оказалась выше нормы на 33,3% (p<0,05). На 6-е сутки показатель ФЛ А2 соответствовал норме (p>0,05). У пациентов с острым тяжелым панкреатитом (III группа) активность ФЛ А2 в периоды наблюдения была повышена на 466,6%, 377,7%, 277,7%, 211,1%, 166,6% (p<0,05) соответственно. На 6-е сутки активность ФЛ А2 снижалась, но оставалась выше значений нормы на 55,5% (p<0,05) (табл. 5) (рис. 2).
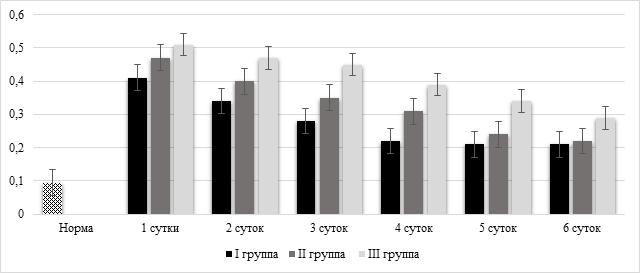
Рис. 2. Динамка активности фосфолипазы А2 в плазме крови
больных острым панкреатитом разной степени тяжести
Подчеркнем, что у 12 больных острым тяжелым панкреатитом в ранние сроки наблюдения не происходило существенного улучшения микроциркуляции и уменьшения активности липопероксидации и фосфолипаз. У этих пациентов регистрировалось прогрессирование заболевания, что потребовало хирургических вмешательств.
Выводы. Таким образом, анализ полученных данных свидетельствует о том, что по мере утяжеления острого панкреатита отмечается ухудшение микроциркуляции. Указанный патофизиологический процесс сопряжен с активизацией оксидативного стресса. Особенно выраженными указанные расстройства были у больных при тяжелой форме болезни, что, безусловно, повышает риск микротромбообразования.
Установлено, что отмеченные микроциркуляторные отклонения сопровождаются полиморфизмом генов NOS3 и C774T, которые участвуют в патогенезе эндотелиальной дисфункции, от которой во многом зависит состояние микроциркуляции. Полученные данные дают основание утверждать, что в патогенезе последней у больных ОП большое значение имеет чрезмерная активность перекисного окисления мембранных липидов и фосфолипаз, приводящая к мембранодестабилизирующим явлениям, в том числе со стороны эндотелиальных клеток.
Отмечено, что указанный спектр расстройств сопряжен с прогрессированием структурно-функциональных нарушений со стороны тканей поджелудочной железы, что диагностировано по данным УЗ-исследований и компьютерной томографии. У этой группы больных стандартизированная консервативная терапия оказалась не всегда эффективной. У 12 (24%) пациентов потребовалось проведение хирургических вмешательств: на первом этапе в большинстве лапароскопическое санирование и дренирование брюшной полости, далее по показаниям – дренирование жидкостных парапанкреатических и параколических образований.



