В современном мире нанотехнологий и быстрого развития науки проблема функционального повреждения центральной нервной системы (ЦНС) обсуждается не только в узких профессиональных кругах, но и среди лиц, не связанных с медициной. Состояние ЦНС, с одной стороны, является следствием сложного взаимодействия всего организма с внешней средой, а с другой - представляет собой результат пространственно-временных взаимодействий. Все формы деятельности мозга можно рассматривать как определенные функции ЦНС, и одной из ее важных характеристик является способность поддерживать внутреннее равновесие во всем организме. По исследованиям специалистов по нейрофизиологии, под воздействием операционной травмы и анестезии могут возникнуть угрожающие для жизни состояния в виде: судорожного синдрома, злокачественной гипертермии, инсульта и т.д., но и условно малозначимые осложнения, которые снижают уровень жизни пациентов (изменения цикла «сон-бодрствование», когнитивные расстройства и другие). Одним из таких, весьма часто встречаемых, осложнений является послеоперационная когнитивная дисфункция (ПОКД), под которой в настоящее время принято понимать расстройство, развивающееся в ранний и сохраняющееся в поздний послеоперационный период. Когнитивная дисфункция изначально была следствием использования искусственного кровообращения. Хотя заболеваемость ПОКД в ближайшем послеоперационном периоде может быть выше после длительных оперативных вмешательств, например кардиохирургических операций, то через 3 месяца заболеваемость сравнивается с внесердечными операциями. Причины возникновения ПОКД до сих пор не изучены, но достоверно известно влияние глубины анестезии, длительности оперативного вмешательства, эпизоды гипотензии и гипоксемии во время операции, приводящие к повреждению стенок церебральных сосудов на уровне микроциркуляторного русла, нарушению обмена внутриклеточного кальция, разобщению ассоциативных и нейромышечных связей структур головного мозга. Считается, что механизм действия общей анестезии реализуется в коре головного мозга, в ретикулярной активирующей системе ствола мозга (ядра моста, среднего мозга и заднего гипоталамуса), торможение которой приводит к снижению восходящего активирующего влияния на кору больших полушарий мозга, а также в определенных структурах лимбической системы головного мозга (гиппокампе, базальных ядрах, миндалевидном теле, гипоталамусе, сосцевидном теле сorpus mamillare) и таламусе. Лимбическая система участвует в регуляции функций внутренних органов, обоняния, инстинктивного поведения, эмоций, памяти, сна, бодрствования: гиппокамп необходим для формирования долговременной памяти; миндалевидное тело - агрессия и осторожность, страх; гипоталамус регулирует цикл сна и пробуждения, автономную нервную систему через гормоны, кровяное давление и сердцебиение, голод, жажду, половое влечение; сосцевидное тело участвует в формировании памяти. Все вышеперечисленные структуры ЦНС в условиях общей анестезии изменяют свою функциональную активность, и это может приводить к различным когнитивным нарушениям, которые усугубляются при глубокой депрессии ЦНС и во время длительного наркоза [1] Последовательными факторами риска ПОКД является возраст и более низкий изначальный коэффициент интеллекта (IQ). Актуальность этих двух факторов не должна оставаться незамеченной, поскольку они также являются достаточно существенными при исследовании MCI и деменции в общей популяции. Области, которые требуют дальнейшего исследования, включают базовые когнитивные траектории индивидуума, воспалительные реакции, связанные ПОКД. Клинически он проявляется нарушениями памяти и других высших нервных функций головного мозга (мышление, речь). В это же понятие входят трудности концентрации внимания, запоминания и восприятия новой информации. Принято различать раннюю ПОКД – 3-7-е сутки послеоперационного периода, промежуточную – недели и месяцы после анестезии и долгосрочную ПОКД (стойкая или пролонгированная) – годы после анестезии [2]. Определенно доказано влияние возраста на частоту развития когнитивного дефицита в послеоперационном периоде [3]. Вероятность возникновения ПОКД и других «условно малозначимых осложнений» у возрастных пациентов особенно велико в первую неделю после оперативного лечения (до 50-80%) и снижается до 30% через два месяца. Но, несмотря на кажущуюся положительную динамику, у 40% пациентов через 5 лет сохраняются поздние когнитивные нарушения [4]. В то же время следует признать, что это состояние может встречаться и в более молодом возрасте и носить временный характер. [5; 6]. По другим данным, стойкий когнитивный дефицит в средневозрастной группе достигает 14% случаев [7]. Основные факторы развития ПОКД могут быть квалифицированы по следующим направлениям: 1) дооперационное состояние здоровья (ASA III-IV группа риска) и ментальный статус (отсутствие деменции, депрессии, наркотической и алкогольной зависимости и другой органической патологии), а также исходно низкие базовые знания; 2) хирургические риски, связанные с объемом и длительностью операцией, возможными интра- и послеоперационными осложнениями в виде кровопотери, различных видов эмболии, анемии; 3) собственно влияние анестезии и средств, используемых во время анестезии; 4) больные с хроническим болевым синдромом вне зависимости от возраста [8]. Каждый год в мире проводятся более 100 миллионов оперативных вмешательств с применением препаратов для общей анестезии, из которых в 25% регистрируются послеоперационные когнитивные расстройства, проявляющиеся в раннем или позднем периоде [9; 10]. На сегодня невозможно сделать однозначно верный вывод, какой вид анестезии или препарат может вызвать те или иные изменения функций центральной нервной системы. Данные многочисленных как отечественных, так и зарубежных исследований разнятся.
Целью нашего исследования являлось сравнение частоты возникновения ранней послеоперационной когнитивной дисфункции у пациентов молодого и среднего возраста, перенесших оперативное вмешательство в условиях внутривенной анестезии, в группах с использованием кетамина и пропофола.
Материалы и методы
В период с 01.02.2017 по 20.10.2017, в условиях урологического отделения областной клинической больницы № 3 города Челябинска, было обследовано 27 пациентов, которым оказывалось анестезиологическое и оперативное пособие. Исследование проведено после одобрения локального этического комитета, все больные дали письменное согласие на исследование. Критериями включения были возраст пациента 60 и менее лет, предполагаемая внутривенная анестезия, сопоставимое по планируемому объёму оперативное пособие, согласие пациента. Критериями не включения были отказ пациента от участия в исследовании, наличие декомпенсированных заболеваний со стороны сердечно-сосудистой, дыхательной, эндокринной систем организма, имеющиеся в анамнезе заболевания центральной нервной системы (острые нарушения мозгового кровообращения, травмы), психические заболевания, алкоголизм, токсикомания, наркомания. Критериями исключения послужили отказ пациента на любом этапе обследования, расширение объёма операции, потребовавшего перевода больного на общий вид анестезии, декомпенсация имеющейся соматической патологии либо возникновение острого состояния декомпенсации жизненно важных функций организма. По данным критериям исключений из исследования не было. Все больные на дооперационном периоде не отличались антропометрически, средний вес в группе с применением пропофола составил 76,53 кг, в группе с кетамином 78,33 кг. Риск анестезиологического пособия по шкале ASA (Шкала Американской ассоциации анестезиологов - American Association of Anaesthetists) у всех пациентов был II-III степени. Оценка по шкале MMSE (Mini Mental State Examination – мини-исследование когнитивного состояния) у обследуемых пациентов была выше 24 баллов. Методом простой слепой рандомизации пациенты распределены на две группы, которые достоверно не отличались по основным (возраст, пол, масса тела, длительность операции) критериям. Данные представлены в таблице 1.
Таблица 1
Общая характеристика пациентов
|
Критерий |
Пропофол (n= 13 человек) |
Кетамин (n= 14 человек) |
|
Возраст, лет, М±SD |
41,3±15,98 |
31±11,88 |
|
Пол, ж/м |
2 (15,38%)/11 (84,62%) |
3 (21,43%)/11 (78,53%) |
|
Длительность операции, мин, М ±SD |
43,46±9,44 |
40±10,95 |
|
Вес, кг, М ±SD |
76,38±15,19 |
79,64 ±19,18 |
Всем пациентам проводилась однотипная предоперационная подготовка: вечером накануне операции пациенты получали феназепам в дозировке 1 мг pe ros. За 30 минут до операции внутримышечно вводился раствор атропина сульфата 0,1% - 0,5 мл. При подаче больного в операционную производилась катетеризация кубитальной вены, катетер G18, без каких-либо технических трудностей и осложнений, проводилась инфузия кристаллоидных растворов в объёме 200-300 мл. Первой группе проводилась индукция пропофолом 10 мг/мл в дозе 1-2 мг/кг, поддержание пропофолом в дозе 0,5-1,0 мг/кг/мин. Второй группе пациентов проводилась анестезия с помощью кетамина: доза насыщения 1-1-1,5 мг/кг, поддержание 0,5 мг/кг/мин, уровень седации оценивался с помощью BIS-мониторинга (поддерживался на уровне 50-40%, индекс качества получаемого сигнала приближался к 100). Также в качестве дополнительных компонентов анестезии использовались фентанил 50 мкг/мл в дозе 3 мкг/кг, релиум 0,5% - 2,0 мл. Оценка параметров дыхания и гемодинамики проводилась с помощью непрямого измерения АД, электрокардиограммы, пульсоксиметрии периферической крови, существенных колебаний параметров во время операции не отмечено. Когнитивная функция оценивалась с помощью прогрессивных матриц Равена за сутки до операции и через 24 часа после операции. Тестирование проводилось в условиях ограничения времени (20 минут). Анализ проводился путем учета «сырых» баллов и перевода их в проценты, 95% и выше - I степень: особо высокоразвитый интеллект испытуемого; 75-94% - II степень: незаурядный интеллект; 25-74% - III степень: средний интеллект; 5-24% - IV степень: интеллект ниже среднего; 5% и менее - V степень: дефектная интеллектуальная способность. Результат тестирования всех пациентов до операции укладывался в степень III – средний уровень интеллекта; после операции один пациент из группы кетамина показал интеллектуальные способности ниже среднего, остальные остались в тех же градациях. Статистический анализ материала проводился с помощью программы SPSS версии 17.0. Описательная статистика проводилась с использованием параметрических критериев средней (М) и стандартного отклонения (SD). Результаты в независимых группах сравнивали с помощью U-критерия Манна – Уитни, в связанных выборках - с помощью W-критерия Уилкоксона. Достоверность принимали при p<0,05. Количественные данные представлены медианой и 25 и 75 процентилями. Порядковые данные представлены абсолютными числами и относительными частотами (%).
Результаты
До операции пациенты, помимо отсутствия различий в группах по антропометрическим показателям, достоверно не отличались ни по возрастным характеристикам, ни по результатам стартового тестирования. Повторим, все пациенты показали средний уровень интеллекта. Течение операционного периода также не имело существенных различий ни по времени, ни по глубине анестезии и каких-либо значимых колебаний со стороны дыхательной и сердечно-сосудистой систем. Результаты тестирования, проведенного через 24 часа, показали, что в группе больных, перенесших анестезию кетамином, достоверно ухудшились результаты, при этом в данной группе появился результат уровень интеллекта ниже среднего. Остальные пациенты остались в группе со средним уровнем интеллекта. Пациенты в группе пропофола свои показатели практически не изменили. Данные представлены в таблице 2.
Таблица 2
Результаты тестирования в зависимости от вида анестезии
|
Группа |
n |
Возраст |
Результативность до операции |
Результативность после операции |
W-критерий Уилкоксона, р = |
|
Кетамин |
14 |
29,5 [20;36,25] |
24 [21,5;25,25] |
22 [19,75;24,25] |
0,042 |
|
Пропофол |
13 |
48 [26;57] |
22 [20;25] |
22 [20;25,5] |
0,687 |
|
U-критерий Манна-Уитни, р = |
0,114 |
0,260 |
0,807 |
Медианы полученных результатов наглядно представлены на диаграмме.
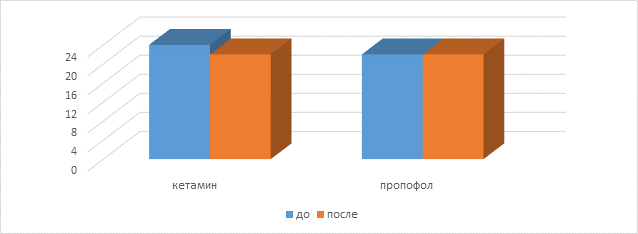
Сравнительные результаты тестирования в группах кетамина и пропофола
Обсуждение
Использование кетамина как диссоциативного анестетика обсуждается с первых опытов его применения. Схожесть его воздействия на NMDA-рецепторы (N-метил-D-аспартат) с фенциклидином, как обезболивающего средства, безусловно, является положительным моментом. Как известно, глутамат, воздействуя на эти же рецепторы, является возбуждающим нейромедиатором. Его избыточное действие, вызывающее перевозбуждение и гибель клетки – эксайтотоксичность. Кетамин, являясь антагонистом NMDA-рецепторов, обладает обратным глутамату действием, блокирует эти рецепторы, вызывая диссоциацию нейрональных связей, «душа удалена от своего тела», поэтому принято использовать кетамин в сочетании с седантами, вызывая скорее истинную седацию, чем диссоциативную. Влияние на NMDA-рецепторы всего головного мозга не равномерно, оно более выражено в височных и передних долях, которые и отвечают за когнитивную составляющую. От того, насколько после окончания анестезии «душа вернется в свое тело», и будет зависеть степень выраженности когнитивной дисфункции. По механизму действия пропофол отличается от кетамина, являясь, как предполагают, потенциатором гамма-аминомасляной кислоты в ГАМК-рецепторе, т.е тормозящим действием на центральную нервную систему. В ряде исследований, при применении пропофола в средних терапевтических дозах, малой или средней длительности, не отмечено необратимого повреждающего воздействия на нейроны.
В нашем исследовании проведено сравнение практически однотипных групп пациентов, полученные результаты заставляют еще раз задуматься о выборе препарата для внутривенной анестезии для планового оперативного вмешательства, учитывая риск возникновения ранней (до 7 суток после операции) когнитивной дисфункции.
Выводы
- использование пропофола для внутривенной анестезии не дает достоверного снижения когнитивной функции в раннем послеоперационном периоде;
- использование кетамина в качестве основного внутривенного анестетика достоверно снижает когнитивный потенциал пациента в раннем послеоперационном периоде;
- применение пропофола предпочтительнее кетамина для плановой внутривенной анестезии в качестве основного препарата.



