На протяжении последних лет сохраняется устойчивая тенденция к росту патологии костно-мышечной системы среди подростков. Резко вырос уровень заболеваемости дистрофической патологией заболеваний опорно-двигательного аппарата, ранним остеохондрозом, увеличилась частота переломов костей, вызванных неадекватно малой травмой. У 70% подростков наблюдаются замедление темпов созревания скелета и недостаточная минерализация костной ткани, согласно эпидемиологическим данным у 10–30% обследованных 1-й и 2-й групп здоровья отмечено снижение минеральной плотности костной ткани [1].
Генетически детерминированная костная масса при развитии скелета до 80% накапливается в детском и пубертатном возрасте, уровень потери плотности ткани у лиц старших возрастных групп зависит от ее пиковой массы, сформированной в молодом возрасте [2, 3]. Эти данные обусловливают повышенный интерес к проблеме развития патологии костной системы у подростков, которая является актуальной для современной педиатрии. Помимо наследственных факторов на формирование минеральной плотности костей оказывают влияние факторы внешней и внутренней среды [4]. С указанной позиции для своевременной диагностики ранних стадий заболеваний необходимы совершенствование биохимических методов оценки минеральной плотности костной массы у детей, отражающих процессы остеосинтеза и костной резорбции, а также исследование молекулярно-генетических маркеров. Это дает основание для поиска и идентификации генов – кандидатов предрасположенности к патологии костно-мышечной системы с помощью методов, которыми располагает молекулярная генетика на сегодняшний день. Также изучение взаимосвязей между биохимическими маркерами состояния костной системы и генами-кандидатами, участвующими в регуляции костного метаболизма и детерминирующими минеральную плотность костной ткани, вызывает обоснованный научный интерес. Подобные данные позволят более углубленно изучить патогенез нарушений костного метаболизма у подростков и тем самым назначить адекватную терапию, а значит, предупредить развитие патологии у лиц старших возрастных групп.
Обмен кальция и фосфатов костной ткани регулируется при участии витамина D путем взаимодействия его гормонально-активной формы кальцитриола 1,25(OH)2 D3 с рецепторами клеток. Рецептор к кальцийтриолу (витамину D, VDR) (или NR1I1) относится к семейству ядерных транскрипционных белков и принимает участие не только в процессе транскрипции, но и в механизме посттранскрипции, контролируемом микроРНК. В организме человека рецептор витамина D кодируется геном, локализованным в 12-й хромосоме (регион 12q13), который оказывает влияние на минеральную плотность костной ткани в организме и обусловленную развитием скелета длину тела [5–7]. Однако известно, что дефицит продукции гормонов щитовидной железы у детей приводит к прекращению роста и созреванию костей, тогда как тиреотоксикоз ускоряет эти процессы. А у взрослых тиреотоксикоз является важной и общепризнанной причиной вторичного остеопороза [8, 9].
Цель работы: изучить диагностическую значимость генетических (ген рецептора витамина D) и биохимических маркеров (гормоны щитовидной железы) минерального метаболизма и в оценке состояния костной системы у подростков.
Материал и методы исследования. Изучено состояние здоровья 78 подростков (36 мальчиков и 42 девочек) в возрасте от 15 до 17 лет, учащихся общеобразовательных учреждений г. Владивостока. Распределение по группам здоровья проводили в соответствии с общепринятыми рекомендациями Института гигиены детей и подростков. Для оценки физиологических параметров состояния костно-мышечной системы использован метод активного интервью согласно разработанной индивидуальной карте. Для молекулярно-генетического анализа использованы образцы ДНК, извлеченные из лейкоцитов крови с помощью наборов для выделения «Экстра ДНК Био» («Алкор Био», Россия). Для определения полиморфных вариантов rs731236 c.1056 T/C гена внутриклеточного рецептора витамина D VDR методом ПЦР в реальном времени на амплификаторе модели PicoReal (США) использовали набор реагентов производства компании ООО «Генотехнология» (Россия).
Количественное выявление свободного тироксина в сыворотке крови проводили с помощью метода твердофазного иммуноферментного анализа (ИФА, набор реагентов «ТироидИФА-свободный Т4», Россия). Регистрация оптической плотности исследованных образцов проводилась на приборе Multiskan FC версия ESW 1.00.96 (Thermo Scientific, США) с помощью программы «BiometraBDA/BioDocAnalyze» (Biometra, США). В методе использован вариант конкурентного твердофазного иммуноферментного анализа, при котором устанавливается равновесие между конъюгатом и свободным тироксином образца в процессе связывания с антителами, иммобилизированными на внутренней поверхности лунок планшета. Количество связанного антителами конъюгата обратно пропорционально количеству свободного тироксина в исследуемом образце, количество которого определяли на основании калибровочного графика. Аналогично было изучено содержание трийодтиронина («ТироидИФА-трийодтиронин», Россия) и тироксина в сыворотке крови (ТироидИФА-тироксин, Россия).
Методы статистической обработки, применяемые в работе для оценки достоверности результатов, проводились в Microsoft Excel с помощью сводных таблиц и описательных статистик из подключаемого пакета анализа Statistika 10.0 для персонального компьютера. Описательный анализ включал определение среднего арифметического значения, стандартного отклонения, ошибки среднего значения (m) при вычислении критерия [C1] Стьюдента. Для изучения влияния фактора на риск развития патологии костно-мышечной системы у подростков рассчитывали критерий Фишера (F) на основе четырехпольной таблицы сопряженности исходя из количества исследуемых. Использовали известные графические приемы для выражения статистических данных. Критический уровень значимости (р) при проверке статистических гипотез в исследовании принимался равным 0,05.
Результаты исследования и обсуждение. Согласно нашим данным из 78 человек в первую группу здоровья вошли всего два человека, остальные были отнесены ко второй (2,3% и 97,7% соответственно). Правильная осанка была выявлена у 63% детей, причем у мальчиков этот показатель преобладал и составлял 73% против 54% у девочек. Гиперкифоз наблюдался у девочек чаще, чем у мальчиков: 15% против 9%, так же как и выпрямленная осанка – 22% против 14%. Х-образная форма ног преобладала у девочек и встречалась в 25% случаев, а у мальчиков – в 19%.
Согласно генетическому тестированию обследуемые были распределены на группы соответственно распределению аллелей полиморфного маркера rs 731236 T/C гена внутриклеточного рецептора витамина D VDR на следующие генотипы: Т/С, С/C, T/T (табл. 1). Первую группу составили 52 человека (66,7%), вторую – 10 человек (12,8%), третью – 16 человек (20,5%).
Таблица 1
Распределение полиморфизма гена рецептора витамина D (VDR)
согласно возрасту и полу обследуемых
|
Распределение аллелей гена рецептора к витамину D |
Возраст, пол и число обследованных |
Всего, соответственно полу |
Всего |
||||||
|
15 |
16 |
17 |
М |
Ж |
|||||
|
М |
Ж |
М |
Ж |
М |
Ж |
||||
|
Гомозиготный генотип С-С |
1 |
2 |
3 |
2 |
1 |
1 |
5 |
5 |
10 |
|
Гомозиготный генотип Т-Т |
2 |
4 |
2 |
6 |
- |
2 |
4 |
12 |
16 |
|
Гетерозиготный генотип Т-С |
15 |
13 |
11 |
11 |
1 |
1 |
27 |
25 |
25 |
Согласно данным М.М. Костик с соавторами [5] распределение аллелей гена внутриклеточного рецептора витамина D VDR у детей с нормальной минеральной плотностью кости было следующим: носители Т/С[C2] -генотипа – 48%, носители С/C -генотипа – 8,7%, носители T/T-генотипа – 43,3%, что несколько отличалось от наших данных. Полиморфизмы в гене внутриклеточного рецептора витамина D VDR чаще встречались у девочек, чем у мальчиков (53,9% и 46,1% соответственно). Также у девочек в 3 раз чаще, чем у мальчиков (5,1% и 15,4% соответственно), встречалось преобладание гомозиготного аллеля T/T в гене VDR. Генотип С/С не зависел от полового признака.
Согласно группам, распределенным по наличию аллелей гена рецептора к витамину D, у подростков определяли концентрацию тироксина, свободного тироксина и трийодтиронина. Установлено, что у носителей генотипа Т/С три показателя по содержанию тироксина оказались ниже нормы (5,8%). У обследуемых с генотипом Т/Т четыре показателя ниже нормы (25%). Только у группы лиц с распределением аллелей С/С все показатели концентрации тироксина оказались в пределах нормы (100%, рис. 1). Вариационные ряды переменных были отнесены к нормальному распределению, следовательно, дальнейшая статистическая обработка данных проводилась с использованием критерия Стьюдента. Сравнение показателей гормона тироксина обследуемых в соответствии с генотипами Т/Т и С/С, Т/Т и Т/С и С/С и Т/С показало незначимые различия. Т-критерий Стьюдента был равен 0,16 (p=0,875793), 0,09 (p=0,926677) и 0,28 (p=0,780032) соответственно при критическом значении t-критерия Стьюдента 2,064 (р = 0,05).
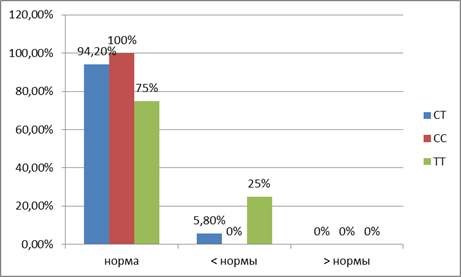
Рис. 1. Изменение концентрации тироксина при различных генотипах рецептора витамина D (VDR)
Взаимосвязь между показателями концентрации гормонов щитовидной железы у подростков и распределением соответственно генотипам рассчитывалась с помощью точного критерия Фишера. В качестве нулевой гипотезы нами было принято утверждение, что риск развития патологии костно-мышечной системы не зависит от концентрации гормонов. Критическим уровнем значимости была принята величина 0,05. При превышении рассчитанного критерия Фишера его критического значения принималась нулевая гипотеза.
При исследовании влияния уровня концентрации тироксина на риск развития патологии костно-мышечной системы у подростков в зависимости от генотипа установлено, что характер связи между генотипами Т/Т и Т/С гена VDR и изменением концентрации тироксина ниже нормального значения наблюдается относительно сильный, так как значение критерия Фишера (F) было меньше значения критического уровня значимости (F >0,05 ед.) и составило 0,0218 соответственно при уровне значимости 0,05 (табл. 2). Это означает, что в данном случае принимается альтернативная гипотеза и делается вывод о наличии прямой взаимосвязи между уровнем концентрации тироксина и риском развития патологии костно-мышечной системы подростков.
Таблица 2.
Критерий Фишера при вычислении степени влияния генотипа гена VDR на показатели концентрации гормонов щитовидной железы (p>0,05)
|
Генотип |
Тироксин |
Свободный тироксин |
||
|
Критерий Фишера |
Характер связи |
Критерий Фишера |
Характер связи |
|
|
С/C и T/T |
1,00000 |
Слабая |
0,10446 |
Средняя |
|
C/C и T/C |
0,02380 |
Относительно сильная |
1 |
Слабая |
|
T/T и T/C |
0,14754 |
Средняя |
0,0218 |
Относительно сильная |
По свободному тироксину были получены следующие данные. У носителей генотипа С/С два показателя содержания этого гормона были ниже нормы (20%), у обследуемых с генотипом Т/Т – один показатель (6,3%), тогда как у группы лиц с распределением аллелей Т/С все показатели концентрации свободного тироксина оказались в пределах нормы (100%, рис. 2). Сравнение показателей гормона свободного тироксина у лиц в зависимости от генотипа выявило незначимые различия. Так, t-критерий Стьюдента при генотипе Т/Т и С/С был равен 0,79 (p=0,434831) при критическом значении 2,064 (р = 0,05), при генотипе Т/Т и Т/С – 1,03 (p=0,304544), критическое значение 1,997 (р = 0,05), и генотип С/С и Т/С – 1,00 (p=0,323009), критическое значение 2 (р = 0,05).
При исследовании влияния уровня концентрации свободного тироксина на риск развития патологии костно-мышечной системы у подростков в зависимости от генотипа установлено, что характер связи между генотипами С/С и Т/С гена VDR и изменением концентрации свободного тироксина ниже нормального значения наблюдается относительно сильный (табл. 2). Это означает, что в данном случае принимается альтернативная гипотеза и делается вывод о наличии прямой взаимосвязи между уровнем концентрации свободного тироксина и риском развития патологии костно-мышечной системы подростков.
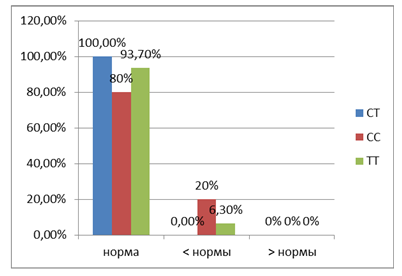 |
Рис. 2. Изменение концентрации свободного тироксина при различных генотипах рецептора витамина D (VDR)
По содержанию трийодтиронина в сыворотке крови получены следующие данные (рис. 3): у носителей генотипа С/С четыре показателя оказались ниже нормы (40%), у обследуемых с генотипом Т/Т – три показателя (18,8%) и два показателя – выше нормы (12,5%), у группы лиц с распределением аллелей Т/С восемь показателей концентрации трийодтиронина превышали показатели нормы (15,4%) и четыре показателя были ниже (7,7%). Сравнение показателей гормона трийодтиронина у лиц в зависимости от генотипа выявило незначимые различия. Для лиц с генотипами Т/Т и С/С t-критерий Стьюдента составил 1,84 (p=078970) при критическом значении 2,064 (р=0,05), для обследуемых с генотипами Т/Т и Т/С – 0,57 (p=0,569069), критическое значение – 1,997 (р = 0,05), и для подростков с генотипом С/С и Т/С – 2,73 (p=0,008398), критическое значение – 2 (р=0,05).
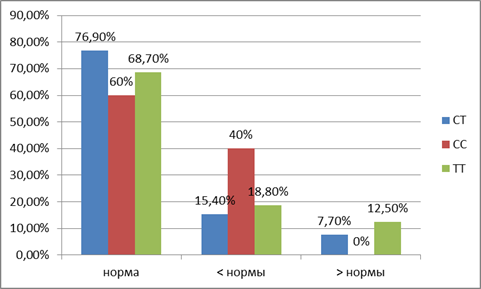
Рис. 3. Изменение концентрации трийодтиронина при различных генотипах рецептора витамина D (VDR)
Определение степени влияния показателей концентрации трийодтиронина на риск развития патологии костно-мышечной системы у подростков в зависимости от генотипа показало отсутствие прямой взаимосвязи (табл. 3).
Таблица 3
Критерий Фишера при вычислении степени влияния генотипа гена VDR на показатель концентрации трийодтиронина при уровне значимости p>0,05
|
Показатели трийодтиронина |
Генотип |
Критерий Фишера |
Характер связи |
|
< нормы |
С/C и T/T |
0,36917 |
Средняя |
|
C/C и T/C |
0,09089 |
Средняя |
|
|
T/T и T/C |
0,71202 |
Несущественная |
|
|
> нормы |
С/C и T/T |
0,50769 |
Средняя |
|
C/C и T/C |
1,00000 |
Слабая |
|
|
T/T и T/C |
0,62008 |
Несущественная |
Патология костно-мышечной системы у подростков является результатом взаимодействия многих наследственных (генетических) факторов и неблагоприятных факторов внешней среды. Основная роль в патогенезе заболевания отводится более 30 генетическим факторам, которые рассредоточены по крайней мере по 5 различным генным сетям как локального, так и интегрального порядка [2, 3]. Существенный прогресс в ранней диагностике и профилактике патологии костно-мышечной системы достигнут благодаря внедрению в лабораторную практику точных методов количественной денситометрии и разработке четких количественных критериев оценки состояния костно-мышечной системы. Несмотря на определенное противоречие данных по генетике остеопороза, результаты мета-анализов популяционных исследований позволили установить наличие по крайней мере 5 генов, аллельные варианты которых достоверно ассоциированы с низкой минеральной плотностью костной ткани. К ним относят гены коллагена COL1A1, кальцитонина CАLCR, остекальцина BGP и рецептора к витамину D VDR [10]. Тестирование аллельных вариантов этих генов открывает широкие возможности для профилактики патологии костной системы, так как позволяет эффективно выявлять лиц с высоким риском заболевания задолго до появления заболеваний опорно-двигательного аппарата. Эти методы принадлежат области превентивной медицины. Выявление гетерозигот и тем более гомозигот генотипа по патологическим аллелям гена рецептора витамина D3 (VDR), у которых вероятность развития остеопороза в 10–15 раз выше, чем в среднем в популяции, позволяет своевременно начать лечебные мероприятия по предотвращению этих заболеваний.
Однако накоплены данные, что дефектная продукция гормонов щитовидной железой приводит к развитию остеопороза, артрита и других заболеваний костно-мышечной системы [11]. Тиреотоксикоз является установленной причиной вторичного остеопороза, а аномальная сигнализация тиреоидного гормона недавно была идентифицирована как новый фактор риска для остеоартрита. Показано, что дисбаланс тиреоидных гормонов влияет на метаболизм и влечет за собой изменение минеральной плотности костной ткани. В случае повышения уровня тиреоидных гормонов при заболеваниях щитовидной железы отмечается ускорение процессов ремоделирования костной ткани, а именно костеобразования и резорбции, с преобладанием последней. Это влечет за собой развитие остеопении и остеопороза и дисбаланс кальций-фосфорного гомеостаза в виде гипокальциемии, гиперфосфатемии, гиперкальциурии. При гипотиреозе, напротив, наблюдается замедление костного метаболизма, процессов резорбции и костеобразования, снижение уровня кальция и фосфора в крови. Подводя итог, можно сказать, что гормоны щитовидной железы, как и витамин D, принимают активное участие в физиологической регуляции костного обмена, включая рост костей в пубертатном периоде и процесс костного ремоделирования в последующем, что указывает на необходимость изучения их состояния [C3] у здоровых лиц.
Выводы
1. Определено, что у 66,7% подростков Приморского края определяется гетерозиготный генотип Т/С rs 731236 гена TaqI рецептора к витамину D, гомозиготный Т/Т у 20,5% обследуемых и С/С у 12,8%.
2. Установлена относительно сильная связь между наличием гетерозиготного генотипа Т/С указанного гена и показателями содержания свободного тироксина (r=0,02380) и тироксина (r=0,0218).



