Одним из научных направлений кафедры нормальной анатомии Крымской медицинской академии им. С.И. Георгиевского является доклиническое исследование in vivo свойств ксеногенной цереброспинальной жидкости (КЦЖ), рассматриваемое как возможное перспективное сырье для выпуска нового иммунобиологического препарата [1; 2]. Предшествующее изучение состава и биологических свойств аллогенной, а затем и ксеногенной цереброспинальной жидкости, парентеральное ее введение экспериментальным животным убедительно доказали высокую степень коррекции различных патологических состояний. Серии проведенных экспериментов выявили отсутствие тератогенных, эмбриотоксических свойств КЦЖ, а также иммунопатологических реакций после ее введения [3].
При парентеральном введении КЦЖ выявлено ее влияние на рост и созревание животных, состояние кожи и ее трофики, семенников, яичников, и репродуктивную функцию. Исследовано влияние на эндокринные органы и органы иммунитета, дыхательную систему, опорно-двигательный аппарат, микроциркуляцию, гемодинамику, обмен липидов, эпилептическую активность головного мозга, течение лучевой болезни [4; 5]. В ходе исследований была доказана неоднозначность эффекта КЦЖ в разные возрастные периоды. Доказан «омолаживающий» эффект на органы дыхания, селезенку, надпочечники, тимус, периферические лимфоузлы [6; 7].
Особый интерес представляет изучение воздействия парентерального введения КЦЖ на сосудистые сплетения желудочков головного мозга, представляющих собой морфологический субстрат, ответственный за продукцию 70-80% эндогенного ликвора. Ранее нами было установлено, что парентеральное введение ксеногенного ликвора оказывает влияние на морфогенез сосудистых сплетений желудочков головного мозга крыс половозрелого и предстарческого возраста [8]. Мы поставили цель изучить влияние ксеногенной цереброспинальной жидкости на ультраструктурное строение сосудистых сплетений желудочков головного мозга новорожденных крыс при парентеральном введении.
Материал и методы исследования. Эксперимент проведен на 20 белых крысах линии Вистар периода новорожденности (первые сутки после рождения, средняя масса – 6-8 г). Животные распределены на две равные серии по 10 особей в каждой: 1 - контрольную (введение физиологического раствора), 2 – экспериментальную (введение КЦЖ). В обеих сериях препараты вводили десятикратно из расчёта 2 мл/кг массы животного один раз в 3 дня. Подбор дозы и кратности введения КЦЖ основывается на многочисленных экспериментальных данных Крымской ликворологической школы анатомов [9]. Животных содержали в стандартных условиях вивария при постоянной температуре и влажности воздуха со свободным доступом к воде и пище. Выведение из опыта проводили на 7-е и 30 сутки (по 5 особей на каждый срок) путем декапитации животных под эфирным наркозом. Исследования проводились в соответствии с Женевской конвенцией International Guiding Principles for Biomedical Research Inroling Animals [10]. Из исследуемой части органа вырезали кусочки размером около 1 мм3 и помещали их в фиксирующий 2,5% раствор глютарового альдегида на 0,1 М фосфатном буфере с рН 7,2–7,4. Фиксацию проводили на протяжении 12 часов при температуре -4 °С, после чего материал промывали в 0,1 М фосфатном буфере 3 раза по 10, 20, 30 минут и дофиксировали на протяжении одного часа 1% раствором тетраоксида осмия на 0,1% фосфатном буфере 1,5-2 часа. Кусочки заливали в капсулы смесью эпоксидных смол. Из полученных капсул на ультрамикротоме ULTRACUT изготавливали ультратонкие срезы с последующей окраской уранилацетатом и цитратом свинца. Срезы просматривали и фотографировали на трансмиссионном микроскопе РЕМ-106.
Результаты исследования и их обсуждение. Вне зависимости от срока эксперимента основное внимание при проведении электронно-микроскопического исследования уделяли главной функциональной единице сосудистого сплетения – эпителиоциту, а также ультраструктурным особенностям его взаимодействия с сосудами микроциркуляторного русла (преимущественно гемокапиллярами). В целом изучаемые структурные компоненты сосудистого сплетения сохраняли своё типичное строение.
В первой группе исследования к 7-му дню отмечалась следующая картина. В центре ворсинки находится гемокапилляр, выстланный эндотелиальными клетками. В просвете обнаруживаются эритроциты. Гемокапилляр окружают рыхло расположенные фрагменты коллагеновых волокон, которые образуют базальную мембрану. По ультрамикроскопическим данным капилляры относятся преимущественно к фенестрированному типу. Снаружи на базальной мембране располагаются эпителиоциты кубической и/или цилиндрической формы с плотными межклеточными контактами. На базальной поверхности клеток образуются хаотично расположенные выпячивания цитоплазмы и десмосомы умеренной электронной плотности, формирующие так называемый базальный лабиринт. На апикальной мембране эпителиоцита находятся неравномерно расположенные множественные микроворсинки и единичные реснички умеренной электронной плотности, имеющие различный угол наклона и различную высоту, что является характерной особенностью для этой группы исследования. Ядра эпендимоцитов сосудистых сплетений чаще эллипсоидной формы и занимают центральную часть клетки. У эпендимоцитов, расположенных в области верхушек ворсинок, локализация ядер центрально-базальная или базальная. Более вытянутые, имеющие полигональную форму ядра определяются у эпендимоцитов на основании ворсинок с незначительными выпячиваниями кариолеммы. По периферии кариолеммы находится прерывисто конденсированный электронно-плотный гетерохроматин; в кариоплазме диффузно располагается в виде мелких глыбок электронно-плотный эухроматин, среди которого отмечается овальной формы ядрышко также с высокой электронной плотностью. В апикальной части цитоплазмы эпендимоцитов обнаруживаются множественные мелкие электронно-плотные (осмиофильные) гранулы – рибосомы, свободно лежащие в виде очаговых скоплений, локализующиеся между митохондриями и секреторными гранулами, единичные лизосомы. Образование гранул в клетках эпендимы указывает на то, что клетка находится в процессе подготовки к секреции цереброспинальной жидкости (рис. 1).
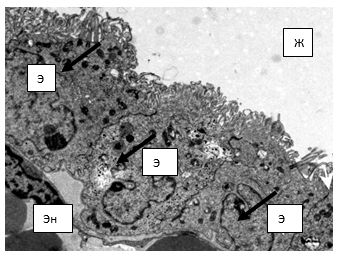
Рис. 1. Электронограмма. Эпителиоциты (Э) сосудистого сплетения. Эн – эндотелиоцит; Ж – просвет желудочка головного мозга; стрелки – секреторные гранулы. Первая серия, 7-е сутки. ТЭМ. Увеличение х3000
У экспериментальных крыс второй группы на 7-е сутки ультраструктурная картина сосудистого сплетения в целом соответствовала первой. В центре ворсинки находится гемокапилляр, окруженный рыхло расположенными фрагментами коллагеновых волокон, которые образуют базальную мембрану. На базальной мембране располагаются эпендимоциты кубической формы с рыхлыми межклеточными контактами, формирующими так называемый базальный лабиринт (рис. 2).
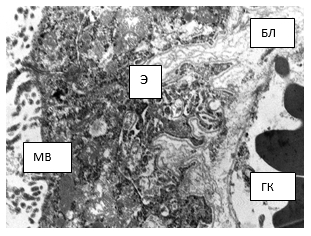
Рис. 2. Электронограмма. Участок эпителиоцита (Э) сосудистого сплетения, базальный лабиринт (БЛ). ГК – просвет гемокапилляра; МВ – микроворсинки на апикальной поверхности эпителиоцита. Вторая серия, 7-е сутки. ТЭМ. Увеличение х4000
Эпендимоциты имеют уплощенную форму. На апикальной мембране эпендимоцита находятся неравномерно расположенные множественные микроворсинки и единичные реснички умеренной электронной плотности, имеющие различный угол наклона и различную высоту (рис. 3). В апикальной части цитоплазмы эпендимоцитов обнаруживаются множественные мелкие электронно-плотные (осмиофильные) гранулы – рибосомы, свободно лежащие в виде очаговых скоплений, локализующиеся между митохондриями и секреторными гранулами, единичные лизосомы. Образование гранул в клетках эпендимы указывает на то, что клетка находится в процессе подготовки к секреции спинномозговой жидкости. На активность клетки указывают и множественные митохондрии с четкой визуализацией крист.
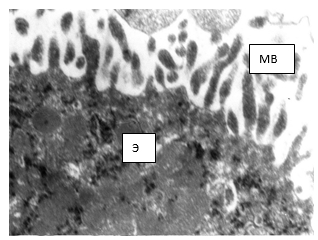
Рис. 3. Электронограмма. Апикальная мембрана эпителиоцита (Э) сосудистого сплетения. МВ – микроворсинки на апикальной поверхности. Вторая серия, 7-е сутки. ТЭМ. Увеличение х6000
Ядра эпендимоцитов сосудистых сплетений чаще эллипсоидной формы и занимают центральную часть клетки. У эпендимоцитов, расположенных в области верхушек ворсинок, локализация ядер центрально-базальная или базальная. Более вытянутые, имеющие полигональную форму, ядра определяются у эпендимоцитов на основании ворсинок с незначительными выпячиваниями кариолеммы. По периферии кариолеммы находится прерывисто конденсированный электронно-плотный гетерохроматин; в кариоплазме диффузно располагается в виде мелких глыбок электронно-плотный эухроматин, среди которого отмечается овальной формы ядрышко также с высокой электронной плотностью. В перинуклеарной зоне располагается пластинчатый комплекс Гольджи, сформированный параллельно лежащими мембранами. На канальцах эндоплазматической сети располагаются рибосомы. В капиллярах сосудистого сплетения эндотелиоциты выстилают внутреннюю поверхность. Цитоплазма эндотелиоцитов имеет более высокую электронную плотность, в которой присутствует небольшое количество органелл. Митохондрии эндотелиоцитов средней электронной плотности с параллельными кристами; цистерны гранулярного эндоплазматического ретикулума незначительно расширены, на мембранах которых практически отсутствуют рибосомы. Комплекс Гольджи редуцирован и представлен отдельно лежащими, беспорядочно ориентированными гладкими мембранами. Ядро эндотелиоцита овальной формы с наличием инвагинаций и конденсацией электронно-плотным кольцом гетерохроматина по периферии. Цитоплазматическая мембрана, обращенная к току крови, образует мелкие парусообразные выросты. В цитоплазме отростков эндотелиоцита находится небольшое количество микропиноцитозных пузырьков, заполненных электронно-прозрачной субстанцией.
На 30-е сутки исследования при электронно-микроскопическом исследовании наблюдается повышение функциональной активности эпендимоцитов во 2-й группе эксперимента по сравнению с 1-й. Они имеют цилиндрическую форму с большим количеством органелл. При этом ядра занимают базально-центральные отделы клеток, увеличиваются в размерах и приобретают многочисленные инвагинации кариолеммы по сравнению с предыдущим сроком исследования. Конденсация электронно-плотного гетерохроматина наблюдается больше вблизи кариолеммы. Центральная кариоплазма становится разряженной с очагами слабой электронной плотности. На апикальной поверхности эпендимоцитов определяются секреторные массы и неравномерно расположенные микроворсинки и увеличенное количество ресничек различных размеров, отходящие от базальных телец. Форма микроворсинок и ресничек более разнообразна: пальцевидная, булавовидная, раздвоенная.
Следует отметить увеличение во второй группе количества секреторных гранул с различной электронной плотностью, которые располагаются не только на апикальной части клетки, но и вдоль боковой части цитоплазмы. Митохондрии различных размеров, овальной формы с очаговой гомогенизацией крист. Отмечается набухание цистерн комплекса Гольджи, локализующегося в перинуклеарной зоне. Канальцы гранулярной эндоплазматической сети содержат небольшое количество рибосом. Количество свободно расположенных мелких осмиофильных рибосом в апикальной части клетки уменьшается. Десмосомальные межклеточные контакты более плотные по сравнению с предыдущим сроком исследования. Также уплотняется и базальный лабиринт, посредством которого хороидный эпендимоцит плотно контактирует с базальной мембраной капилляра (рис. 4).
Эндотелиоциты капилляров увеличены, имеют овальную форму с широкими периферическими отростками, крупные эухромные ядра с ядрышками и глубокими инвагинациями кариолеммы, электронно-прозрачный цитоплазматический матрикс с многочисленными пиноцитозными везикулами, свободными рибосомами, полисомами, мелкими митохондриями, профилями гранулярной цитоплазматической сети и аппарата Гольджи (рис. 4).
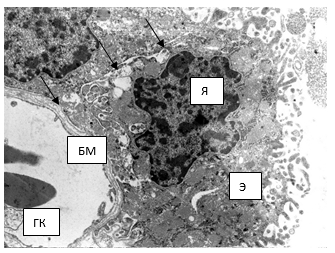
Рис. 4. Электронограмма. Структурный фрагмент ворсинки: эпителиоцит (Э); ядро (Я); базальная мембрана (БМ); гемокапилляр с эритроцитами (ГК); межэпителиальные контакты (стрелки). Вторая серия, 30-е сутки. ТЭМ. Увеличение х2800
Несмотря на существующие до сих пор разногласия, большинством исследователей признано, что цереброспинальная жидкость является результатом секреторной деятельности сосудистых сплетений. Вырабатываемая жидкость постоянно циркулирует в желудочках головного мозга, субарахноидальном пространстве мозговых структур, ликворопроводящих путях. При этом основной функцией ликвора является защита головного и спинного мозга от механических и гравитационных воздействий, обеспечение поддержки стабильного внутричерепного давления и водно-электролитного равновесия, а также участие в трофических и обменных процессах между кровью и мозгом. Нарушение секреции и оттока ликвора, особенно во внутриутробном и послеродовом периодах, приводит к разнообразным нарушениям, хорошо известным в неврологической практике. Введение КЦЖ приводит к возрастанию функциональной активности сосудистых сплетений, в первую очередь эпителиоцитов, проявляющейся усилением секреции цереброспинальной жидкости и активацией ультраструктур эндотелиоцитов, и ожидаемо приведет к торможению возрастной инволюции органа, проявляющейся утолщением стромы за счет огрубения волокон и увеличения их количества.
Заключение. В целом выявленные структурные изменения у крыс периода новорожденности свидетельствуют о стимулирующем эффекте парентерального введения КЦЖ на секреторную активность сосудистых сплетений на протяжении всего срока эксперимента.



