Актуальность. Снижение функциональной нагрузки поврежденной конечности при переломах приводит к изменению в ней кровоснабжения, уменьшению массы кости и развитию иммобилизационного остеопороза [1-4]. Иммобилизация оказывает негативное влияние и на суставной хрящ, околосуставные ткани, что предрасполагает к развитию остеоартрозов [5-7]. Проблема лечения остеоартрозов (ОА) весьма сложна. В консервативном лечении этой патологии, кроме лекарственной терапии, большая роль принадлежит физическим факторам, среди которых определенное место занимает гипербарическая оксигенация (ГБО). Применение ГБО при ОА, по мнению многих авторов [8-10], снижает выраженность болевого синдрома и улучшает функцию пораженных суставов [11; 12]. Однако влияние ГБО на дегенеративно-дистрофические изменения суставов до сих пор изучено недостаточно.
Цель работы – изучить влияние ГБО на структурные изменения хряща, развивающиеся в суставах неопорной конечности на фоне иммобилизационного остеопороза (ИОП).
Материалы и методы исследования. Исследовали коленные суставы 70 половозрелых крыс самцов линии Вистар массой 100-120 г, которым в возрасте 3-4 месяца предварительно моделировали ИОП путем ампутации верхней трети голени одной из задних конечностей. Содержание животных осуществлялось в условиях вивария при температуре воздуха 20-22 °С в световом режиме «день – ночь» на стандартном рационе. Исследования проводили согласно «Правилам проведения работы с использованием экспериментальных животных» (приложение по Приказу МЗ СССР № 755) и Европейской конвенции защиты животных, принятой в 1986 г. в Страсбурге. Операции проводили под внутримышечным наркозом. Выведение животных из опыта проводили согласно Международным правилам гуманного отношения к животным путем эвтаназии с использованием передозировки эфира.
Вследствие отсутствия нагрузки через 90-100 дней в ампутированной конечности формировался ИОП. Все животные были разделены на 2 группы. 1-я группа (n=25) получала ежедневно ГБО при давлении 1.5 АТА в барокамере «Ока-МТ». Курс ГБО составил 10 сеансов. 2-я группа (n=45) послужила контролем, животные этой группы не подвергались воздействию ГБО. В контрольной группе сроки наблюдения составили 30-60-90-120-180 и 240 дней после операции, в опытной группе животные наблюдались после завершения курса ГБО в течение 30, 60, 90 и 120 дней. Кроме того, 27 крыс составили интактную группу.
Экспериментальный материал от крыс составили коленные суставы c прилежащими к ним эпиметафизарными отделами бедра и большеберцовой кости на протяжении 20-25 мм. Материал фиксировали в 10%-ном растворе формальдегида, декальцинировали в 7%-ном растворе азотной кислоты и Biоdec R. Затем вырезали по определенной схеме костно-хрящевые блоки размером 1,5-2 см, обезвоживали их в спиртах восходящей концентрации, заливали в парафин, окрашивали гематоксилин-эозином, по Ван Гизону. Фотопротоколирование препаратов проводили с помощью видеонасадки VidiCam. Морфологический материал изучали с помощью световой микроскопии с использованием микроскопа Olympus (Япония). Морфометрическое изучение гистологических препаратов проведено с использованием программного обеспечения «ВидеоТест-морфология-4.0».
Материал для электронно-микроскопического исследования (суставной хрящ) измельчали бритвой, фиксировали в 2,5%-ном растворе глутаральдегида на 0.1М фосфатном буфере (pH 7,2–7,4) с последующей фиксацией в 1%-ном растворе осмиевой кислоты. Затем материал заливали в аралдит, изготавливали полутонкие и ультратонкие срезы, контрастировали их уранилацетатом и цитратом свинца по Рейнольду. Готовые препараты изучали на электронном микроскопе JEM-200. Морфологическое исследование суставов в динамике формирования иммобилизационного остеопороза проводили в сроки 30, 60, 90, 120, 240, 270 дней после операции.
Статистическую обработку полученных данных проводили с использованием электронных таблиц Microsoft Excel-2012 и программного обеспечения BIOSTAT (v 4.03). При обработке материала применяли непараметрические критерии, для межгрупповых сравнений использовали критерии Манна-Уитни, Краскела-Уоллиса. Различия показателей считали достоверными при р ≤ 0,05.
Результаты исследования показали, что уже в процессе моделирования ИОП отсутствие нагрузки конечности оказывало непосредственное воздействие на структуру хряща коленного сустава. У животных контрольной группы уже через 60 дней после ампутации голени в суставном хряще морфологически выявлялись дистрофические изменения хондроцитов и межклеточного вещества. На 90-120 день наблюдения, когда все характерные морфологические признаки ИОП присутствовали в неопорной конечности, в суставном хряще отмечались некрозы хондроцитов, дистрофические изменения межклеточного вещества, бесклеточные очаги, трещины и краевые узуры на его поверхности (рис. 1).
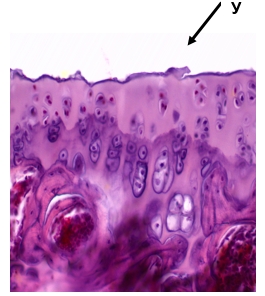
Рис. 1. 90 дней ИОП. Узуры на суставной поверхности хряща (У).
Окраска гематоксилином и эозином. Ув. х 200
В субхондральном отделе кости определялись дистрофические изменения костных трабекул. К 180-му дню наблюдения в хряще определялись распространенные дистрофические изменения, участки некроза различной формы и размеров, уплощение клеточных элементов, зональность хряща была нарушена (рис. 2).
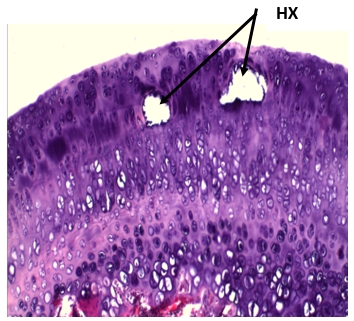
Рис. 2. 180 дней ИОП. Участки некроза хряща (НХ).
Окраска гематоксилином и эозином. Ув. х 100
 При электронно-микроскопическом исследовании в эти сроки установлено, что часть хондроцитов имела деструктивные и дистрофические изменения. Матрикс состоял из коллагеновых фибрилл, в цитоплазме определялись вакуоли, цистерны эндоплазматической сети, а в ядрах неравномерно распределенный хроматин. Через 240 дней на всей площади суставной поверхности нормальную зональность хряща не удалось обнаружить.
При электронно-микроскопическом исследовании в эти сроки установлено, что часть хондроцитов имела деструктивные и дистрофические изменения. Матрикс состоял из коллагеновых фибрилл, в цитоплазме определялись вакуоли, цистерны эндоплазматической сети, а в ядрах неравномерно распределенный хроматин. Через 240 дней на всей площади суставной поверхности нормальную зональность хряща не удалось обнаружить.
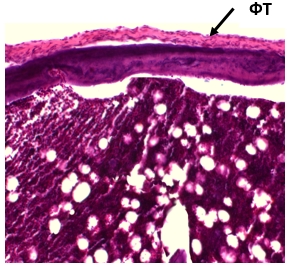
Рис. 3. 240 дней ИОП. Частичное замещение суставной поверхности фиброзной
тканью (ФТ). Окраска гематоксилином и эозином. Увеличение ×100
На отдельных его участках он был замещен фиброзной тканью, что свидетельствовало о выраженных явлениях ОА (рис. 3). В этот срок были отмечены в субхондральной кости участки атрофии костной ткани и очаги склерозированных трабекул, характерных для ОА второй стадии. В 1-й группе (крысы с ИОП, которые получили курс ГБО) морфологические изменения суставного хряща были значительно менее выраженными в сравнении с крысами контрольной группы (ИОП, без ГБО). Через 30 дней после окончания курса ГБО в суставном хряще определялись дистрофические явления межклеточного вещества, метахромазия, уплощение поверхностной зоны хряща, пустые лакуны. Через 60 дней после завершения ГБО узуры и дефекты в суставном хряще отсутствовали, тангенциальный слой его состоял из плотно прилегающих к поверхности коллагеновых волокон. Хондроциты имели нормальную форму (рис. 4). На большей площади зоны суставного хряща имели правильное гистологическое строение.
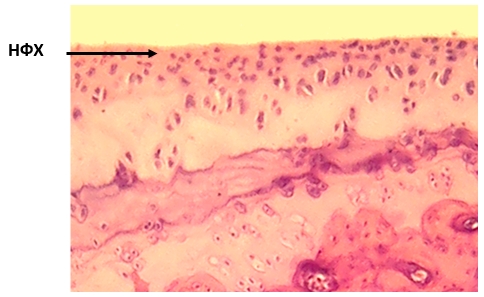
Рис. 4. 60 дней после ГБО. Нормализация формы хондроцитов (НФХ).
Окраска гематоксилином и эозином. Ув. х 200
Через 90 дней после завершения курса ГБО структура суставного хряща у крыс характеризовалась частичным восстановлением его зональности. На отдельных участках хряща сохранялось уплощение его поверхностного слоя (рис. 5).
К окончанию эксперимента (120 дней после ГБО) морфологические изменения свидетельствовали о практически полном восстановлении структуры хряща за исключением неравномерности его толщины на отдельных участках (рис. 6).
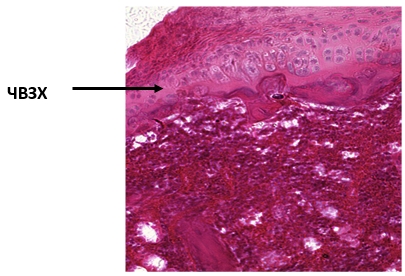
Рис. 5. 90 дней после ГБО 1,5 АТА. Частичное восстановление зональности хряща (ЧВЗХ).
Окраска гематоксилином и эозином. Увеличение х 200
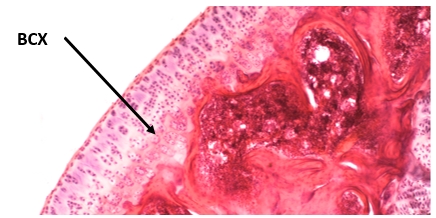
Рис. 6. 120 дней после сеансов ГБО. Восстановление структуры хряща (ВСХ),
толщина его неравномерная. Окраска гематоксилином и эозином. Увеличение × 200
Изучение динамики высоты суставного хряща выявило существенные отличия в исследованных группах животных. Сравнение высоты суставного хряща интактных крыс и крыс с ИОП показало, что уже на начальных этапах формирования ИОП было отмечено достоверное снижение этого показателя. Через 30 дней после ампутации голени высота суставного хряща была достоверно меньше (147, 73 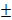 2,25 мкм), чем у интактных животных (156, 23
2,25 мкм), чем у интактных животных (156, 23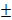 3,19 мкм, p
3,19 мкм, p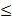 0,05). Наибольшие изменения были выявлены через 150 дней после ампутации: у крыс с ИОП высота хряща составляла 190,94
0,05). Наибольшие изменения были выявлены через 150 дней после ампутации: у крыс с ИОП высота хряща составляла 190,94 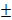 2,97 мкм, а у интактных животных 229,47
2,97 мкм, а у интактных животных 229,47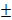 3,14 мкм, p
3,14 мкм, p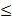 0,001.
0,001.
По данным морфометрии, высота суставного хряща у крыс с ИОП и у крыс с ИОП, получивших ГБО, достоверно изменялась в изученные сроки исследования у животных обеих групп (р≤ 0,05), причем динамика была схожей, но количественные показатели в группе с ГБО были достоверно выше во всех сроках наблюдения (рис. 7). После завершения курса ГБО статистически значимые различия между животными с ИОП и животными с остеопорозом, получившими ГБО, были выявлены во всех сроках наблюдения: 30 суток (p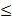 0,05), 60 суток (p
0,05), 60 суток (p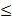 0,05). 90 суток (p
0,05). 90 суток (p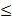 0,05), 120 суток (p
0,05), 120 суток (p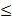 0,01). Установлено, что к концу эксперимента (120 дней) у животных, получивших курс ГБО, высота суставного хряща была на 6,4% достоверно больше, чем у животных контрольной группы, и составляла 207,74 мкм (показатель в контрольной группе в этот срок составлял 189,97 мкм).
0,01). Установлено, что к концу эксперимента (120 дней) у животных, получивших курс ГБО, высота суставного хряща была на 6,4% достоверно больше, чем у животных контрольной группы, и составляла 207,74 мкм (показатель в контрольной группе в этот срок составлял 189,97 мкм).
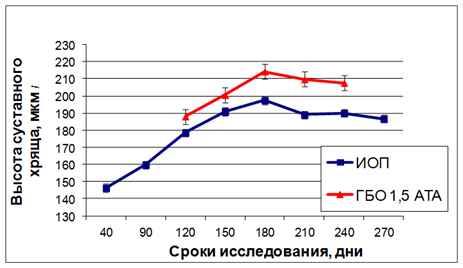
Рис. 7. Динамика изменения высоты суставного хряща у опытных животных
Обсуждение. В настоящем исследовании изучение влияния ГБО на суставной хрящ при ИОП показало, что применение гипербарической оксигенации позволяет в значительной мере снизить выраженность и распространенность дистрофических и деструктивных изменений в хряще, которые при дефиците функциональной нагрузки развиваются в неопорной конечности одновременно с формированием в ней ИОП. Было установлено, что ГБО обеспечивает улучшение структуры хряща, способствуя ликвидации в нем очагов некроза и трещин, а также увеличению высоты его покровного слоя. Ранее авторами [13-16] в эксперименте были изучены особенности костного ремоделирования и метаболизма костной ткани у лабораторных животных в условиях ИОП. Было доказано, что у крыс с ИОП применение ГБО оптимизирует процессы костного ремоделирования по сравнению с животными с ИОП, которые не подвергались воздействию этого фактора. ГБО обеспечивает активизацию процессов остеогенеза при одновременном снижении резорбции костной ткани за счет роста анаболических аэробных реакций, которые снижают выраженность патологических изменений в кости при ИОП и активизируют синтез костного матрикса. Эти исследования позволили заключить, что для коррекции нарушенного костного ремоделирования и нормализации метаболизма костной ткани в условиях ИОП целесообразно использовать ГБО терапию. Причем было доказано, что именно щадящий режим ГБО (не более 1,5 АТА) оказывает благоприятное воздействие на восстановление костной ткани. Положительный эффект гипероксии был установлен в настоящем исследовании и в отношении суставного хряща также в условиях режима 1,5 АТА.
Саногенетический эффект ГБО хорошо известен, он приводит к устранению или снижению интенсивности течения основного патологического процесса [17]. Именно этим и следует объяснить благоприятное влияние ГБО на патологически измененную кость при ИОП и ассоциированный с ним ОА. Результаты проведенного исследования позволяют полагать, что применение в клинической практике ГБО у пациентов с переломами, осложненными ИОП и ассоциированным с ним ОА, позволит расширить возможности немедикаментозного лечения остеоартроза. Такой патогенетический подход перспективен, на наш взгляд, так как будет способствовать одновременному снижению выраженности патологических симптомов как при ИОП, так и при ОА у травматологических больных.
Выводы
1. Гипокинезия вследствие снижения функциональной нагрузки приводит к одновременному развитию в ненагружаемой конечности иммобилизационного остеопороза и ассоциированного с ним остеоартроза крупных суставов.
2. Использование ГБО в щадящем режиме (1,5 АТА) снижает выраженность дистрофических и деструктивных процессов в суставном хряще, обеспечивает регресс патологических изменений, характерных для остеоартроза, и улучшение структуры хряща, приближая его к норме.



