ДВС-синдром является серьезным и довольно частым осложнением множества тяжелых критических состояний, что определяет его большую распространенность [1; 2]. Вследствие того, что в развитии синдрома задействованы практически все составляющие системы регуляции агрегатного состояния крови (свертывающая, противосвертывающая, фибринолитическая), предложено большое количество лабораторных тестов [1; 3]. Из всей совокупности предлагаемых лабораторных тестов известно, пожалуй, не более десяти, по абсолютным значениям которых можно с достаточной долей вероятности говорить о наличии ДВС-синдрома. Большинство из них относится к методам выявления в кровотоке продуктов паракоагуляции – специфичных маркеров генерализации внутрисосудистого свертывания и гиперактивности фибринолиза [4].
Поводом для настоящего исследования послужил обнаруженный нами факт увеличения массы фибринового сгустка в процессе проведения непрямого электрохимического окисления крови (НЭХОК) гипохлоритом натрия (ГХН) у больных с тяжелым хирургическим эндотоксикозом и гипокоагуляцией [5; 6]. Интересно, что у больных с нормо- и гиперкоагуляцией после сеансов НЭХОК подобных изменений не отмечалось. В связи с этим была изучена возможность использования гипохлорита натрия в качестве реактива для in vitro диагностики коагулопатии потребления у пациентов в критических состояниях, что и стало основной целью данного исследования.
Материал и методы. Раствор гипохлорита натрия готовили путем электролиза физиологического (0,9%) раствора NaCl на аппарате ЭДО-4 в режиме 5А 30 минут. Для определения концентрации гипохлорита натрия использовали метод объёмного оксидометрического титрования. Исследование проводилось в диапазоне доз ГХН от 150 до 1200 мг/л. Необходимые для исследования концентрации ГХН получали разведением маточного раствора физиологическим раствором NaCl. Кровь для исследования забиралась из периферической вены в пробирку с антикоагулянтом (3,8% цитрат натрия) в соотношении 9:1. Бедную тромбоцитами плазму получали центрифугированием крови при 3000 об/мин в течение 20 минут. Для изучения фибринообразования за основу взят метод определения концентрации фибриногена по Р.А. Рутберг. Полученную центрифугированием цитратную плазму разливали по 1 мл в стеклянные пробирки и маркировали. До активации свертывания в плазму добавляли по 0,1 мл 0,9%-ного NaCl (контроль) или 0,015-0,12%-ных растворов ГХН (опыт) с последующей инкубацией в течение 30 минут при комнатной температуре. Коагуляцию активировали введением 0,1 мл 5%-ного хлористого кальция. Через 1 час инкубации при 37 °С оценивали результат. Оценивались время образования сгустка, внешний вид (цвет, прозрачность, размер), консистенция (эластичность, фрагментируемость), сухая масса фибринового сгустка, растворимость сгустка в 5М мочевине и 2%-ной уксусной кислоте.
Лабораторные показатели АЧТВ и МНО определялись с помощью коагулометра «Amelung КС 4 Delta» (Tcoag, Ирландия), содержание тромбоцитов подсчитывалось вручную в камере Горяева, Д-димер измерялся с помощью набора для количественного определения на aнализаторе RAMP, РФМК определялись с помощью ортофенантролинового теста [3].
Результаты и их обсуждение
Конечную стадию свертывания крови условно разделяют на 3 этапа [3]. На первом, ферментативном, этапе под действием тромбина происходит последовательное отщепление от фибриногена четырех фибринопептидов с образованием мономеров фибрина, способных соединяться с подобными себе молекулами. Второй этап представляет собой спонтанную (неферментативную) сборку мономеров фибрина в димеры (2 молекулы) и олигомеры (от 3 до 10 молекул) фибрина. Образующийся на этой стадии фибрин хорошо растворяется в 5-7 М мочевине или 2%-ной уксусной кислоте, в связи с чем получил название растворимый фибрин S (solubile). На третьем этапе под влиянием фактора XIII (плазменной трансглутаминазы), которая активируется тромбином в присутствии ионов кальция, в фибрине происходит образование дисульфидных связей между α- и β-цепями, что делает его нерастворимым в мочевине и уксусной кислоте - фибрин I (insolubile) [3; 7].
Изучение действия гипохлорита натрия на образование фибрина в плазме здоровых доноров
Эксперимент выполнен с кровью пяти здоровых доноров. Во всех пробах без ГХН (контроль) визуально наблюдалось своевременное образование полноценного фибринового сгустка. Взвешивание в данных пробах максимально высушенного остатка подтвердило нормальные значения концентрации фибриногена (рис. 1). Несмотря на отсутствие заметных отличий во времени образования сгустка, консистенция фибрина в опытных образцах имела отличия от контроля и четко определялась концентрацией добавленного ГХН. Начиная с концентрации ГХН 300 мг/л наблюдали дозозависимые визуальные изменения структуры образующегося сгустка.
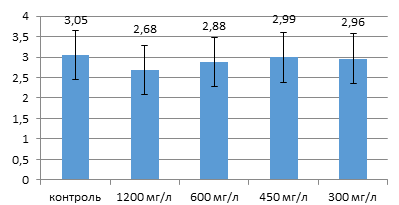
Рис. 1. Сухая масса фибриновых сгустков (г/л) в плазме здоровых доноров (n=5)
В пробах с максимальной концентрацией ГХН наблюдалось образование фибринового геля без каких-либо признаков последующего уплотнения и формирования полноценного белого сгустка. С увеличением концентрации ГХН сгусток становился более рыхлым, терял эластичность и при механическом воздействии легко фрагментировался. Однако результаты взвешивания показали, что масса сухого фибринового сгустка в опытных образцах достоверно не отличалась в сравнении с контролем (р>0,05) (рис. 1).
Своевременное образование фибринового сгустка в пробах с ГХН позволяет утверждать, что ГХН в дозе до 1200 мг/л не оказывает заметного влияния на динамику образования тромбина и процесс его ферментативного действия на молекулы фибриногена. Незначительное изменение сухой массы сгустков по сравнению с контролем показало отсутствие влияния ГХН на процесс самосборки мономеров в протофибриллы фибрина.
Проведена проба на растворимость в 5М мочевине и 2%-ной уксусной кислоте, сформированных в опытных образцах и в контроле фибриновых сгустков. Сгустки выдерживали в указанных растворах при комнатной температуре в течение 24 часов. Видимой динамики по размерам сгустков в течение суток не наблюдалось (рис. 2).

Рис. 2. Динамика размеров сгустков по результатам пробы на растворимость (А) в мочевине, (Б) в уксусной кислоте
Пробы на растворимость показали отсутствие влияния ГХН на стабилизацию протофибрилл и образование нерастворимого фибрина в плазме здоровых доноров.
Изучалась динамика фибринообразования в богатой (ТП) и бедной тромбоцитами (БТП) плазме (рис. 3). В серии с бедной тромбоцитами плазме ретракция сгустков не наблюдалась (рис. 3Б). В плазме с тромбоцитами наблюдалась быстрая ретракция фибринового сгустка, без четкой зависимости от наличия и концентрации гипохлорита натрия (рис. 3А). Причем в серии с ТП в двух опытных пробах наблюдалась более отчетливая и ранняя ретракция сгустков по сравнению с контролем, что однозначно исключает ингибирующее влияние ГХН на ретрактивную функцию тромбоцитов. Отличия по массе фибрина между данными сериями были статистически не значимыми.

Рис. 3. Влияние ГХН на фибринообразование в богатой (А) (верхний ряд) и бедной (Б) тромбоцитами плазме (нижний ряд)
Таким образом, полученные данные дают возможность утверждать об отсутствии заметного влияния ГХН в изучаемых концентрациях на формирование нерастворимого фибрина и, следовательно, на процесс образования протромбиназы и тромбина в плазме здоровых доноров. Однако остается неясным механизм дозозависимого нарушения ретракции сгустка, так как предположение об угнетающем действии ГХН на ретрактивную функцию тромбоцитов не подтвердилось в сравнительном опыте с богатой и бедной тромбоцитами плазмой. По всей видимости, взаимодействие ГХН с фибриногеном приводит к увеличению адсорбционной связи его молекул с молекулами воды, что препятствует реализации ретрактивной функции, но существенно не влияет на формирование и активность центров полимеризации.
Влияние гипохлорита натрия на массу коагулирующего фибриногена при коагулопатиях различной природы
Изучено влияние ГХН на содержание фибриногена у пациентов с наиболее часто встречающимися видами приобретенных коагулопатий: дилюционной коагулопатией (ДКП) на фоне массивного кровотечения и ДВС-синдромом. ДКП травматического генеза диагностирована на основании клиники массивной кровопотери (более 30% ОЦК), требовавшей восполнения компонентами крови в сочетании с изменениями лабораторных показателей системы гемостаза (прежде всего, хронометрических коагулологических тестов). В эту группу было включено 5 пациентов. Группу пациентов с ДВС (n=4) составили пациенты с полиорганнной недостаточностью, развившейся на фоне сепсиса (перитонит, панкреонекроз, тяжелая пневмония). В качестве критерия диагностики ДВС-синдрома использовали достаточно широко применяемую в настоящее время шкалу японской ассоциации критической медицины DIC JAAM [8]. ДВС-синдром диагностировали при сумме баллов 4 и более. Результаты тестов гемостазиограммы у пациентов различных групп приведены в таблице 1.
Таблица 1
Изменения тестов системы гемостаза на фоне коагулопатий различной природы
|
Группы пациентов |
|||
|
Контроль (здоровые) |
Дилюционная коагулопатия |
ДВС-синдром |
|
|
Балл по шкале DIC JAAM |
0 |
1,40±0,55 |
4,25±0,50 |
|
АЧТВ, с |
25,2+2,3 |
33,4+4,1 |
40,5+5,6 |
|
МНО, ед |
1,07±0,14 |
1,62±0,31 |
2,04±0,42 |
|
Тромбоциты, кл/мл |
284±18 |
192±32 |
116±28 |
|
Д-димеры, нг/мл |
121,2±13,2 |
216,5±27,1 |
419,3±48,4 |
|
Растворимые фибрин-мономерные комплексы, мг/л |
3,6±0,1 |
3,9±0,3 |
10,5±1,0 |
|
Фибриноген (по методу Рутберг), мг/л |
2342±254 |
1692±305 |
986+220 |
|
Фибриноген (в тесте с ГХН), мг/мл |
2394±196 |
1724±360 |
1275±240 |
|
Абсолютное изменение концентрации фибриногена в тесте с ГХН, мг |
+52 |
+32 |
+289 |
|
Число пациентов, у которых прирост концентрации ФГ был более 250 мг/мл |
1 |
0 |
3 |
У пациентов с дилюционной коагулопатией регистрировалось увеличение значений хронометрических коагуляционных тестов, незначительное снижение количества тромбоцитов и невыраженный рост уровня Д-димеров. Уровень РФМК не выходил за рамки нормальных значений. Концентрация фибриногена снижалась, но не достигала критических значений. В этой группе пациентов добавление к плазме растворов ГХН не приводило к увеличению массы сгустка.
В группе пациентов с коагулопатией потребления выраженность расстройств гемостаза была значительно большей. Наряду с увеличением АЧТВ и МНО, регистрировалось значимое увеличение Д-димеров и РФМК и снижение количества тромбоцитов. Концентрация фибриногена была снижена до 980±220 г/л. В данной группе добавление ГХН к плазме приводило к росту концентрации фибриногена, причём у 3 из 4 пациентов увеличение концентрации было больше чем 0,25 г/л. Эта степень увеличения (более чем на 250 мг/л) эмпирически принята за практический уровень, имеющий диагностическое значение.
Данные наблюдения позволили предположить, что ГХН приводит к восстановлению коагуляционной способности фибриногена, блокированного вторичными антикоагулянтами, образующимися в процессе фибринолиза и внутрисосудистого свёртывания.
Для подтверждения данного предположения мы изучили фибринообразование на фоне ятрогенной коагулопатии, вызванной действием препаратов тромболитического действия. Тромболитическая терапия создает искусственное состояние гиперфибринолиза с целью восстановления тромботической или тромбоэмболической закупорки кровотока в критических состояниях, что сопровождается многократным увеличением плазменной концентрации продуктов лизиса фибрина и фибриногена [9; 10]. Был проведен эксперимент с плазмой трех больных острым нарушением мозгового кровообращения по ишемическому типу, получивших различные варианты тромболитической терапии. Кровь для исследования забиралась из периферической вены в интервале от 6 до 12 часов после окончания процедуры тромболизиса. В двух случаях с целью тромболизиса использовался препарат Актилизе (алтеплаза – тканевой активатор плазминогена) в дозе 80 мг; в одном – Метализе (тенектеплаза - рекомбинантный активатор плазминогена) в дозе 7000 ЕД. Результаты эксперимента представлены в таблице 2.
Таблица 2
Влияние ГХН на массу коагулирующего фибрина после тромболизиса
|
Терапия |
Фибриноген, г/л |
||||
|
контроль |
ГХН |
||||
|
1200 мг/л |
600 мг/л |
450 мг/л |
300 мг/л |
||
|
Актилизе |
2,1 |
4,9 |
6,0 |
6,3 |
5,0 |
|
Актилизе |
3,5 |
+ |
4,5 |
6,0 |
4,75 |
|
Метализе |
+ |
+ |
+++ |
+++ |
- |
Примечание: + - визуальная оценка фибринообразования.
Несмотря на нормальные значения концентрации фибриногена, визуальная оценка выявила заметно слабое фибринообразование во всех контрольных пробах. По сравнению с контролем, в большинстве опытных проб с Актилизе отмечалось как визуальное, так и гравиметрическое усиление фибринообразования (рис. 4). Практически во всех опытных пробах концентрация фибриногена существенно превышала значения контроля с максимумом в интервале доз ГХН 450-600 мг/л.

Рис. 4. Влияние ГХН на фибринообразование до (верхний ряд) и после (нижний ряд) тромболизиса Актилизе (80 мг). Слева направо: контроль, ГХН 1200 мг/л, ГХН 600 мг/л, ГХН 450 мг/л, ГХН 300 мг/л
В эксперименте с Метализе, ввиду малой массы образующихся сгустков, определить массу фибрина методом Рутберг не представлялось возможным, поэтому была проведена только визуальная оценка результатов. На рисунке 5 хорошо видно явное отличие от контроля в пробах 2 (ГХН 600 мг/л) и 3 (ГХН 450 мг/л).

Рис. 5. Влияние ГХН на фибринообразование после тромболизиса Метализе (7000 ЕД). Слева направо: контроль, ГХН 1200 мг/л, ГХН 600 мг/л, ГХН 450 мг/л
Интересно, что в двух опытных пробах с ГХН в концентрации 1200 мг/л увеличения образования фибрина не наблюдалось, а в одной уступало по интенсивности пробам с пониженными концентрациями окислителя. По всей видимости, существует различие тропности ГХН к различным молекулам фибриногенового пула, что определяет первоочередное окисление вторичных антикоагулянтов и улучшение коагуляционных свойств плазмы. Высокие концентрации ГХН приводят к окислению также и молекул нормального фибриногена, что объясняет наблюдаемое нарушение фибринообразования в пробах с концентрацией 1200 мг/л.
Выводы. Таким образом, результаты настоящего исследования позволяют сделать заключение, что при смешивании in vitro плазмы крови, содержащей продукты паракоагуляции, с растворами гипохлорита натрия наблюдается зависимое от дозы окислителя усиление свертывающей способности этой плазмы, выражающееся в увеличении массы коагулирующего фибрина. Данное умозаключение послужило основанием для разработки нового метода диагностики коагулопатии потребления [11].
Описание метода. Исследуемую кровь быстро забирают в чистую сухую пробирку с 1 мл 3,8%-ного цитрата натрия до отметки 10 мл, закрывают плотно пробкой и тщательно перемешивают многократным переворачиванием. Пробирку помещают в центрифугу на 10 мин при 3000 об/мин. Разделяют цитратную плазму на четыре сухие маркированные пробирки по 1 мл: одна контрольная, три опытные. В контрольную пробирку добавляют 0,1 мл 0,9%-ного раствора хлорида натрия (NaCl), в 1, 2 и 3-ю опытные пробирки по 0,1 мл 0,03%, 0,06% и 0,09%-ного раствора гипохлорита натрия (NaClO) соответственно. Пробирки перемешивают плавным вращением. Контрольную и опытные пробирки выдерживают при комнатной температуре в течение 30 мин. В контрольную и опытные пробирки добавляют по 0,1 мл 5%-ного раствора хлорида кальция (СаСl2). Пробирки перемешивают плавным вращением и помещают в термостат при 37 °С на 30 мин. Образовавшиеся в исследуемых пробирках фибриновые сгустки поочередно отжимают насухо на фильтровальной бумаге и взвешивают на лабораторных весах гравиметрическим методом Р.А. Рутберг. Результат взвешивания записывают и оценивают по следующей схеме. Для расчета берется один опытный образец с наибольшей массой полученного сухого фибрина. Определяют разность массы сухого фибрина в этой пробе и в контрольной пробе. При положительном значении разности от 0,25 г/л (минимальное значение достоверной воспроизводимости теста) проба считается положительной, что свидетельствует о наличии в изучаемой плазме продуктов паракоагуляции – маркеров ДВС-синдрома. С увеличением разности повышается достоверность лабораторной диагностики ДВС-синдрома.
По сумме результатов всех тестов с ГХН, проведённых как у пациентов с ДВС-синдромом, так и без него, были определены чувствительность и специфичность этого метода. Он оказался положительным у 3 из 4 пациентов, которым был выставлен диагноз ДВС-синдром по шкале DIC JAAM, чувствительность составила 75%. У пациентов, не имеющих ДВС-синдрома, ложноположительный результат был зарегистрирован в 1 случае из 9, таким образом, специфичность была равна 89%. Отметим, что количество наблюдений недостаточно для корректного суждения о диагностических возможностях метода, однако мы считаем, что благодаря своей простоте и доступности он может стать дополнением к набору методов диагностики ДВС-синдрома.



