Транскраниальная электростимуляция (ТЭС-терапия) – лечебный метод, позволяющий при помощи неинвазивного воздействия током определенных характеристик селективно стимулировать синтез и секрецию β-эндорфина [1]. Активация опиоидэргической системы обладает нейропротекторным, противовоспалительным, антиоксидантным, нейротрофическим и антигипоксическим эффектами [2]. Благодаря этому ТЭС-терапия оказывает благоприятное стресс-лимитирующее влияние на нейроиммуноэндокринную регуляцию и используется для лечения широкого круга заболеваний. Одной из важнейших характеристик благоприятного эффекта ТЭС-терапии является гомеостатический характер действия метода [1-3]. Стресс-лимитирующий потенциал ТЭС-терапии был выявлен во многих экспериментальных и клинических работах, однако вопрос о влиянии ТЭС-терапии на стресс-индуцированую экспрессию гена c-fos мононуклеарными лейкоцитами крови остается недостаточно освещенным [1-5]. Последняя рассматривается в литературе в качестве маркера стресса и провоспалительного статуса и используется для оценки выраженности психических заболеваний [6-8].
Особого внимания заслуживает вопрос о влиянии индивидуальной стрессоустойчивости на характер стресс-индуцированной экспрессии c-fos мононуклеарными лейкоцитами. Ранжирование по стрессоустойчивости является ключевым методологическим приемом исследований, посвященных стрессу. Хорошо известны физиологические отличия низко- и высокоустойчивых животных, к числу которых, например, относится разное медиаторное обеспечение стресс-респонсивных центров мозга [9]. Для исследований, посвященных ТЭС-терапии, эта разделение тем более важно, так как позволяет детализировать представления о гомеостатическом характере действия данного лечебного метода.
Цель работы
Изучение влияния ТЭС-терапии на характер стресс-индуцированной экспрессии гена c-fos мононуклеарными лейкоцитами крыс различной стрессоустойчивости.
Материалы и методы исследования
Объектом исследования были 50 взрослых белых нелинейных самцов крыс массой 200-250 г. Содержание животных, постановка, описание экспериментов и представление полученных результатов проводились в соответствии с требованиями Приказа № 199н МЗ РФ от 01.04.2016 г., рекомендациями ARRIVE (Animal Research: Reporting of InVivo Experiments, 2010) и MIQE (Minimum Information or Publication of Quantitative Real-Time PCR Experiments, 2009) [10; 11].
Период адаптации перед экспериментом для всех крыс составлял 7 дней. Животные интактной группы не включались в эксперимент. Забор материала производился в первый день после адаптации. Оценка выносливости, работоспособности и стрессоустойчивости остальных крыс производилась в первый день после адаптации при помощи модифицированного НЦБМТ РАМН (Научный центр биомедицинских технологий) теста вынужденного плавания (плавательного теста) [12]. Для этого стеклянный аквариум, квадратный в сечении (длина стороны 30 см), заполнялся водой (высота водного столба 40 см, температура воды 28 °C). К хвосту животного прикреплялся груз (10% от массы тела). Животное погружалось в аквариум и после утомления извлекалось из воды. Критериями утомления являлись отказ от плавания, невозможность всплытия на поверхность и адинамия более 10 секунд [12]. Оценка стрессоустойчивости осуществлялась по времени плавания до утомления. Животные, время плавания которых было меньше среднего или превышало среднее более чем на 35%, оценивались как низкоустойчивые и высокоустойчивые соответственно. Далее животные случайным образом разделялись на две группы: основную (ТЭС-терапия по 1 сеансу в день со 2-го по 6-й день, n=20) и группу сравнения (без ТЭС-терапии, n=20). Таким образом, были сформированы три группы: интактная, группа сравнения и основная. Две последние группы включали в себя подгруппы низко- и высокоустойчивых животных. ТЭС-терапия проводилась с помощью модифицированного двухпрограммного электростимулятора «ТРАНСАИР-03» (ООО «Центр транскраниальной электростимуляции», Санкт-Петербург). Продолжительность первого сеанса составляла 15 мин, всех последующих - по 30 мин. [13]. Параметры ТЭС-терапии для крыс представлены в таблице. В качестве подкожных электродов использовались булавки с антикоррозийным покрытием. Электроды располагались фронто-мастоидально (сдвоенный катод – в области лба над глазницами, сдвоенный анод – позади ушных раковин). Предварительно перед установкой электродов место их установки и сами электроды обрабатывались 0,05%-ным водным раствором хлоргексидина [13]. За исключением ТЭС-терапии, все релевантные условия содержания, манипуляции и процедуры, производимые над животными основной группы и группы сравнения, были идентичны.
На 7-й и 8-й дни моделировался комбинированный стресс. Для этого использовались модифицированный тест вынужденного плавания, производимый на 7-й день, и ортостатический стресс на 8-й день. Ортостатический стресс включал в себя фиксацию крыс в специальных футлярах из оргстекла (объем 0,75×10-3 м3) вниз головой под прямым углом к горизонтальной поверхности. Ортостатический стресс сочетался, таким образом, с иммобилизацией. Время пребывания в антиортостатическом положении составляло 45 минут.
Параметры электрического тока, использующегося при проведении ТЭС-терапии в режиме анальгезии у крыс
|
Частота, Гц |
Длительность импульса, мс |
Величина суммарного тока, мА |
|
70±2 |
3,75±0,25 |
1–2,5 |
Забор крови в объеме 2 мл производился через 2 часа после ортостатического стресса в вакуэты с ЭДТА (концентрация 2,7%). Перед этим животное наркотизировалось золетилом 0,8 мг на 100 г веса крысы в/м (Virbac, Франция) и ксиланитом 0,8 мг на 100 г веса крысы в/м («НИТА-ФАРМ», Россия) [13]. Глубина наркоза верифицировалась по угнетению роговичного рефлекса и исчезновению реакции на болевые раздражители.
Мононуклеарные лейкоциты выделялись градиентным центрифугированием. Для этого кровь (1 мл) разбавлялась 1 мл физиологического раствора и наслаивалась на фиколл-верографиновый градиент плотности (ρ=1087 кг/м3) в соотношении 1:1, после чего производилось центрифугирование в течение 20 минут при 2000 об/мин. Отбиралось интерфазное кольцо мононуклеаров. Клетки осаждались центрифугированием в течение 5 минут при 2000 об/мин с последующим удалением надосадочной жидкости.
Экспрессия гена c-fos оценивалась методом полимеразной цепной реакции (ПЦР) в режиме реального времени. Выделение РНК из мононуклеарных лейкоцитов осуществлялось методом гуанидинтиоцианат-фенол-хлороформной экстракции с использованием коммерческого набора ExtractRNA («Евроген», Россия). Концентрацию РНК измеряли при помощи спектрофотометра Picodrop Pico200 (PicodropLtd, UK). Целостность выделенной РНК изучалась при помощи электрофореза в агарозном геле с бромистым этидием.
Для обратной транскрипции на матрице полученной РНК использовался коммерческий набор MMLV RT kit («Евроген», Россия) по инструкции производителя. Определение уровня мРНК гена интереса и референтного гена (actb) проводилось с использованием наборов TaqMan Gene Expression Assays (Applied Biosystems, USA) c-fos:Rn02396759_m1, beta-actin: Rn00667869_m1 (краситель – FAM, гаситель – BHQ).
Амплификационная смесь общим объемом 25 мкл, содержащая 1×TaqMan Gene Expression MasterMix (Applied Biosystems, USA), 1×TaqMan Gene Expression Assays и 5 мкл кДНК, помещалась в прибор для проведения ПЦР в режиме реального времени (Rotor-Gene Q-series, Qiagen, Germany). Режим ПЦР состоял из 2-минутного прогревания смеси при 50 ºC (для активации урацил-N-гликозилазы), 10-минутного прогрева при 95 ºС (активация полимеразы) с последующими 60 циклами: 12 сек денатурации при 95 ºС, 30 сек отжига праймеров при 56 ºС и 20 сек элонгации при 72 ºС. Описанный состав реакционной смеси и режим амплификации были подобраны в ходе предварительной оптимизации. Расчет относительной экспрессии гена c-fos осуществлялся по Livak [14].
Статистическая обработка полученных данных проводилась с помощью пакета программ Statistica (StatSoft, USA). Гипотеза о виде распределения проверялась посредством критерия Шапиро-Уилка. Поскольку закон распределения полученных значений отличался от нормального, данные представлялись как Me(Q1-Q3), где Me – медиана, Q1-Q3 – нижний (25%) и верхний (75%) квартили. Для выполнения задачи сравнения двух независимых групп использовался непараметрический U-критерий Манна-Уитни. Критический уровень значимости нулевой статистической гипотезы принимался равным 0,01 (с учетом проблемы множественных сравнений).
Результаты и обсуждение
Экспрессия гена c-fos в исследуемых клетках была ниже экспрессии гена β-актина во всех случаях. Эффективность амплификации кДНК гена интереса и референтного гена была равной (необходимое условие использования метода Livak). Относительная экспрессия гена c-fos в подгруппе низкоустойчивых животных группы сравнения составила 0,03(0,028–0,1)и была статистически значимо меньше (р=0,002), чем в высокоустойчивой подгруппе (1,3(1–2,9)). Применение ТЭС-терапии сопровождалось статистически значимым (p=0,008) увеличением медианы относительной экспрессии гена c-fos до уровня, сопоставимого с интактным (1(0,1–1,1)) в подгруппе низкоустойчивых животных (рисунок). Таким образом, одним из эффектов данного лечебного метода является благоприятное воздействие на процесс адаптации мононуклеарных лейкоцитов в условиях жесткого комбинированного стресса. В подгруппе высокоустойчивых животных применение ТЭС-терапии сопровождалось статистически значимым (p=0,002) снижением уровня относительной экспрессии гена c-fos (0,15(0,1–0,2). В данном случае имело место предупреждение и подавление мальадаптивной стресс-индуцированной гиперактивации гена c-fos в мононуклеарных лейкоцитах.
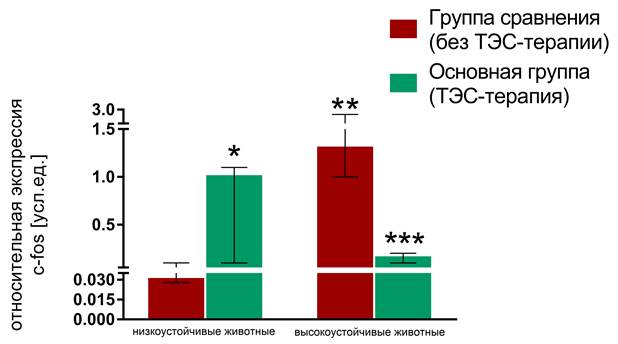
Уровень экспрессии гена c-fos в мононуклеарных лейкоцитах низко- и высокоустойчивых животных основной группы и группы сравнения относительно интактной группы
Примечание: * p=0,008 - по сравнению с низкоустойчивыми животными группы сравнения (без ТЭС-терапии); ** p=0,002 - по сравнению с низкоустойчивыми животными группы сравнения (без ТЭС-терапии); *** p=0,002 - по сравнению с высокоустойчивыми животными группы сравнения (без ТЭС-терапии).
Индивидуальная стрессоустойчивость является значимым фактором, влияющим на характер физиологических изменений при стрессе. У крыс с различной стрессоустойчивостью обнаруживаются значимые отличия в концентрации плазменного кортикостерона, электрической активности мозга, медиаторном обеспечении стресс-респонсивных центров [9]. К примеру, содержание моноаминов в гипоталамусе у высокоустойчивых животных выше, а содержание дофамина в стволовых структурах ниже, чем у низкоустойчивых [9]. В зависимости от стрессоустойчивости разнятся также паттерны активации нейронов стресс-реализующих систем. В паравентрикулярном ядре гипоталамуса после иммобилизации у высокоустойчивых животных наблюдается значительно больше Fos-позитивных клеток по сравнению с низкоустойчивой группой. Эти изменения, отражающие первый этап активации гипоталамо-гипофизарно-надпочечниковой оси, в свою очередь, связаны с разным содержанием моноаминов и глутамата в указанных структурах мозга [9]. Аналогичные паттерны активации – большее количество Fos-позитивных клеток в группе резистентных животных – имеют место также в лимбических структурах при стрессе [15]. Таким образом, многие значимые стресс-индуцируемые изменения в организмах низко- и высокоустойчивых животных имеют противоположную направленность [8]. При этом гипореактивность является характерным свойством низкоустоустойчивых организмов. Особое значение поэтому имеет детальное изучение стресс-лимитирующих лечебных методов, обладающих гомеостатическим характером действия.
Заключение
Уровень экспрессии генов стресса мононуклеарными лейкоцитами крови в значительной мере зависит от индивидуальной стрессоустойчивости организма. Так, низкоустойчивые животные в настоящем исследовании демонстрировали низкий уровень экспрессии гена c-fos, который является одним из проявлений характерной для подобных организмов гипореактивности. Напротив, в мононуклеарных лейкоцитах высокоустойчивых животных имела место стресс-индуцированная гиперактивация гена c-fos. В подгруппе низкоустойчивых животных использование ТЭС-терапии сопровождалось повышением экспрессии гена c-fos до уровня, сопоставимого с интактным. В подгруппе высокоустойчивых животных применение ТЭС-терапии предупреждало и подавляло мальадаптивную стресс-индуцированную гиперактивацию гена c-fos. Эти эффекты являются проявлением системного благоприятного стресс-лимитирующего влияния ТЭС-терапии на нейроиммуноэндокринную систему, имеющего выраженный гомеостатический характер.



