Сахарный диабет 2 типа является глобальной проблемой во всем мире, диагностируется у 7,6% населения, каждый 13-й человек имеет сахарный диабет [1]. Прогнозируется, что количество больных сахарным диабетом возрастет со 135 миллионов в 1995 г. до 300 миллионов к 2025 году, при этом особое значение имеет рост заболеваемости диабетом 2 типа (СД2) в условиях старения населения. В отличие от здорового населения, использование дентальной имплантации у пациентов с СД2 остается спорным, так как сведения по успешной интеграции имплантатов у этих групп пациентов единичные [2; 3]. Имеются данные, что неспособность к остеоинтеграции в начальной фазе установки имплантатов приводит к фиброзной инкапсуляции имплантата и подвижности, что в конечном счете приводит к отторжению имплантата [4]. Большая часть представлений о процессе интеграции дентальных имплантатов происходит от исследований на экспериментальных моделях на животных, при этом в большинстве экспериментов использована модель сахарного диабета 1 типа (СД1) на грызунах, однако патофизиология СД1 отличается от СД2, частота которого растет при старении взрослого населения. Модель СД2 на генетически модифицированных крысах является неадекватной для экстраполяции метаболических изменений в костной и окружающих её тканях на организм человека, что отмечено большинством авторов, занимающихся этой проблемой [5; 6]. Успехи в лечении СД2, увеличение продолжительности жизни требуют пересмотра списка противопоказаний и рассмотрения диабетических пациентов как кандидатов для дентальной имплантации. Однако даже если процент успеха дентальной имплантации при СД2 высокий, это не исключает сбоев по неизвестным причинам [7; 8].
На современном этапе известно, что процесс остеоинтеграции при непосредственном контакте между костью и поверхностью имплантата зависит не только от уровня метаболизма костной ткани, но и от состояния иммунного гомеостаза слизистой оболочки рта пациентов [9]. Поэтому мониторинг интеграции имплантатов имеет абсолютное значение для обеспечения долгосрочной стабильности дентальных имплантатов в клинической практике [10]. Результаты лечения имеют прямую зависимость от уровня современных представлений о механизмах патогенеза при отторжении имплантатов и особенностях репаративной регенерации в структурах пародонта в условиях имплантации. Это диктует проведение мониторинговых исследований СОР в группе стоматологических пациентов с СД2 патологией для повышения эффективности дентальной имплантации и гарантированной интеграции имплантатов [11].
Целью данного исследования является анализ клинико-морфологической динамики дентальной имплантации у пациентов с сахарным диабетом 2 типа c выявлением рисков и разработкой патогенетически обоснованной стратегии дентальной имплантации у пациентов с сахарным диабетом 2 типа.
Материал и методы. Исследования проведены с разрешения Этического комитета ФГАОУ ВО «ДВФУ» в соответствии с положениями Хельсинкской декларации (2000) об информированном согласии пациентов с помощью клинических и морфологических методов исследования. Материалом для наших исследований послужили биоптаты пациентов с клинически диагностированным СД2 различной продолжительности заболевания с момента постановки диагноза. По клиническим показаниям производили забор биоптатов СОР у мужчин, которых распределили с учётом возрастных групп, принятых ВОЗ от 16.01.2016.
Обследованы 44 мужчины в возрасте от 45 до 90 лет, имеющие дефекты зубных рядов с атрофией челюстей, удалявших зубы или утративших зубы в результате травм. В группу контроля вошли пациенты с адентией без атрофии челюстей с локальной адентией в результате травмы (таблица).
Распределение пациентов по патологии
|
Группа контроля |
Средний возраст |
Пожилой возраст |
Старческий возраст |
Долголетие |
|
45-50 лет без СД2 |
45-59 лет |
60-74 лет |
75-90 лет |
Старше 90 лет |
|
11 |
15 |
12 |
5 |
1 |
|
Итого: |
Контроль |
Пациенты с СД2 |
Всего |
|
|
11 |
33 |
44 |
||
Весь спектр клинических обследований слизистой оболочки рта проводился в динамике - в процессе подготовки и установки дентальных имплантатов.
Клинические методы включали оценку состояния ССС, ДС, ЖКТ, органов детоксикации, клинический анализ крови с определением уровня глюкозы в крови с сахарной нагрузкой и без неё автоматическим способом на аппарате Cobas Mira по стандартной методике, а также плотности костной ткани.
Всем больным проводилась двухэтапная операция дентальной имплантации с соблюдением хирургического протокола операции, утвержденного производителем, с взятием биоптатов из зоны имплантации. Проведено иммуногистохимическое фенотипирование T-лимфоцитов CD4/8, CD34, клеток Лангерганса СD68, интерстициальных макрофагов СD163, CD203a. Анализ регенераторного потенциала кератиноцитов изучен с применением маркера Ki-67, р53 и маркера ранней клеточной дифференцировки р63. Иллюстративный материал получен на микроскопе фирмы Olympus Bx52 и цифровой камеры DPx25.
Результаты и их обсуждение
Нами установлено, что практически у всех пациентов в группе с сопутствующим СД2 в предоперационный период диагностированы гингивит и пародонтит легкой и средней степени тяжести: гиперемия, отечность и воспалительные явления отмечены в 92,3%, положительная проба Шиллера–Писарева – в 94,8% случаев.
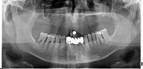
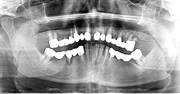
У пациентов с СД2 практически всегда на фоне адентии выявлялись патология пародонта, частичная или генерализованная адентия, атрофия альвеолярных отростков челюстей (рис. 1, 2).
 а
а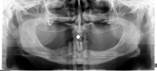 б
б 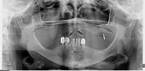 в
в 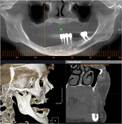 г
г
Рис. 1. Панорамная томография челюстей и конусно-лучевая компьютерная томография лицевого черепа пациентов с сахарным диабетом второго типа (а, б, в, г); г – фрагмент панорамной зонограммы челюстей, объемный рендеринг и коронарный реформат области альвеолярного отростка верхней и нижней челюстей в области правого второго премоляра, отсутствие верхнего свода нижнечелюстного канала. Атрофия альвеолярных отростков обеих челюстей крайней степени выраженности
 а
а 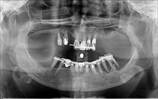 б
б
Рис. 2. Панорамная томография челюстей пациентов с сахарным диабетом второго типа. Генерализованный пародонтит: а, б - частичная адентия
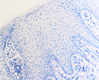
При этом морфологически идентифицировалось нарушение межклеточных контактов с образованием оптически прозрачных участков между клетками с фрагментами цитоплазматических отростков соседних клеток. Некоторые клетки имели признаки деструкции и апоптоза. Межклеточные соединения иногда были сохранны, но по направлению к апикальной поверхности идентифицировались межклеточные щели с чёткими контурами цитоплазмы шиповатых клеток (рис. 3).
 а
а 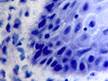 б
б 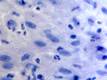 в
в 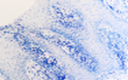 г
г 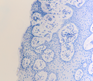 д
д
Рис. 3. Слизистая оболочка рта больных СД2: а, б - мужчины 39 лет, длительность заболевания 2 года; в – мужчины 66 лет, длительность заболевания 3 года; г, д - 67 лет, длительность заболевания 10 лет; а, б - преимущественно лимфоцитарная инфильтрация в собственной пластинке, базальном и шиповатом слое; б - инфильтрация лейкоцитами (преимущественно нейтрофильная и моноцитарная) всех слоёв СОР; в - структура эпителиального пласта – обильная инфильтрация клетками крови в собственной пластинке. Расширенные межклеточные контакты. Окраска толуидиновым синим. Микрофото, ув. а, г, д х100; б, в х200
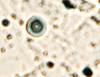
У пациентов с СД2 исходный фон иммуноцитов слизистой оболочки рта статистически достоверно отличался по всем показателям в сравнении с данными контрольной группы пациентов. В мазках-отпечатках пациентов с СД2 определялись клетки крови, что могло свидетельствовать об увеличении проницаемости эндотелия сосудов собственной пластинки и нарушении целостности эпителиальной пластинки в области имплантации. Присутствовали клетки, контаминированные микроорганизмами, ядерно-цитоплазматическое отношение сдвигалось в сторону ядра (на 14–22%). Увеличивалось число ядросодержащих эпителиоцитов (7:5), что свидетельствовало об усилении выраженности дистрофических процессов в поверхностных слоях эпителиальной пластинки. У пациентов с СД2 патологией, имевших в анамнезе длительное отсутствие зубов, независимо от возраста на поверхности слизистой оболочки содержались не только слущенные эпителиоциты, контаминированные микроорганизмами, но и лимфоциты, дендритные клетки, в случае длительного ношения металлических протезов – наночастицы металлов, иногда фагоцитированные эпителиоцитами, иногда свободно расположенные в ротовой жидкости (рис. 4, 5). Важно отметить, что микроорганизмы не только располагались вдоль мембраны, но и проникали в цитоплазму эпителиоцитов.
 а
а 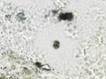 б
б 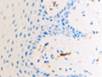 в
в  г
г  д
д
Рис. 4. Слизистая оболочка рта пациента с СД2 патологией: а, б - фазовый контраст;
в - локализация CD68; г - Ki67; д - p53. Микрофото, ув. а, б х400; в, г х200; д х 100

Рис. 5. Показатели иммунного гомеостаза слизистой оболочки рта пациентов с СД2 сопутствующей патологией
По данным диаграммы показано, что, несмотря на процессы апоптоза, регенерация эпителиального пласта в группе контроля происходит в соответствии с процессами дифференцировки кератиноцитов, у пациентов с CD2 нарушается дифференцировка, соответственно сопровождаясь снижением защитных свойств эпителия.
Цитоплазма некоторых клеток была вакуолизирована, встречались достаточно крупные вакуоли, смещавшие ядро к цитоплазматической мембране. Наблюдалась инфильтрация лейкоцитами собственной пластинки слизистой оболочки, и внутри эпителиального пласта идентифицировались многочисленные моноциты, нейтрофилы и лимфоциты. На границе шиповатого и базального слоев встречались единичные клетки Лангерганса, в основном они идентифицировались в собственной пластинке слизистой оболочки, что позволяет предположить и косвенно свидетельствует о нарушении антигенпрезентирующих свойств эффекторных иммуноцитов, при этом компенсация барьерных свойств эпителиального пласта происходит за счёт антигенпрезентирующих свойств кератиноцитов.
В базальном слое цилиндрические клетки располагаются равномерно вдоль базальной мембраны, межклеточные промежутки не определяются. Митотически делящиеся клетки группируются преимущественно на дне эпителиальных гребешков. Количество митозов достигает 1 на 100 клеток, что примерно в 2 раза ниже по сравнению с нормой (1–2 на 50–100 клеток). При изучении сравнительной характеристики пролиферативной активности кератиноцитов в срезах биоптатов контроля и биоптатов слизистой оболочки на фоне СД2 выявлено не только усиление пролиферативной активности клеток базальных слоёв в первые 3 года с момента постановки диагноза, но и высокая активность гена белка Ki67 в слоях шиповатого слоя, прилежащих к базальной мембране. Высокая скорость пролиферации не гарантирует своевременную дифференцировку и восстановление барьерных свойств эпителия. Поэтому остаётся открытым вопрос о возможности полноценной дифференцировки и специализации кератиноцитов для адекватной регенерации с закрытием дефекта и выполнением защитных свойств после дентальной имплантации. В данном случае повышение пролиферативной активности свидетельствует о снижении барьерных свойств эпителиоцитов. При этом происходит быстрое истощение регенераторного потенциала, ведущее к исчезновению базальных кератиноцитов, а затем к разрушению базальной мембраны, являющейся продуктом базальных клеток и прилежащих структур соединительной ткани, дефицит камбия приводит в последующем к невозможности закрытия дефекта эпителия способом реституции.
В собственной пластинке слизистой оболочки идентифицируются сосочковый и сетчатый слои. Собственная пластинка образует многочисленные сосочки, внедряющиеся в эпителий, и характеризуется тем, что содержит тонкостенные сосуды. В случае атрофии собственная пластинка слизистой оболочки выглядела отечной, прослеживалась интенсивная лейкоцитарная инфильтрация, толщина стенок сосудов увеличивалась за счёт гипертрофии эндотелия. Вокруг сосудов также идентифицировалась обильная лейкоцитарная инфильтрация.
В слизистой оболочке при этом сохранялась региональная гистоархитектоника, соотношение слоев не нарушалось. Дифференцировались роговой, зернистый, шиповатый и базальный слои. В поле зрения на срезах определялся умеренно выраженный роговой слой, на поверхности эпителия скапливалась микрофлора, преимущественно кокковая. Отмечалась незначительная адгезия однотипной кокковой микрофлоры на поверхности слущенных кератиноцитов.
Анализ результатов иммуногистохимического исследования в начальный период подготовки и по окончании в течение первых часов позволил сделать вывод о декомпенсированном состоянии регенераторного потенциала в группе пациентов на фоне CD2 патологии, объективном снижении пластических процессов, нарушениях иммунного гомеостаза, ведущих к недостаточной реактивности эффекторных клеток иммунофагоцитарного звена.
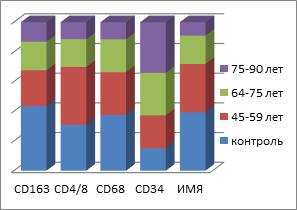
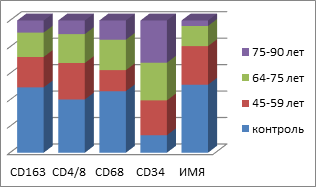
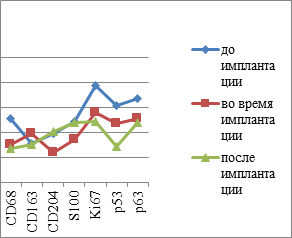
Таким образом, подсчёт иммуноцитов показал статистически достоверные отличия не только в их содержании в СОР, но и топографии их распределения в толще эпителиальной пластинки. Также установлены отличия и в количестве пролиферирующих клеток, необратимо вступивших в митоз. При этом фактор дифференцировки эпителиоцитов, соответствующий физиологическому запросу ткани и отражающий функциональные барьерные свойства эпителиального пласта, снижен в сравнении с нормой. Уменьшение количества CD163 клеток в эпителиальной пластинке мы можем связать с их исчезновением из эпителиальных пластов и выходом в собственную пластинку слизистой оболочки или на её поверхность. Также наблюдается идентификация СD4/СD8 в составе дифферонов эпителиального пласта, а не в собственной пластинке. Отмечается сниженная реакция местных иммуноцитов СОР в динамике имплантации у пациентов в обычных возрастных группах и в группах пациентов с CD II типа. Динамика изменения количества эффекторных иммуноцитов в слизистой оболочке рта пациентов без и с СД2 представлена на рисунке 6.
 а
а
 б
б
 в
в 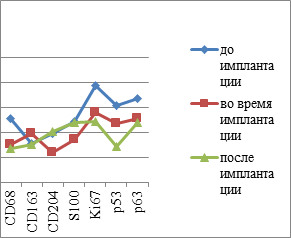 г
г
Рис. 6: а, в - контроль; б, г - пациенты с СД2 патологией. Динамика показателей иммунного гомеостаза и пластичности слизистой оболочки в динамике имплантации у пациентов с СД2 патологией
В совокупности с результатами анализа выявления р53-, р63-, Tunel–позитивных клеток и идентификации усиленного апоптоза в эпителиальной пластинке сделан вывод о несоответствии физиологического запроса барьерных функций эпителия и репаративной регенерации.
Таким образом, морфологическая характеристика в диаграммах дает четкое представление о происходящих изменениях в СОР с возрастом и при СД2 патологии, которые носят индивидуальный и возрастной характер. Однако забор секционного материала (биопсия) выполняется только лишь по узкому кругу показаний и на современном этапе не является рутинным методом диагностики текущего состояния СОР, хотя назрела необходимость внедрять этот метод в работу стоматологических стационаров и особенно клиник, на базе которых проводится дентальная имплантация.
В процессе стоматологического лечения пациентов с СД2 патологией морфологические изменения характеризовались тем, что митотический индекс в эпителии снижался, не достигая, однако, нормальных величин.
На фоне мониторинга динамики показателей эффекторных иммуноцитов и пластичности с учётом регенераторного потенциала структур СОР, анализ результатов предварительной подготовки СД2 пациентов с помощью специальной безуглеводной диеты и иммуномодулирующего лечения мягкими иммуномодуляторами 2-й группы для достижения результатов состояния иммунного гомеостаза, близкого к нормальным показателям в течение 2 недель, позволил получить хорошие результаты дентальной имплантации, и только у одного пациента произошло нарушение интеграции имплантата, установленного на нижней челюсти с одной стороны на начальном этапе дентальной имплантации. При этом было отмечено локальное отсутствие CD163 в эпителиальной пластинке в зоне отторжения и идентификация антигенпрезентирующих клеток вокруг сосудов собственной пластинки слизистой. Также в зоне отторжения отмечено большое количество клеток эффекторного макрофагального пула и тучных клеток, местных регуляторов тканевого гомеостаза, влияющих на проницаемость ткани. Второй симметрично установленный имплантат на этой же нижней челюсти показал хорошие результаты интеграции, что было подтверждено не только морфологической идентификацией эффекторных иммуноцитов, количественно соответствующих аналогичным показателям в группе контроля, но также и рентгенологическим методом исследования.
Анализ собственных и литературных данных свидетельствует, что показатели иммунокомпетентных эффекторных иммуноцитов и тучных клеток в слизистой оболочке в зоне имплантации могут служить важным прогностическим критерием успешности проводимой имплантации и показателем наличия–отсутствия возможных осложнений имплантации [12; 13]. Отсутствие антигенпрезентирующих эффекторных иммуноцитов в составе эпителиальной пластинки слизистой оболочки и наличие большого количества макрофагов, рост числа тучных клеток в собственной пластинке СОР служат признаком риска при проведении дентальной имплантации и являются неблагоприятным прогностическим показателем. Разработка патогенетически обоснованной стратегии имплантации зубов у пациентов с сопутствующим СD2 может в перспективе быть более успешной [14]. В настоящее время известны работы по реконструкции челюсти с последующей дентальной имплантацией у онкологических больных на фоне СД2, и даже после облучения [15; 16]. При дентальной имплантации у пациентов с сахарным диабетом 2 типа необходима предварительная подготовка с применением безуглеводной диеты и мягких иммуномодуляторов 2-й группы с проведением морфологического мониторинга показателей иммуноцитов, возможна и остеопластика в случае необходимости [17; 18].
Результаты нашего исследования свидетельствуют о важности мониторинга эффекторных иммуноцитов в морфологической оценке результатов дентальной имплантации для профилактики нарушения интеграции имплантатов и их отторжения у пациентов с сопутствующим СД2.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г. и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.).



