Для повышения урожая в современном сельском хозяйстве часто используют фитогормоны как регуляторы роста, воздействующие на интенсивность и направленность процессов жизнедеятельности растительного организма [3; 7].
При оценке токсичности фитогормонов исходят из общеизвестных, широко применяемых в практике гигиенического нормирования подходов. Как показывает анализ литературных данных, фитогормоны требуют отдельного рассмотрения [5]. Применение регуляторов роста как синтетического, так и биогенного происхождения и их неконтролируемое производство часто связано с риском возникновения опасных последствий для здоровья человека и окружающей среды. Некоторые из синтезированных соединений данного класса способны оказывать влияние на генетический аппарат растений и вызывать мутации [1; 6]. Выраженность цитогенетической активности и способность вызывать мутации у фитогормонов неодинакова.
Целью настоящей работы является исследование цитогенотоксичности трех фитогормонов (синтетического индола, гетероауксина, корневина) с помощью тест-объекта Аllium cepa L.
Материалы и методы исследования
В нашем исследовании были использованы фитогормоны из группы ауксины - производные индола: гетероауксин (β-индолилуксусная кислота), корневин, содержащий индолилмасляную кислоту и синтезированный индол (таблица). В качестве контроля использовали дистиллированную воду.
Варианты опыта
|
Вариант опыта |
Фитогормоны и их концентрация |
Повторность |
|
1 (контроль) |
Дистиллированная вода |
3 |
|
2 |
Индол (1:1) |
3 |
|
Индол (1:2) |
3 |
|
|
Индол (2:1) |
3 |
|
|
3 |
Гетероауксин (1:1) |
3 |
|
Гетероауксин (1:2) |
3 |
|
|
Гетероауксин (2:1) |
3 |
|
|
4 |
Корневин (1:1) |
3 |
|
Корневин (1:2) |
3 |
|
|
Корневин (2:1) |
3 |
В качестве экспериментального объекта был взят лук репчатый (Allium сера L.). A. сера L. широко применяется для оценки генетического потенциала химических соединений и рекомендован как возможный объект для цитогенетических исследований при изучении мутагенности факторов окружающей среды [4; 9].
Для определения митотической активности и анализа спектра аберраций готовили давленные ацетокарминовые препараты по методики Паушевой [8].
В каждом препарате подсчитывали делящиеся клетки, исследовали все анафазные клетки и учитывали долю клеток с хромосомными аберрациями. Анализ спектра аберраций проводили с выделением хроматидных (одиночных) и хромосомных (двойных) фрагментов и мостов. Сложные, не распознаваемые аберрации относили к группе неклассифицируемых [2].
Статистическую обработку результатов проводили стандартными методами вариационной статистики. Полученные данные обрабатывали способом вариационной статистики с использованием программ Stat2, Fstat.
Результаты исследований и их обсуждение
Фитогормоны регулируют такие процессы, как дифференциацию, рост, переход из вегетативной в репродуктивную фазу и другие этапы развития. Поэтому первым этапом нашего исследования явился анализ способности индола и фитогормонов, содержащих производные индола, влиять на прорастание семян A. cepa (рисунок).
Раствор индола во всех вариантах опыта обладал ингибирующим действием по сравнению с контролем. В контроле всхожесть семян составляла 60,3 ± 2,27%, а при действии водным раствором индола при разведении 1:2 – 55,3 ± 3,19%, при разведении 1:1 – 59,0 ± 2,55%, при разведении 2:1 – 49,1 ± 1,27%.
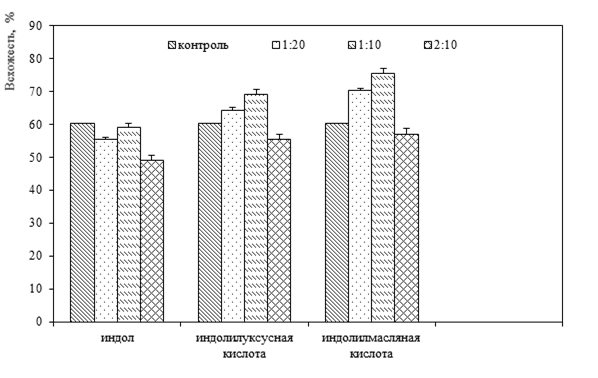
Динамика всхожести семян A. cepa при проращивании в водных растворах индола и фитогормонов
Наибольшая всхожесть семян A. cepa наблюдалась в вариантах опыта с водными растворами индолилмасляной и индолилуксусной кислот при разведении 1:2 и 1:1 и составила 70,1 ± 2,12% и 64,3 ± 2,25% для разведения 1:2 и 75,3 ± 0,71% и 69,1 ± 1,55% для разведения 1:1. Показатель всхожести в растворе этих фитогормонов превышал контрольные значения. Однако при разведении 2:1 наблюдалось обратное явление – уменьшение процента всхожести семян. Всхожесть семян A. cepa при обработке водным раствором индолилмасляной кислоты в этом варианте опыта составила 57,0 ± 2,16%, индолилуксусной кислоты – 55,3 ± 0,71%.
Далее мы исследовали способность индолов влиять на пролиферативную активность клеток корневой меристемы лука. Пролиферативную активность оценивали по величине митотического индекса, подсчитанного относительно контроля.
Наибольшая митотическая активность клеток апикальной меристемы A. cepa L., превышающая контрольные значения, отмечена при наименьших концентрациях водных растворов индолилмасляной и индолилуксусной кислот и составила 12,3 ± 1,08% и 11,5 ± 0,7% для разведения 1:2 и 12,8 ± 1,78% и 11,9 ± 0,54% для разведения 1:1 соответственно. Здесь мы наблюдаем, как и в случаях со всхожестью, проявление стимулирующего эффекта.
С увеличением концентрации водных растворов индолилмасляной и индолилуксусной кислот величина митотического индекса уменьшалась. При действии индолилмасляной и индолилуксусной кислот при разведении 2:1 величина митотической активности клеток A. cepa L. составила 9,2 ± 0,53% и 8,5 ± 0,3% соответственно.
В варианте опыта с водным раствором индола стимулирующего эффекта не наблюдалось. Наименьшая величина митотической активности клеток A. cepa L. наблюдалась в варианте опыта с индолом при разведении 2:1 и составила 7,1 ± 0,4%. При действии водного раствора индола при разведении 1:2 и 1:1 величина митотического индекса составила 7,3 ± 0,4% и 8,4 ± 0,7% соответственно.
Биологическое действие фитогормонов выразилось в индукции хромосомных нарушений, выявленных в клетках корневой меристемы A. cepa L.
При проведении цитогенетического анализа нами выявлено достоверное увеличение выхода аберрантных клеток для всех видов исследованных фитогормонов. Если в контроле у семян A. cepa L. спонтанным путем образовывалось всего 1,09 ± 0,04% хромосомных аберраций, то после обработки водными растворами фитогормонов их оказалось в несколько раз больше. Причем хромосомные нарушения встречались и в вариантах опыта с наименьшей концентрацией химического реагента (1:2). Здесь доля хромосомных аберраций у семян A. cepa L. составляла от всех делящихся клеток 2,31 ± 0,01% в случае с индолом, 1,98 ± 0,01% с индолилуксусной кислотой и 1,7 ± 0,02% с индолилмасляной кислотой. С уменьшением концентраций водных растворов фитогормонов идет уменьшение доли хромосомных нарушений, происходящих в ядре соматических клеток. Однако последние показатели в достаточной степени высоки, что свидетельствует о биологической активности фитогормонов. В варианте опыта с водным раствором индола при разведении 1:1 и 2:1 выход аберрантных клеток составил 3,38 ± 0,01% и 4,21 ± 0,01% соответственно.
Проведенный эксперимент показал, что фитогормоны индуцируют все типы структурных мутаций: хромосомные (двойные фрагменты и мосты) и хроматидные (одиночные фрагменты и мосты) аберрации. Среди неклассифицированных аберраций наблюдали отставание хромосом и слипание хромосом.
Таким образом, по данным изучения частоты хромосомных нарушений можно сформировать ряд генотоксического (мутагенного) действия фитогормонов на клетки А. сера L.: индол > индолилмасляная кислота > индолилуксусная кислота. Наибольшая генотоксичность индолилуксусной кислоты, вероятно, связана с тем, что при синтезе индолилуксусной кислоты в качестве побочного продукта образуются ароматические соединения с конденсированными циклами. Эти вещества особо опасные, так как они индуцируют синтез железосодержащих ферментов – цитохромов, что в свою очередь грозит нарушением обмена веществ и некрозом тканей.
Заключение
Мутагенным и канцерогенным свойствам фитогормонов уделяется недостаточно внимания. В этой работе нам удалось показать, что ряд широко используемых фитогормонов проявляют мутагенный эффект.
Проанализировав полученные данные, можно сделать следующие выводы.
- Цитогенетический анализ показал, что водные растворы индола, индолилмасляной кислоты и индолилуксусной кислоты при разных концентрациях изменяют динамику всхожести семян А. сера L. Водные растворы индолилмасляной и индолилуксусной кислот повышают всхожесть семян по сравнению с контролем, раствор индола понижает всхожесть семян.
- Водные растворы индола, индолилмасляной кислоты и индолилуксусной кислоты влияют на митотическую активность клеток апикальной меристемы А. сера L., повышая пролиферативную активность клеток лука по сравнению с контролем при действии индолилмасляной кислоты и индолилуксусной кислоты при разведении 1:1 и 1:2 и понижая при действии более высоких концентраций индола, индолилмасляной и индолилуксусной кислот.
- Исследуемые фитогормоны являются мутагенами для А. сера L. Наибольшее количество хромосомных нарушений связано с действием водных растворов индола, наименьшее количество хромосомных аберраций наблюдается при действии индолилмасляной и индолилуксусной кислот. По мере большего разведения фитогормонов во всех вариантах опыта число аберрантных клеток уменьшается.
По полученным результатам можно дать следующие практические рекомендации, которые позволяют до минимума сократить нежелательные побочные эффекты их применения.
- При хранении и транспортировке фитогормонов необходимо соблюдать требования, исключающие причинение вреда здоровью людей и окружающей среде.
- Не превышать допустимой концентрации и нормы расхода фитогормонов.
- Обработка фитогормонами должна осуществляться вдали от водоемов и источников питьевой воды.
- Избегать попадания препарата в продукты питания и корма.
- Необходимость проведения мониторинговых исследований, принятия мер личной и общественной безопасности.



