Активное внедрение генетики в практическое здравоохранение на настоящий момент является приоритетным направлением развития медицины. Это связанно с тем, что заболевания человека в большей или меньшей степени связаны с особенностями наследственности. Заболевания могут быть следствием мутации одного аллеля гена (доминантные), сочетания мутаций в двух аллелях: рецессивные и мультифакториального сочетания, так называемые полигенные заболевания. Практическое применение в медицине знаний о существовании «генов предрасположенности», мутантные аллели которых совместимы с нормальным жизнеобеспечением организма в постнатальном периоде, позволяет более точно осуществлять прогнозирование течения заболевания при неблагоприятных условиях. При правильном подходе к трактовке результатов молекулярного исследования возможно выявление не только генов, лежащих в основе наследственных заболеваний, но и генов предрасположенности к ним [1].
В ходе онтогенеза каскад генов последовательно включается в развитие тканей организма, обеспечивая процесс специализированной дифференцировки клеток и формирования органных структур. Изменение стадий под влиянием различных факторов этого процесса приводит к нарушению или прекращению развития эмбриона. Известно, что многие врожденные пороки развития (ВПР) могут быть вызваны мутациями разных типов генов. К ним относятся гены, кодирующие факторы транскрипции, включающие специфические нуклеотидные последовательности (мотивы), которые принимают участие в процессе регуляции экспрессии генов и, таким образом, контролируют процессы развития организма [2]. Также на нарушение процесса онтогенеза оказывают влияние мутации генов, кодирующих рецепторы, ферменты, транспортные молекулы и структурные белки. Причем отмечается, что большинство изолированных пороков развития возникает в результате взаимодействия не только генетических, но и средовых (внешних) факторов, и эти патологии мультифакториальной этиологии составляют от 20 до 30% в общей группе пороков развития [1-3].
Показано, что более 30% россиян являются носителями хотя бы 5-6 рецессивных генетических мутаций, связанных с тяжелым наследственным заболеванием [3]. Так, до 5% населения в настоящее время страдают от ВПР, хромосомных и моногенных заболеваний. При этом на удельный вес ВПР приходится 3,5%, на наследственные орфанные болезни – 1% и заболевания при хромосомной патологии – 0,5%. Вместе с тем на настоящий момент представлено достаточно данных о генетической причине многих заболеваний костно-мышечной системы, и частота встречаемости врожденных пороков этой системы ежегодно растет. Так, частота и структура формирования пороков развития костно-мышечной системы в России превышают данные других стран в 2,7 раза [4]. На территории Приморского края пороки костно-мышечной системы у новорожденных занимают 2 ранговое место с частотой до 5‰, и, как правило, в структуре пороков костно-мышечной системы, выявленных у новорожденных, преобладает вывих бедра.
Помимо изученных, известных наследственных и врожденных заболеваний костно–мышечной системы, рассматривается влияние предрасполагающих факторов, в том числе и генетических. Показана связь минеральной плотности костной ткани с наличием различных аллельных вариантов генов витамина D и полиморфизмом в регуляторной области гена COL1A1. Аминокислотная структура основного структурного белка костной ткани, коллагена 1 типа, кодируется генами COL1A1 и COL1A2. Увеличение уровня транскрипции гена COL1A1, вызванное полиморфизмом регуляторной области, приводит к изменению соотношения альфа 1 и альфа 2 цепей коллагена. Это вызывает дезорганизацию межклеточного матрикса и инициирует процесс прогрессивного снижения минеральной плотности костной ткани. По данным Е.М. Базилевской [4], около 80% обследованных по функциональному состоянию генов COL1A1 и VDR имеют «неблагоприятные» сочетания в различных вариантах их неполноценности, при этом у 80% выявлено сочетание двух таких аллелей, а у 20% трех аллелей «предрасположенности». Действительно, по мнению большинства авторов, существует определенная зависимость между снижением минеральной плотности кости, остеопорозом и функциональным состоянием генов COL1A1 и VDR [5; 6]. С другой стороны, Е.М. Яковлевым [7] показано, что вариабельность дефектов в генах, кодирующих белки, связанные с процессом биосинтеза и деградацию коллагена и других компонентов межклеточного вещества, при многофакторном сочетании, коррелирует с выраженностью гетерогенности и полиморфизмом наследственной патологии дисплазии соединительной ткани. Причем последняя не является отдельной нозологической единицей патологии и определяется как генетически детерминированный процесс, который выражается фенотипическими особенностями наследственной патологии. Таким образом, инициация системного патологического процесса дисплазии соединительной ткани обусловлена генетической предрасположенностью, а условия его развития сопровождаются эндогенными механизмами, также связанными со свойственными для него наследственными характерными [7; 8]. По мнению других авторов [9], состояние мезенхимы зависит также от особенностей генов, кодирующих белки экстрацеллюлярного матрикса, и различных сигнальных механизмов. Показана прямая корреляционная связь между аллелями ТТ TaqI rs731236 гена, кодирующего рецептор для витамина D (VDR), и наличием остеопороза [2]. Указывается, что частота аллеля Т полиморфизма TaqI rs731236 гена VDR статистически значимо чаще встречается в группе у женщин с остеопатическими переломами, по сравнению со здоровыми женщинам. Наибольшую статистическую значимость у женщин с остеопорозом имел гомозиготный генотип ТТ полиморфизма TaqI rs731236 гена VDR по сравнению со здоровыми женщинами, а гетерозиготный генотип CT статически значимо чаще встречался у женщин с переломами.
В последние десятилетия, по мнению педиатров, педагогов и врачей общей практики, наблюдается снижение количества детей 1-й и 2-й группы здоровья и отмечается рост заболеваемости. Несмотря на то что патология костно-мышечной системы не относится к ведущим в структуре заболеваемости и смертности у детей и подростков, а в Приморском крае составляет всего 15-19%, эта патология является предрасполагающим фактором в развитии последующих артрозов, артритов, остеохондрозов и остеопорозов. Данные заболевания во взрослом состоянии прогрессируют и в 40-50% случаев приводят к инвалидизации. Одной из основных причин формирования патологии костно–мышечной системы у детей и подростков является изменение молекулярно-генетического регулирования, что выражается нарушением кальциевого обмена. К одной из причин, инициирующей изменение процесса минерализации костной ткани, можно отнести изменение генов, кодирующих белки, принимающих участие в этом процессе, а именно: гена рецептора кальцитонина CALCR, гена коллагена I типа COL1A1, гена рецептора витамина D (VDR).
Цель исследования: изучить распространенность полиморфных вариантов генов (COL1A1, CALCR и VDR), участвующих в процессе минерализации костной ткани у подростков 15-17 лет (1-я и 2-я группа здоровья), проживающих в г. Владивостоке.
Материалы и методы
С помощью метода активного интервью с использованием индивидуальной карты изучено состояние здоровья 51 ребенка 1-й и 2-й группы здоровья (20 мальчиков и 31 девочка), в возрасте от 15 до 17 лет в общеобразовательных учреждениях г. Владивостока: средняя школа № 17 и средняя школа № 51. Физическое развитие оценивали на раздетом ребенке в положении «по стойке смирно» между антропологическими точками. Методика антропометрических исследований включала измерение тела стандартными инструментами (вертикальный ростомер, весы медицинские, рулетка). Изучение состояния костно–мышечной системы включало: общую оценку, осанку, двигательную активность, силовые возможности, фотоплантографию. Фотоплантография заключалась в анализе отпечатка стопы, окрашенной раствором Люголя при нагрузке. В норме отпечаток середины стопы не пересекает границу средней и латеральной трети перпендикуляра, проведенного от середины линии, соединяющей края отпечатка в области медиального края пятки и основания 1 пальца. Линию поперек стопы делили на три равные части, упрощение наружного свода в одной трети принимали за норму, в двух третях относили к первой степени, в трех третях – второй, и при большем - к третьей.
Для молекулярно-генетического анализа использовали образцы ДНК, выделенные из лейкоцитов крови с помощью наборов «Экстра ДНК Био» компании «Алкор Био». Определение типа полиморфизма генов COL1A1, CALCR и VDR осуществляли с использованием набора реагентов для определения полиморфных вариантов rs1800012 IVS1 2046 G\T гена альфа-1 цепи коллагена-I COL1A1, rs1801197 c.1377C/T p.P447L гена рецептора кальцитонина CALCR и rs731236 c.1056 T/C гена внутриклеточного рецептора витамина D VDR (ООО «Генотехнология», Россия). Полимеразно-цепную реакцию в реальном времени проводили по стандартной схеме (БаЗо, 1989), согласно инструкции производителя набора, для амплификации использовали программированный термоциклер PicoReal (Финляндия). Статистическая обработка данных произведена в программе Statistica 5.5 (Stat-Soft, Inc). Для оценки соответствия распределения генотипов по изученным полиморфным маркерам равновесию Харди – Вайнберга статистически значимыми считали различия при p < 0,05.
Результаты и обсуждение
Установлено, что у подавляющего большинства обследуемых детей отмечаются отклонения костно-мышечной системы. Так, правильная осанка наблюдалась у 63% детей, причем у мальчиков этот показатель преобладал и составлял 73% относительно 54% у девочек. Тогда как гиперкифоз у девочек отмечался чаще, чем у мальчиков: 15% и 9%, так же как и выпрямленная осанка: 22% и 14% соответственно. Х-образная форма ног преобладала у девочек и встречалась в 25% случаев, а у мальчиков в 19%, остальные показатели приведены в таблице 1.
Таблица 1
Показатели состояния костно-мышечной системы
|
Пол |
Переломы |
Вывихи |
Телосложение |
Уровень плеч |
Уровень лопаток |
Уровень таза |
Гипермоб суставов |
||||||||||
|
|
0 |
1 |
2,3 |
0 |
1 |
2,3 |
норм |
гипер |
гипо |
пр |
лев |
пр |
лев |
пр |
лев |
есть |
нет |
|
Жен |
71 |
16 |
13 |
87 |
10 |
3 |
84 |
10 |
6 |
68 |
32 |
61 |
39 |
50 |
50 |
31 |
69 |
|
Муж |
60 |
30 |
10 |
100 |
- |
- |
80 |
5 |
15 |
69 |
31 |
56 |
44 |
50 |
50 |
15 |
85 |
По результатам фотоплантографии поперечное плоскостопие 1-й степени обнаружено у 27%, 2-й степени у 63%, 3-й степени у 5% обследуемых. Продольное плоскостопие 1-й степени наблюдалось у 39%, 2-й степени 8% и 3-й степени не выявлялось. Вальгус определялся в 8% случаев, а варус в 29%, и всего 7% обследуемых имели стопы без каких-либо отклонений.
По результатам генетического тестирования, обследуемые были распределены на группы по С\Т-, С\C–, T\T-генотипам по генам VDR и CALCR и на G\T–, G\G–, T\T-генотипы по гену COL1A1.
При изучении распределения аллелей полиморфного маркера rs 731236 T/C гена внутриклеточного рецептора витамина D VDR 1-ю группу (С\Т-генотип) составили 33 человека обследуемых (64.7%), 2-ю группу (С\C –генотип) 5 человек (9.8%) и 3-ю группу (T\T-генотип) – 13 человек (26.0%) (рис. а). Тогда как, по данным М.М. Костик [10], распределение аллелей указанного гена у детей с нормальной минеральной плотностью кости было следующим: носители С\Т-генотипа – 48%, носители С\C генотипа – 8.7%, носители T\T-генотипа – 43.3%, что значимо отличалось от полученных нами данных.
В полиморфных вариантах rs 1801197 c.1377 C/T p.P447L гена рецептора кальцитонина CALCR нами обнаружено, что 1-ю группу обследуемых (С\Т-генотип) составили 41 человек (80.4%), 2-ю группу (С\C–генотип) – 7 человек (13,7%), и 3-ю группу (T\T-генотипа) – 3 человека (5,9%) (рис. б). При изучении частоты встречаемости аллеля альфа-1 цепи коллагена-I COL1A1 полиморфных вариантов rs 1800012 IVS1 2046 G\T в 1-ю группу (G\T–генотипа) было отнесено 46 человек (90,2%), во 2-ю группу (G\G–генотип) 5 человек (9,8%), T\T-генотип не обнаружен (рис. в).
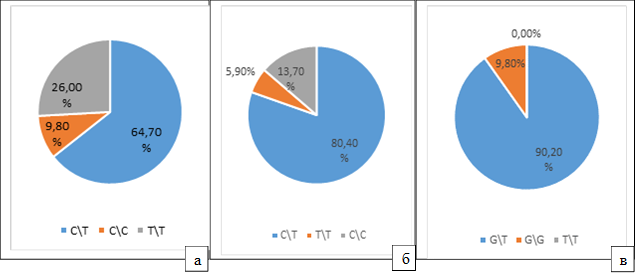
Распределение аллелей генов у обследуемых по группам: а) внутриклеточного рецептора витамина D VDR полиморфного маркера rs 731236 T/C; б) рецептора кальцитонина CALCR в полиморфных вариантах rs 1801197 c.1377 C/T p.P447L; в) альфа-1 цепи коллагена-I COL1A1 полиморфных вариантов rs 1800012 IVS1 2046 G\T
В исследованиях Н.М. Шилиной [11] в обследованной когорте преобладающим генотипом полиморфизма rs1800012 гена COL1A1 был выявлен генотип GG (55,1%), частота генотипа ТТ - 7,6%, аллеля Т - 26,2%. Отмечена обратная ассоциация аллеля Т c риском снижения костной прочности (0R=0,621 при р=0,037) полиморфизма rs1800012 гена COL1A1 у всех обследованных детей дошкольного и школьного возраста. По данным Э.А. Майлян [12], распределение полиморфизмов в гене COL1A1 было следующим: GG - 67,1%, GT - 29,8%, а в TT - 3,1%.
Нами установлено, что полиморфизмы в гене внутриклеточного рецептора витамина D VDR в 2 раза чаще встречались у девочек, чем у мальчиков (60,8% и 39,2% соответственно). Преобладание гомозиготной T\T и G\G в указанном гене также встречалось у девочек в 5 и 4 раз чаще (таблица 2), чем у мальчиков. Известно, что аллель G* является неблагоприятным по «предрасположенности» обследуемых к остеопорозу [2]. Гетерозиготный вариант G\T - преобладал у девочек в соотношении 1:1,6. Структура распределения полиморфизмов в генах VDR, CALCR, COL1A1 по половому признаку представлена в таблице 2.
Таблица 2
Структура распределения полиморфизмов генов VDR, CALCR, COL1A1 у детей различного пола (%)
|
|
VDR |
CALCR |
|
COL1A1 |
|||
|
|
мальчики |
девочки |
мальчики |
девочки |
|
мальчики |
девочки |
|
C\C |
3,9 |
5,9 |
7,8 |
5,8 |
G\G |
2,0 |
7,8 |
|
T\T |
3,9 |
19,6 |
2,0 |
3,9 |
T\T |
0 |
0 |
|
C\T |
31,4 |
35,3 |
29,4 |
51,0 |
G\T |
37,3 |
53,0 |
|
Всего |
39,2 |
60,8 |
39,2 |
60,8 |
Всего |
39,2 |
60,8 |
Таким образом, сочетание полиморфизмов генов VDR C/T, CALCR C/T, COL1A1 G\T выглядело следующим образом: C/T C/T G/T – 51%; Т/T C/T G/T – 13,7%; C/T C/С G/T – 11,7%; C/С C/T G/T – 7,8%; Т/T C/T G/G – 7,8%; C/T Т/T G/T – 2%; Т/T Т/T G/G – 2%; Т/T C/С G/T – 2%; C/С Т/T G/T – 2%, и совместное сочетание этих генов занимало почти 80%. Нами в литературных источниках не найдено данных о сочетании вариантов аллелей в генах VDR C/T, CALCR C/T, COL1A1 G\T. Учитывая значимые различия между результатами, полученными в наших исследованиях, и данными, отмечаемыми в других регионах, можно сделать предположение о наличии отличий указанных генов населения Приморского края от генов населения центральной части России. На наш взгляд, это связано с активной миграцией населения в страны Юго-Восточной Азии, а также значительным удельным весом переселенцев из Украины. Это утверждение требует проведения расширенного сравнительного анализа остальных полиморфизмов генов населения Приморского края.



