Специфика обучения студентов нехимического университета по программам бакалавров и специалистов предполагает получение фундаментальных знаний по химии, необходимых для самостоятельного решения дальнейших профессиональных задач. Для бакалавров это существенно без получения узконаправленных знаний, для специалистов важно прикладное образование по химии. Оба уровня высшего звена законченного высшего образования опираются на тот фундамент знаний, который получен в средней школе.
В МГТУ им. Н.Э. Баумана на кафедре химии в течение многих лет проводится входное тестирование знаний по химии студентов, поступивших на первый курс. К сожалению, по ряду причин неудовлетворительные результаты получают более 60% студентов. По нашему мнению, это обусловлено тем, что наша дисциплина не является ключевой при вступительных экзаменах в технический университет. Освоению химии в выпускных классах школы отводится второстепенная роль после физики и математики [1]. Кроме того, после поступления студенты сталкиваются с тем, что программа по общей химии, например для бакалавров инженерных специальностей, сокращена до одного семестра [9]. В связи с этим остро стоит задача за короткий период помочь студентам систематизировать и усвоить большой объем теоретической информации, полученной на лекциях и самостоятельно проработанной с помощью учебника [10], научить их решать задачи различного уровня сложности при проведении лабораторных работ [4-5], выполнении домашних заданий [6].
Обсуждение возможности приведения материала упрощённых школьных программ по химии в соответствие с тем, что необходимо знать студентам после окончания высшего учебного заведения, представляет основную цель данной работы. Задача заключается в подборе методов решения этой проблемы путём обучения способам и навыкам усвоения знаний по химии с помощью алгоритмов.
Наряду с получением и освоением знаний «почти с нуля» в рамках учебной программы по химии, а также формированием у первокурсников творческого потенциала, необходимо применять практические навыки использования методики алгоритмов для решения различных инженерных задач [2]. На кафедре химии внедрена интегративно-модульная методика обучения и контроля знаний студентов [8; 11-12]. Большой объём информации теоретического (лекции, литература) и практического (лабораторные работы и семинары) блоков согласуются с блоком самостоятельной работы (например, решение домашних заданий). Реализация принципов алгоритмов в данном контексте помогает адаптации студентов младших курсов в научно-учебной среде и используется, в первую очередь, при анализе теоретического материала (лекции и учебники), а также при составлении отчетов по лабораторным работам, в самостоятельной и реферативной работе [1; 3; 9]. Особенно актуально это когда студент делает первые шаги в самостоятельной научно-исследовательской работе путём исследовательских работ и публикации своих научных докладов в печати.
Большое внимание при обучении студентов уделяется решению расчетных задач с помощью различных методических пособий [3; 7], в которых применение алгоритмов тоже возможно.
Для успешного решения задач с помощью алгоритмов рекомендуется следующий порядок действий.
1. Внимательно изучить условие задачи, определить с какими величинами предстоит проводить вычисления, установить единицы измерения, записать данные в условие задачи.
2. Если в условии задачи речь идет о взаимодействии нескольких веществ, записать уравнение (или уравнения) реакции (реакций) и рассчитать стехиометрические коэффициенты.
3. Выяснить количественные соотношения между величинами. Определить этапы расчета.
4. Определить и записать необходимые формулы для расчета. Подставить численные значения величин, проверить их размерности и провести вычисления.
Рассмотрим алгоритм решения задач блока «Основные законы химии».
Примеры создания системы алгоритмов при описании свойств химических элементов и разнообразных веществ могут быть оформлены таблицей, в левом и правом столбцах которой подробно изложены ступени решения данной проблемы.
Пример. Расставьте коэффициенты окислительно-восстановительной реакции методом полуреакций (ионно-электронных уравнений).
|
Порядок действий |
Пример решения |
|
1. Запишите окислительно-восстановительное уравнение |
KMnO4 + NaNO2 + H2SO4 = MnSO4 + NaNO3 + H2O |
|
2. По теории диссоциации распределите молекулы на ионы (катионы и анионы), в которых находятся элементы переменной степени окисления, и подчеркните их |
K+ + MnO4- + Na+ + NO-2 + 2H+ + SO42- = ——- - - - Mn2+ + SO42- + Na+ + NO3- + H2O —— - - - |
|
3. Выберите пару частиц, в которой происходит окисление, в другой - восстановление |
ионы NO2- окисляются в ионы NO-3 ионы MnO4- восстанавливаются до Mn2+ |
|
4. В первой полуреакции произведите баланс атомов: добавьте слева 8 моль ионов Н+ для связи атомов кислорода в молекулы воды, получающиеся из них в правой части уравнения |
MnO4- + 8H+ = Mn2+ + 4H2O |
|
5. Для баланса зарядов в левой части этого уравнения добавьте 5 моль электронов |
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O окисленная восстановленная форма форма |
|
6. Во второй полуреакции для баланса атомов в левую часть добавьте 1 моль молекул воды, в правую - 2 моль ионов водорода, используя только частицы, участвующие в реакции |
NO2- + H2O = NO3- + 2H+
|
|
7. Для баланса зарядов в левую часть уравнения добавьте 2 моль электронов |
NO2- + H2O - 2e- = NO3- + 2H+ восстановленная окисленная форма форма |
|
8. Сложите две полуреакции, предварительно умножив их на такие коэффициенты, чтобы число молей приобретенных и потерянных электронов были равны |
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O ½2 NO2- + H2O - 2e- = NO3- + 2H+ ½5 ——————————————————— 2MnO4- + 5NO2- + 6H+ = 2Mn2+ + 5NO3- + 3H2O |
|
9. Учитывая, что в исходный состав входили катионы натрия и калия и применялась серная кислота, закончите полное молекулярное уравнение |
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + 3H2O |
Для успешного решения задач студенты должны освоить необходимый набор предварительных компетенций по материалу средней школы как из области химии, так и из области математики. Студенты должны уметь корректно использовать понятия «моль», «молярная масса», «количество вещества», «формульная единица», «масса вещества», «объем вещества», «молярный объем газа», используя экспериментально определенную массу вещества и табличное значение молярной массы вещества, рассчитать количество вещества. Закон эквивалентов используется при решении большинства задач рассматриваемого типа. После получения определенного навыка в решении задач и по мере формирования умения разбиение на таблицы в примерах и решениях задач может быть опущено.
Пример. Определить массу соды, необходимую для устранения жесткости в 1 м3 воды, обусловленной присутствием гидрокарбоната кальция с содержанием S=2г/л.
Алгоритм решения
1. Из условия следует, что в химическую реакцию вступают гидрокарбонат кальция и карбонат натрия. Следовательно, в уравнении nЭ(1)=nЭ(2) количество вещества эквивалентов соответствует указанным веществам. Примем nЭ(1) для карбоната натрия.
2. По определению nЭ=m/MЭ, и одна часть нового уравнения получена: nЭ(1)=m(1)/MЭ(1).
3. Для получения второй части нового уравнения найдем массу карбоната кальция в 1 м3 воды из условия задачи. По условию, в 1 л воды содержится S карбоната кальция, следовательно, в 1000 л (1 м3=1000 л) содержится 1000S г.
4. Используя определение количества вещества эквивалентов, получаем nЭ(2)=1000S/MЭ(2).
5. Карбонат натрия и гидрокарбонат кальция принимают участие в обменной химической реакции, поэтому эквивалентные числа для них равны 2 и MЭ(1)=М(1)/2, MЭ(2)=М(2)/2.
6. Приравнивая выражения для nЭ(1) и nЭ(2), получаем итоговое уравнение 2m(1)/M(1)=2•1000S/M(2) и уравнение для расчета массы карбоната натрия m(1)=М(1)•1000S/M(2).
Химия является основой многих практических производств, требующих расчетов как материального и теплового баланса расхода сырья и энергии, количества получаемого продукта, так и потерь производственного процесса. Хорошая математическая подготовка студентов позволяет применить систему математических вычислений к решению химических задач. Алгоритмы реализуются в процессе изучения химии при решении экспериментальных задач разного типа, при подготовке и выполнении научного эксперимента [1], практикума [2-3] и участия в олимпиадах. Владение приемами расчета химических процессов является важным для планирования и проведения экспериментов как в лабораторных, так и в заводских условиях, когда это решение способствует лучшему усвоению теории термодинамики, равновесия и кинетики химических процессов [10].
Алгоритмы решения задач блока «Свойства макроскопических систем»
Пример. Константа скорости реакции А(р-р) +2B(р-р)→C (р-р) +3D(р-р) равна 0,1 л/моль∙мин. Начальная концентрация вещества A 0,01 моль/л, а вещества B – 0,05 моль/л. Во сколько раз изменится скорость реакции, когда концентрация вещества A станет равной 0,008 моль/л?
Решение (составлением таблицы).
|
№ |
Алгоритм |
Решение |
|
1. |
Вычислить скорость химической реакции в начальный момент времени |
rt=0 =k[A]·[B]2 = 0,1· 0,01·0,052 = = 2,5·10-5 моль2/л2·мин |
|
2. |
Рассчитать текущие концентрации компонентов реакции |
Используем таблицу 2 (расположена ниже) |
|
3. |
Вычислить текущую скорость химической реакции, когда концентрация вещества А достигнет значения 0,008 М, концентрация вещества В – 0,046 М |
rt=k[A]·[B]2 = 0,1·0,008·0,0462 = = 1,7·10-6 моль2/л2·мин |
|
4. |
Найти отношение скоростей в начальный и текущий момент времени rt=0 / rt
|
rt=0 / rt =2,5·10-6 /1,7·10-6 = 1,47 раза, скорость реакции снизится в 1,47 раза |
Расчет текущих концентраций компонентов реакции
|
Концентрации компонентов |
[A], М |
[B], М |
[C], М |
[D], М |
|
Стехиометрические коэффициенты |
1 |
2 |
1 |
3 |
|
Cнач. |
0,01 |
0,05 |
0 |
0 |
|
Cпрореаг. |
0,01- 0,008 = 0,002 |
2· 0,002 = 0,004 |
||
|
Cтекущ. |
0,008 (по условию) |
0,05 - 0,004 = 0,046 |
1· 0,002 = 0,002 |
3· 0,002 = 0,006 |
Для успешного решения задач контрольного блока (защита лабораторных работ, сдача модулей и итоговые зачёт или экзамен) используются алгоритмы решения задач в рамках целостности восприятия всего курса химии и логичности строгого математического аппарата. При оформлении решения эти подробные части могут не записываться, они служат вспомогательным материалом для чёткого построения ответа на вопрос.
Алгоритмы решения задач блока «Электрохимические процессы»
Пример. Гальванический элемент состоит из цинкового и серебряного электродов в растворах их нитратов. Составьте электрохимическую схему элемента, напишите уравнения электродных процессов и токообразующей реакции. Вычислите ЭДС: а) при стандартных условиях; б) при концентрациях 0.01 М (нитрат цинка) и 0.1 М (нитрат серебра) и стандартной температуре.
Решение
1. Цинк - более активный металл - анод, а серебро – катод, поэтому электрохимическая схема данного гальванического элемента такая: АНОД Zn | Zn(NO3)2 || AgNO3 |Ag КАТОД.
2. Электродные процессы: анодный: Zn – 2e = Zn2+, катодный: Ag+ + e = Ag.
3. Уравнение токообразующей реакции: Zn + 2Ag+ =Zn2+ + 2Ag – ионно-молекулярное,
Zn + 2AgNO3 = Zn(NO3)2 +2Ag – молекулярное.
4. Электродвижущая сила (ЭДС) элемента при стандартных условиях
(концентрация ионов металлов в растворах равна 1 моль/л).
Е = φ
= φ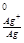 – φ
– φ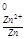 = 0.80 – (- 0.76) = 1.56 В.
= 0.80 – (- 0.76) = 1.56 В.
5. Электродный потенциал цинка при концентрации 0.01 М:
φ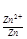 = - 0.76 +
= - 0.76 +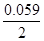 lg 0.01= -0.76 - 0.059 = - 0.82 В.
lg 0.01= -0.76 - 0.059 = - 0.82 В.
6. Электродный потенциал серебра при концентрации 0.1 М:
φ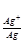 = 0.80 +
= 0.80 +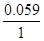 lg 0.1 = 0.80 -0.059 = 0.74 В.
lg 0.1 = 0.80 -0.059 = 0.74 В.
7. Электродвижущая сила элемента при данных концентрациях:
E = φ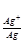 - φ
- φ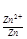 = 0.74 – (- 0.82) =1.56 В.
= 0.74 – (- 0.82) =1.56 В.
Выводы
1. Для эффективного обучения студентов общей химии по программе бакалавров и специалистов в техническом университете используются методики обучения путём составления алгоритмов решения практических и расчётных задач.
2. Особое внимание уделено разделам «Основные законы химии», «Свойства макроскопических систем» и «Электрохимические процессы» в соответствии с интегративно-модульной системой обучения и контроля знаний студентов по курсу химии.
3. Представлены примеры решения заданий составлением алгоритмов (в виде таблиц или поэтапного хода решения).



