В настоящее время приобрело широкое распространение тестирование различных препаратов, изделий медицинского назначения и физических факторов на культурах адгезивных клеток [1]. Разработано и используется множество протоколов для проведения данных доклинических исследований. Оценка результатов осуществляется различными лабораторными методами, среди которых одним из основных является морфологический.
В последние годы наблюдается устойчивый рост интереса к сверхразрешающим методам оптической микроскопии. Однако широко применяемые в медико-биологических исследованиях методы электронной, атомно-силовой, конфокальной и когерентной микроскопии ограничены вследствие низкого (150…200нм) латерального разрешения [2, 3], высокой погрешности измерений, многочисленных артефактов и трудоемкой пробоподготовкой.
Относительно недавно был предложен метод модуляционной интерференционной микроскопии, на основе которого разработано новое поколение быстродействующих оптических профилометров с разрешением в плоскости XY 10–100 нм. Метод интерференционной микроскопии позволяет не только получить изображение структуры с нанометровым разрешением, но и провести комплексный анализ оптических свойств объекта [4]. Одним из таких профилометров является модуляционный интерференционный микроскоп (МИМ).
Сравнительные характеристики возможностей различных микроскопов представлены нами в таблице 1.
Таблица 1
Сравнительная характеристика различных методов микроскопического исследования поверхности биологических объектов
|
Метод |
Увеличе-ние |
Рабочая среда |
Изобра-жение |
Воздействие на образец |
Пробоподготовка |
|
Световая микроскопия |
103 |
воздух жидкость |
2D |
инвазивное неинвазивное |
фиксация окраска |
|
Сканирующая электронная микроскопия |
106 |
вакуум |
2D |
инвазивное |
фиксация сушка |
|
Сканирующая зондовая микроскопия |
109 |
вакуум воздух жидкость |
3D |
инвазивное |
сушка фиксация |
|
Флуоресцентная микроскопия |
109 |
воздух жидкость |
3D |
инвазивное |
фиксация окраска |
|
Конфокальная микроскопия |
109 |
воздух |
3D |
инвазивное |
фиксация окраска |
|
Интерференцион- ная микроскопия |
109 |
воздух |
3D |
неинвазивное |
--- |
В литературе описаны результаты исследования методом интерференционной микроскопии клеток крови [5,6], бактерий [7], спор микроорганизмов [8], опухолевых клеток [9], нейрон-глиальной сети [10]. Данных по изучению культур адгезивных клеток в доступной литературе нами обнаружено не было.
Разработанный ОАО «ПО «УОМЗ» (Россия) микроскоп МИМ-340 был передан Институту экспериментальной медицины и биотехнологий СамГМУ в рамках договора о временном безвозмездном пользовании в целях проведения фундаментальных медико-биологических исследований (Договор № А0104 от 04.05.2015 г.).
На базе ИЭМБ СамГМУ располагаются лаборатории, где выращивают культуры клеток из различных источников для использования в доклинических исследованиях, в том числе в качестве тест-систем. Такие культуры должны отвечать требованиям, которые задаются соответственно целям и задачам каждого эксперимента. Для этого все культуры проходят процедуру идентификации с использованием комплекса методов исследования. В связи с этим расширение комплекса методов идентификации является актуальным.
Цель нашей работы – адаптировать возможности интерференционного микроскопа МИМ-340 для исследования культур адгезивных клеток.
Согласно руководству по эксплуатации данного микроскопа, изучаемый объект следует помещать под объектив на диэлектрическом предметном стекле с зеркальным покрытием. Препараты из перечисленных выше биообъектов авторы изготавливали непосредственно перед микроскопированием. Если готовить подобным образом препарат из адгезивной культуры, необходимо «снять» клетки с поверхности культурального пластика, где они инкубировались в ростовой среде. Данная манипуляция сильно искажает морфологические характеристики клеток.
Для того чтобы получить возможность изучать нативную культуру с помощью МИМ-340, было принято решение вырастить клетки непосредственно на стекле с зеркальным напылением. Поскольку клетки invitro культивируются только в стерильных условиях, а стекла поставляются нестерильными, необходимо было разработать метод их стерилизации. Данный способ был разработан авторами в 2016 году, подана заявка на патент («Уведомление о поступлении заявки на изобретение» № 20161130601 от 25.07.2016).
Материалы и методы
Было проведено изучение использования возможностей МИМ-340 применительно к культуре адгезивных клеток.
Исследования осуществляли на культурах дермальных фибробластов человека 7 пассажа, которые выращивали в лаборатории культуры клеток ИЭМБ СамГМУ. Первичный материал получали у доноров с соблюдением всех требований биоэтики после подписания информированного согласия. Фибробласты (4,5х104 клеток в 100 мкл полной ростовой среды) высевали на стерильные диэлектрические стекла с зеркальным покрытием (опытная группа) и на стерильные предметные стекла (контрольная группа). Стекла выдерживали во влажной камере в течение 60 минут для обеспечения прикрепления клеток к поверхности, затем помещали в стерильные чашки Петри и заливали ростовой средой. Культивирование проводили в полной ростовой среде следующего состава: среда 199 – 90 %, эмбриональная телячья сыворотка – 10 % (среда и сыворотка – ООО «БиолоТ», РФ), гентамицин – 40 мкг/мл- в условиях СО2-инкубатора (Sanyo – Incubator, MCO -18AС, Япония) при температуре 37 °С, 5 % СО2 и постоянной влажности в течение 7 суток. В эксперименте было задействовано 48 объектов (по 24 стекла в каждой группе).
Дермальные фибробласты контрольной серии изучали и фотографировали с помощью инвертированного микроскопа Olympus СКX 41 с цифровой камерой SC100 и программным обеспечением Cell Sence Entry при увеличении 200, 400.
Препараты опытной серии изучали с помощью интерференционного микроскопа МИМ-340. После извлечения стекла с зеркальным покрытием с культурой из ростовой среды по периметру стекла прокладывали спейсер высотой 10–15мкм. На ограниченную спейсером поверхность наносили 20 мкл ростовой среды и накрывали покровным стеклом. Полученный таким образом препарат помещали под объектив микроскопа. Монослой оценивали в навигационном канале. Так как площадь измерения оптической плотности ограничена пределами стандартной рамки (отображающей площадь интерференционного канала), мы избрали ядро фибробласта в качестве объекта для детального исследования.
Для определения жизнеспособности клеток использовали общепринятую методику окраски витальным красителем трипановым синим. Количество живых и мертвых клеток подсчитывали в 5 полях зрения каждого стекла при увеличении 100, результат выражали в процентах.
Сравнительный анализ морфофункционального состояния опытных и контрольных культур в динамике проводили, основываясь на следующих показателях: плотность монослоя, индекс адгезии IA, время удвоения TD, количество удвоений KD. Для этого сначала через 24 часа, а затем каждые 48 часов эксперимента клетки снимали со стекол стандартным способом (по 6 стекол из каждой группы) и считали при помощи ручного автоматического счетчика клеток Scepter (Millipore, США).
Индекс адгезии (IA) рассчитывали по формуле:
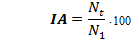
гдеN1 – посевная доза, Nt – количество клеток на стекле через 24 часа после посева, и выражали в процентах (%).
Время удвоения культуры (TD) рассчитывали по формуле:
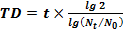 ,
,
где t – время роста культуры (часы), N0 – начальное количество клеток, Nt – количество клеток через t часов.
Количество удвоений культуры (KD) вычисляли по формуле:

где N0 – количество клеток в монослое через 24 часа после посадки, Nt – количество клеток в монослое по окончании эксперимента.
Статобработка. Статистическая обработка результатов исследования была проведена с помощью операционной системы Windows-7, программного комплекса Microsoft Office Excel 2010. Нормальность распределения количественных признаков определяли с помощью критерия Шапиро – Уилка. Результаты были представлены в виде среднего арифметического (M) и стандартной ошибки выборочной средней (m) [11,12]. Для определения равнозначности сравниваемых групп использовали t-критерий Стьюдента. Значимыми считались отличия при p ≤ 0,05 (95 %).
Результаты и их обсуждение. Проведенное исследование показало, что и в опытной, и в контрольной серии в течение всего эксперимента фибробласты сохраняли свойственную им форму, размеры, количество ядер и отростков, структуру цитоплазмы, характер роста в монослое. При микроскопировании препарата как с помощью МИМ-340 (камера навигационного канала), так и инвертированного микроскопа мы наблюдали расправленные клетки веретенообразной формы с 2–4 отростками (рис.1 а,б), контактирующими между собой. Цитоплазма фибробластов гомогенная, ядра с 1–2 ядрышками четко визуализировались. При окраске трипановым синим в монослое выявлялись преимущественно жизнеспособные клетки (табл. 2).
Вместе с тем дермальные фибробласты человека с самого начала эксперимента проявили несколько меньшее сродство к диэлектрическим стеклам: индекс адгезии опытной культуры составил 85 %, по сравнению с 96 % в контроле. Время удвоения опытной культуры, отражающее ее пролиферативную активность, было стабильным на всем протяжении эксперимента, сохраняясь достоверно ниже контрольного показателя (таб. 2), что, по-видимому, связано с более слабым сцеплением клеток с зеркальной поверхностью. В результате формирование монослоя в опытной серии происходило равномерно и диффузно, с сохранением характера роста, свойственного нормальной культуре дермальных фибробластов человека, но плотность монослоя в течение всего эксперимента значимо меньше, чем в контроле. За 7 суток в опытной группе произошло 4,0691 удвоение, в контрольной группе – 4,7558 удвоений.
 а
а  б
б
Рис.1. Культура дермальных фибробластов человека, 5 суток. Окраска трипановым синим. а)МИМ, камера навигационного канала; б) световой микроскоп. Ув. 400
Таблица 2
Сравнительная характеристика культур фибробластов при посеве на обычные и диэлектрические предметные стекла
|
Показатели |
1сутки эксперимента |
3 суток эксперимента |
5 суток эксперимента |
7 суток эксперимента |
||||
|
Конт роль |
Опыт |
Конт роль |
Опыт |
Конт роль |
Опыт |
Конт роль |
Опыт |
|
|
Плотность монослоя, кл/1 мм2 |
43,20±1,23 |
38,25± 1,51* |
139,97±4,53 |
97,92± 3,97* |
404,51±12,21 |
250,68± 17,92* |
1169,03±25,49 |
641,74± 18,98* |
|
Время удвоения, ч |
- |
- |
28,30±0, 83 |
35,40±1,62* |
31,35 ±0, 61 |
35,39±1,17* |
31,35 ±0,89 |
35,39±1,24* |
|
Живые клетки в монослое, % |
96,41± 0,56 |
94,62± 1,02 |
97,61± 2,14 |
95,53± 1,57 |
96,51± 1,73 |
95,63± 0, 94 |
96,42± 1,66 |
94,61± 1,42 |
Примечание: * – р< 0.05 по сравнению с контролем.
Фазовые изображения, полученные с помощью МИМ-340, представляют собой оптическую разность хода интерферирующих лучей. Физиологические процессы, происходящие в клетке, а также фазы клеточного цикла приводят к изменениям оптических параметров (изменение оптической плотности). Используя разработанный нами способ выращивания клеток на диэлектрических стеклах, мы получили возможность определять фазовую высоту ядер нативных фибробластов в культуре (рис. 2,3). Фазовый портрет представляет собой временную последовательность профилей фазовой толщины по скан- линии при периодически многократном сканировании объекта. Команда «Сечение» позволяет задавать начальную и конечную точку произвольного сечения и выводить его график в отдельном окне. При средних размерах ядер живых дермальных фибробластов (длина – 27,14 ±2,4 мкм, ширина – 16,7±3,2 мкм) средняя фазовая высота их к концу эксперимента составила 142,17±21,7 нм. Следует обратить внимание на несовпадение терминов «геометрическая толщина» и «фазовая толщина» объекта [8].
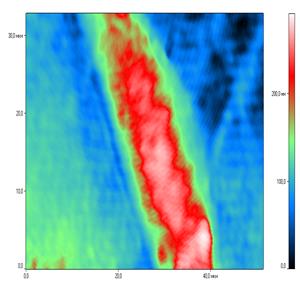
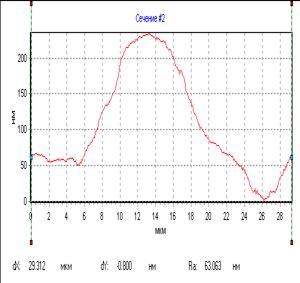
Рис.2. Фазовый портрет ядра фибробласта Рис.3. Профиль фазовой толщины ядра фибробласта
Выводы
В ходе наших исследований была продемонстрирована возможность выращивания культуры дермальных фибробластов человека на диэлектрических стеклах без изменения структуры клеток и характера их роста. В результате была доказана возможность исследования нативных клеток в монослое с использованием интерференционного канала МИМ-340 максимально длительное время. Были получены фазовые портреты ядер в нативной культуре фибробластов и определена их фазовая толщина.



