Асептическая нестабильность вертлужного компонента эндопротеза тазобедренного сустава – одно из наиболее часто встречаемых осложнений первичного эндопротезирования [1-3]. Ее распространенность по данным различных авторов колеблется от 15 до 50 % в сроки от двух лет и достигает максимальных величин к семи – десяти годам. Основу асептической нестабильности компонентов составляет возникающий в результате «хронического воспаления» в парапротезной ткани остеолизис, являющийся результатом нарушения ремоделирования костной ткани [4]. Этиологическими факторами указываются продукты износа пар трения при бесцементной фиксации и воздействие высоких температур полимеризации костного цемента при цементной фиксации. Немаловажную роль в развитии асептической нестабильности вертлужного компонента отводят и его неправильному позиционированию. Избыточная вертикализация чашки эндопротеза по данным математического моделирования приводит к увеличению области концентрации напряжений, что влияет на долговечность стабильной фиксации и способствует раннему возникновению асептической нестабильности [5]. Диагностика патологии крайне затруднительна на дооперационном этапе в связи с отсутствием методик определения, обладающих высокой специфичностью и чувствительностью, а также типичной клинической картины [6, 7]. Окончательный диагноз и объем оперативного вмешательства, как правило, устанавливаются хирургами интраоперационно, что делает предоперационное планирование крайне затруднительным. Одним из вариантов лечения пациентов с изолированной асептической нестабильностью вертлужного компонента и стабильным правильно ориентированным феморальным компонентом является замена чашки эндопротеза с сохранением ее ножки. Учитывая возраст и наличие сопутствующей патологии, уменьшение объема оперативного вмешательства положительно скажется на общем состоянии пациентов. Однако анализ отечественной и зарубежной литературы показал недостаточное количество сообщений по отдаленным результатам лечения данной методикой и проценту возникновения нестабильности в сохраненном бедренном компоненте.
Цель исследования: анализ результатов лечения больных с изолированной асептической нестабильностью вертлужного компонента путем замены чашки эндопротеза и сохранением стабильного правильно ориентированного бедренного компонента.
Материалы и методы. Ретроспективно были проанализированы результаты лечения 29 пациентов с изолированной асептической нестабильностью вертлужного компонента, прооперированных в период с 2014 по 2015 год. Основное большинство составили женщины в возрасте от 50 лет. Средний возраст пациентов 57 лет. Средний индекс массы тела составил 28, что по классификации Всемирной Организации Здравоохранения соответствует избыточной массе тела. Наличие сопутствующей патологии наблюдалось у 24 пациентов (82,8 %), среди которой превалировали заболевания сердечно-сосудистой (13 пациентов) и дыхательной (5 пациентов) систем. У 4 пациентов наблюдалась патология эндокринной системы, и лишь у 2 пациентов – заболевания мочеполового тракта. Средний срок от момента первичного эндопротезирования до ревизионного вмешательства составил 5 лет. Критериями включения являлись: 1) изолированная нестабильность ацетабулярного компонента; 2) наличие стабильного правильно ориентированного феморального компонента; 3) неинфекционный генез заболевания; 4) первичное ревизионное вмешательство. Критериями исключения являлись: 1) инфекционный генез заболевания; 2) тотальная нестабильность компонентов эндопротеза; 3) изолированная нестабильность феморального компонента; 4) неоднократно проведенное ревизионное вмешательство. Диагноз изолированной асептической нестабильности устанавливался на основании: данных клинического (болевой синдром, нарушение функции), рентгенологического (критерии Н.В. Загороднего, 2011) и лабораторного исследований (отрицательный С-реактивный белок, отсутствие сдвига лейкоцитарной формулы влево, отрицательные результаты микробиологического пунктата синовиальной жидкости пораженного сустава). После верификации диагноза производили оценку костных дефектов вертлужной впадины с указанием их размеров и локализации для предоперационного планирования, используя классификацию R.W. Paprosky [1]. Распределение пациентов по типам костных дефектов было представлено следующим образом: 1 тип – 5 пациентов (17 %), 2А тип – 9 пациентов (32 %), 2В тип – 5 пациентов (17 %), 2С тип – 3 пациента (10 %), 3А тип – 5 пациентов (17 %), 3В тип – 2 пациента (7 %).
Оперативное вмешательство осуществлялось под тотальной внутривенной анестезией с применением миорелаксантов в условиях ИВЛ воздушно-кислородной смесью. Во всех случаях применялся переднелатеральный доступ по Хардингу. Тактика выбора имплантируемой чашки эндопротеза зависела от типа дефекта вертлужной впадины и состояния ее костной ткани. В 21 случае (73 %) был избран бесцементный тип фиксации эндопротеза, у 7 пациентов (24 %) в связи с наличием значительных дефектов применялись укрепляющие кольца типа Бурх – Шнайдер, и в 1 случае (3 %) – чашка Мюллера. Распределение имплантированных чашек эндопротеза в зависимости от типа костного дефекта вертлужной впадины представлено в таблице 1.
Таблица 1
Распределение имплантированных чашек эндопротеза по типам костных дефектов вертлужной впадины
|
Тип дефекта |
Тип чашки эндопротеза (type of cup) |
|||||||
|
Pinnacle Gription (De Puy) |
Bicon (Smith&Nephew) |
Muller ring (Zimmer) |
Burch-Schneider cage (Zimmer) |
|||||
|
Абс. |
Отн.,% |
Абс. |
Отн.,% |
Абс. |
Отн.,% |
Абс. |
Отн.,% |
|
|
1 тип |
5 |
17 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2А тип |
0 |
0 |
8 |
28 |
1 |
4 |
0 |
0 |
|
2В тип |
0 |
0 |
5 |
17 |
0 |
0 |
0 |
0 |
|
2С тип |
0 |
0 |
3 |
10 |
0 |
0 |
0 |
0 |
|
3А тип |
0 |
0 |
0 |
0 |
0 |
0 |
5 |
17 |
|
3В тип |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
7 |
|
Итого |
5 |
17 |
16 |
55 |
1 |
4 |
7 |
24 |
У пациентов с типами 3А и 3В помимо установки укрепляющих колец производилось замещение дефектов костными аллотрансплантатами и трабекулярными аугментами. Средний объем интраоперационной кровопотери составил 458 мл. Среднее время оперативного вмешательства 84 минуты.
Динамическое наблюдение за больными осуществлялось при контрольном осмотре через 3, 6, 12 месяцев, а затем 1 раз в год. При осмотре производилась оценка болевого синдрома и функциональных результатов лечения при помощи модифицированной шкалы Харриса, визуально-аналоговой шкалы боли, а также оценка качества жизни пациентов с применением унифицированной анкеты-опросника SF-36. Фиксация вертлужного компонента и признаки нестабильности компонентов оценивались по данным рентгенологического исследования. Всем пациентам с дефектами вертлужной впадины 3 типа с целью оценки остеинтегрирования примененных трансплантатов осуществлялась компьютерная томография. Полученные данные были обработаны с помощью программы STATISTICA (версия 10.0). Сравнение количественных параметров производилось с использованием непараметрического U-критерия Манна – Уитни. Данные были представлены в виде Me (LQ – UQ), где Me – медиана, (LQ – UQ) – интерквартильный разброс. Статистическая гипотеза считалась достоверной при р<0,05. Исследование производилось на основании подписания информированного согласия пациентами и разрешения этического комитета в соответствии с этическими стандартами, разработанным в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинский исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266.
Результаты. Средний срок послеоперационного наблюдения составил 25 месяцев (минимальный срок – 15 месяцев, максимальный срок – 39 месяцев).
При оценке клинических результатов с помощью модифицированной шкалы Харриса хорошие (80–89 баллов) и отличные (90–100 баллов) результаты были получены в 93 % случаев (27 артропластик). С увеличением времени, прошедшего после оперативного вмешательства, отмечался рост значений функционального состояния и уменьшение болевого синдрома. Распределение результатов ревизионного эндопротезирования в зависимости от степени костного дефекта вертлужной впадины представлено в таблице 2.
Таблица 2
Распределение результатов ревизионного эндопротезирования в зависимости от степени костного дефекта вертлужной впадины
|
Результат по Харрису |
Тип дефекта |
Итого |
|||||
|
1 |
2А |
2В |
2С |
3А |
3В |
||
|
Отличный |
5 (17%) |
7 (24,5%) |
2 (7%) |
2 (7%) |
2 (7%) |
0 |
18 (62%) |
|
Хороший |
0 |
1 (3,5%) |
3 (10%) |
1 (3,5%) |
3 (10%) |
1 (3,5%) |
9 (31%) |
|
Удовлетвори тельный |
0 |
0 |
0 |
0 |
0 |
1 (3,5%) |
1 (3,5%) |
|
Неудовлетво- рительный |
0 |
1 (3,5%) |
0 |
0 |
0 |
0 |
1 (3,5%) |
Динамика показателей функционального состояния и болевого синдрома показана на рисунке 1.
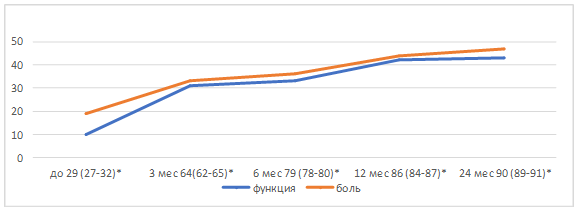
Рис. 1. Динамика значений показателей функционального состояния и болевого синдрома: - статистически достоверные различия между значениями по шкале Харриса до и после оперативного лечения через 6, 12 и 24 месяца при р<0,001
Удовлетворительные результаты (70 – 79 баллов) были получены у 1 пациента (3,5 %) в возрасте старше 70 лет. Пациент передвигался при помощи средств дополнительной опоры (трость). Болевой синдром носил временный характер и возникал после длительной ходьбы. Имелось умеренное ограничение функции в оперированном суставе, не повлиявшее на социальную адаптацию пациента.
Неудовлетворительный результат (менее 70 баллов) был получен у 1 пациентки (3,5%) с дефектом вертлужной впадины типа 2А, ревизионное эндопротезирование которой осуществлялось при помощи укрепляющего кольца Мюлера, в связи с развитием глубокого параимплантарного нагноения через 6 месяцев после оперативного лечения. В анамнезе данной больной за 2 месяца до возникновения осложнения было зарегистрировано обострение хронического пиелонефрита. Пациентке проведено удаление компонентов с установкой артикулирующего спейсера до купирования инфекционного воспаления сроком на 5 месяцев. Впоследствии осуществлялась замена спейсера на укрепляющее кольцо типа Бурх – Шнайдер. Послеоперационный период протекал без особенностей. Через 1 год балл по шкале Харриса составил 82 балла.
Ревизионное эндопротезирование практически во всех случаях (28 пациентов – 96,5 %) позволило избавить пациентов от болевого синдрома. Лишь у 1 пациента (3,5 %) отмечался болевой синдром средней степени интенсивности, возникающий после длительной ходьбы, локализовавшийся в области ягодичных мышц. Средний показатель визуально-аналоговой шкалы боли (ВАШ) после проведенного оперативного лечения снизился с 7 (8–9) до 1 (1-2).
У всех пациентов (100 %) в дооперационном периоде отмечалось наличие хромоты различной степени выраженности. Наличие хромоты и необходимость в использовании средств дополнительной опоры оценивались через 12 месяцев после оперативного лечения. У 18 пациентов хромота полностью отсутствовала и не требовала применения средств дополнительной опоры. У 9 больных отмечалась хромота легкой степени, требовавшая применения трости при ходьбе на дальние расстояния (более 5 километров). У 1 пациента отмечалась хромота умеренной степени выраженности, связанная с возникающим болевым синдромом (наличие фиброзной фиксации) при ходьбе на расстояния более 1 километра, что требовало применения трости. Также у 1 пациента в связи с развитием глубокой параимплантарной инфекции отмечалась выраженная хромота с необходимостью применения костылей. Распределение пациентов по наличию хромоты в послеоперационном периоде представлено на рисунке 2.
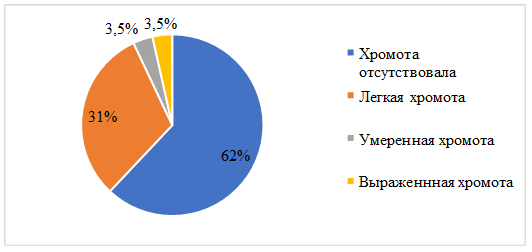
Рис. 2. Распределение пациентов по наличию хромоты
после оперативного лечения
Оценка объема движений в оперированном тазобедренном суставе производилась через 3 месяца после операции. Полный объем функции был получен у 20 пациентов, незначительное ограничение – у 7 пациентов, умеренное ограничение – у 1 пациента (пациент с фиброзной фиксацией чашки эндопротеза), выраженное ограничение – у 1 пациента (пациент с развившимся глубоким параимплантарным нагноением). Распределение больных по объему движений в оперированном тазобедренном суставе представлено на рисунке 3.
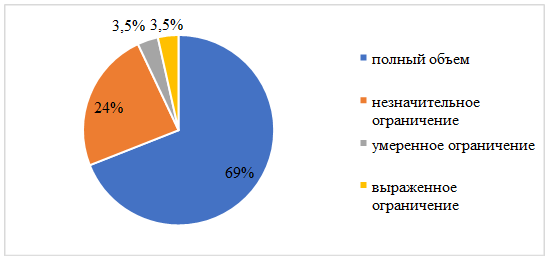
Рис. 3. Распределение пациентов по объему движений
в оперированном тазобедренном суставе
Рентгенологическая оценка состояния эндопротеза производилась по двум стандартным проекциям. Основное внимание уделялось выявлению нестабильности ацетабулярного и бедренного компонентов, остеоинтеграции металлоконструкций и примененных трансплантатов. Оценка положения вертлужного компонента производилась в динамике со сравнением показателей и включала определение угла наклона вертлужного компонента, угла антеверсии, степени покрытия чашки эндопротеза. Абсолютным показателем нестабильности являлась миграция компонента с изменением данных в динамике. Угол наклона вертлужного компонента составлял 40 (39–42) градусов. Угол антеверсии 11 (10–12) градусов. Степень покрытия чашки эндопротеза 93 (90–98) процента. Существенных различий в линейных показателях позиционирования ацетабулярного компонента выявлено не было, что говорило об отсутствии его миграции. В 27 случаях в динамике отмечались признаки остеоинтеграции на границе «кость-имплант» и «кость-аугмент». Начальные признаки перестройки губчатых аллотрансплантатов наблюдались на рентгенограммах в среднем через 2 (1–3) месяца и проявлялись в виде сглаженности их контуров. Окончательная перестройка губчатых аллотрансплантатов отмечалась у всех пациентов в среднем через 7 (5–8) месяцев. На рентгенограммах наблюдалась однородная костная ткань. У 1 пациента (удовлетворительный результат лечения) отмечалось появление линии просветления в зонах II и III по DeLee – Charnley шириной 1мм, сопровождавшееся периодически возникающим болевым синдромом после длительной ходьбы, а также умеренным нарушением функции в оперированном суставе, через 6 месяцев после операции. Наличие линии просветления шириной 1 мм говорило о фиброзной фиксации чашки эндопротеза. Увеличения ширины линии просветления в динамике не наблюдалось. Миграции чашки эндопротеза за время наблюдения не отмечалось. Признаков нестабильности бедренных компонентов и смещения антипротрузионных колец выявлено не было. Во всех случаях наблюдалась костная интеграция ножки эндопротеза. Линий просветления по зонам Gruen ни в одном случае выявлено не было. Вывихов головки эндопротеза и перипротезных переломов бедренной кости за время наблюдения не зарегистрировано.
Показатели физического и ролевого функционирования, болевой синдром и состояние общего здоровья после оперативного лечения при оценке стандартизированной анкеты-опросника SF-36 статистически значимо отличались от дооперационных результатов (р<0,001). Однако показатели жизненной активности (ощущение себя полным сил и энергии или напротив), социального функционирования (ограничение социальной активности (общения) в зависимости от физического и эмоционального состояния), ролевого функционирования (влияние эмоционального состояния на выполнение повседневной деятельности) и психического здоровья (общий показатель положительных эмоций) на дооперационном этапе находились на высоком уровне и значительно не отличались от послеоперационных результатов (табл. 3).
Таблица 3
Оценка качества жизни пациентов по опроснику SF-36
|
Показатель |
До операции |
После операции |
|
Физическое функционирование |
17 (15-20) |
87* (84-89) |
|
Ролевое (физическое) функционирование |
11 (10 – 14) |
89* (86-92) |
|
Боль |
12 (10-15) |
90* (88 – 93) |
|
Общее здоровье |
33 (30-35) |
91* (89-94) |
|
Жизненная активность |
80 (77-82) |
84 (81-86) |
|
Социальное функционирование |
84 (81 – 88) |
85 (82 – 88) |
|
Ролевое (эмоциональное) функционирование |
89 (86 – 92) |
91 (89 – 93) |
|
Психологическое здоровье |
83 (80 – 85) |
85 (83-88) |
Примечание: * - статистически значимые различия между показателями до и после лечения при р<0,01.
Обсуждение. Асептическая нестабильность вертлужного компонента – самое распространенное осложнение первичного эндопротезирования тазобедренного сустава. Одной из основных методик лечения в настоящее время признается изолированная замена чашки эндопротеза. По данным литературных источников, отдаленные результаты показали высокую эффективность операции и низкий процент развития нестабильности сохраненного бедренного компонента [8]. Преимуществами методики, как указывают зарубежные авторы, является уменьшение времени оперативного вмешательства, объема интраоперационной кровопотери и сохранение костного массива бедренной кости [9]. Функциональные результаты после оперативного лечения в данном исследовании также статистически значимо отличались от дооперационных, а средний балл по шкале Харриса возрос с неудовлетворительного до хорошего. За весь срок наблюдения ни у одного пациента расшатывания ножки эндопротеза зарегистрировано не было. Говоря об ацетабулярном компоненте, необходимо отметить, что ревизионное эндопротезирование при костных дефектах 1 типа, как правило, не вызывает значительных трудностей, при этом замещение дефектов 2 и 3 типа по Paprosky является серьезной проблемой. Особое значение в данной ситуации принимает пластика лизированного массива вертлужной впадины и применение антипротрузионных и укрепляющих колец. Выбор трансплантата является весьма актуальным и дискутабельным вопросом, не нашедшим в настоящее время единого ответа. Для замещения и восстановления опорности вертлужной впадины применяют различные ауто- и аллотрансплантаты, аугменты из пористого металла, биосовместимые остеокондуктивные материалы на основе биологической матрицы. Все из предложенных современной медициной и инженерией материалы имеют свои преимущества и недостатки. Еще в 1999 году S.S. Leopold с соавторами провели исследование, в котором производили замещение дефектов вертлужной впадины ауто- и аллокостью. В итоге, у 84 % пациентов был отмечен положительный результат, проявлявшийся в стабильности ацетабулярного компонента [10]. В нашем исследовании аутокость была применена у 4 пациентов с дефектами типа 3А и 3В. В динамике у всех больных отмечена окончательная перестройка аллотрансплантата в сроки в среднем до 7 месяцев. Примененные танталовые аугменты также показали высокую эффективность в замещении значительных костных дефектов вертлужной впадины. Ни у одного пациента с пластикой пористым металлом за весь срок наблюдения развития нестабильности чашки эндопротеза зарегистрировано не было. Подобные результаты были показаны в исследовании Jeong Min и соавторов, опубликованных в 2016 году [11]. Лечение значительных дефектов вертлужной впадины помимо пластики достаточно часто сочетается с применением антипротрузионных колец типа Бурх – Шнайдер. В исследовании Lim Seung-Jae и соавторов в 2014 году данные конструкции показали высокую эффективность в создании стабильности вертлужного компонента, что сопоставимо с полученными нами результатами [12]. Во всех случаях получены признаки интегрирования антипротрузионного кольца. Одной из проблем, с которой сталкиваются хирурги в послеоперационном периоде, является возникновение инфекционных осложнений. По данным современной литературы, процент параимплантарных нагноений составляет от 2,3 % до 4,3 %, предрасполагающим фактором к развитию которых указывается значительный объем оперативного вмешательства [13]. В нашем исследовании у 1 больного (3,5 %) через 6 месяцев после лечения развилась глубокая параимплантарная инфекция, потребовавшая проведения повторных ревизионных вмешательств. Вероятно, в данном случае причинами развития явились обострение хронической инфекции мочеполового тракта и значительный объем вмешательства (дефект вертлужной впадины типа 2А по Paprosky с установкой укрепляющего кольца Мюллера и костной пластикой аллотрансплантатами).
Выводы
1. Применение антипротрузионных укрепляющих колец в сочетании с пластикой позволяет эффективно бороться с костными дефектами вертлужной впадины 3 типа и получить хорошие результаты оперативного лечения.
2. Развития асептической нестабильности в сохраненном бедренном компоненте при изолированной замене чашки эндопротеза в сроки до 3 лет ни в одном случае выявлено не было.
3. Изолированная замена ацетабулярного компонента при его нестабильности является эффективной методикой лечения с низким процентом послеоперационных осложнений.
Конфликт интересов: не заявлен.



