Известно, что хорионический гонадотропин, являясь ключевым гормоном беременности, способен оказывать действие на иммунную систему на уровне предшественников зрелых Т-лимфоцитов [1], в результате этого происходит активация гуморального и подавление клеточного иммунного ответа. Так, в тимусе небеременных мышей при введении хорионического гонадотропина увеличивается количество Ki-67 позитивных клеток, что доказывает влияние этого гормона на пролиферативные процессы [2]. Вместе с тем торможение пролиферации и снижение числа митозов при ускорении дифференцировки лимфоцитов в тимусе наблюдается при выключении периферического отдела симпатической нервной системы [3]. Существует прямая зависимость морфофункционального состояния тимуса от активности симпатоадреналовой системы [4]. Тимус быстро и разнообразно реагирует на любые воздействия благодаря тому, что на лимфоцитах имеются рецепторы к катехоламинам [5].
Важную роль для различных стадий дифференцировки лимфоцитов играет ядерный белок р-53 – фактор транскрипции, который регулирует клеточный цикл и активирует белки, участвующие в репарации поврежденной ДНК. Если поврежденную ДНК восстановить невозможно, то белок р-53 запускает апоптоз [6], процессы которого, наряду с процессами пролиферации, являются основными механизмами, контролирующими иммунный гомеостаз. В связи с этим участие катехоламинов в процессах с участием белка p-53 при адаптации тимуса мышей к поступлению хорионического гонадотропина представляет определенный научный интерес.
Целью исследования явилось изучение морфологических, иммуногистохимических характеристик и катехоламинсодержащих структур тимуса мышей на фоне введения хорионического гонадотропина.
Материал и методы
Объектом исследования служил тимус 100 белых лабораторных небеременных четырехнедельных мышей-самок, содержавшихся в условиях лабораторного вивария на стандартном рационе со свободным доступом к воде и корму. Животные были разделены на 3 группы: I – интактная группа (n=20); II – контрольная группа: внутримышечно вводили 0,02 мл физраствора (Люблинский фармацевтический завод, Польша) на животное 2 раза в неделю: II А – в течение одной недели (n=10); II Б – в течение двух недель (n=10); II В – в течение трех недель (n=10); II Г – в течение четырех недель (n=10); III – опытная группа: мышам вводили 2 Международных единицы (МЕ)/животное раствора хорионического гонадотропина (ФГУП «Московский эндокринологический завод», Россия), 2 раза в неделю: III А – в течение одной недели (n=10); III Б – в течение двух недель (n=10); III В – в течение трех недель (n=10); III Г – в течение четырех недель (n=10).
Дозировку гормона рассчитывали в зависимости от веса животных так, чтобы она была эквивалентна 500 МЕ – дозировке, применяемой в клинической практике. Все инъекции проводились с соблюдением правил асептики и антисептики. Процедуры по уходу за животными осуществляли согласно «Правилам проведения работ с использованием экспериментальных животных» («Приказ МЗ РФ от 19.06.2003 г. № 267») и в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях».
Тимус извлекался в одно и то же время суток с 16 до 18 часов, непосредственно после декапитации животных, часть органа замораживали для последующего приготовления криостатных срезов и постановки люминесцентно-гистохимических реакций, часть органа фиксировали в 10 % растворе формалина с последующей заливкой в парафин и проведением иммуногистохимических реакций.
Люминесцентно-гистохимический метод Фалька – Хилларпа в модификации Е.М. Крохиной [7] применялся для выявления в тимусе адренергических нервных волокон и клеток, содержащих катехоламины. Криостатные срезы тимуса инкубировали в камере в парах формальдегида («Лабтех», Россия) в течение 60 минут при температуре 80 °С. Люминесцентный метод основан на реакции моноаминов с формальдегидом, в ходе которой образуются флуоресцирующие соединения. При этом происходит цепь химических реакций, в результате которых с начала катехоламины превращаются в 6,7-диокси-1,2,3,4-тетрагидроизохинолин и 4,6,7-триокси-1,2,3,4-тетрагидроизохинолин, а затем в процессе дегидрогенизации из них образуются флуоресцирующие соединения – 3,4-дигидро-изохинолины. При просматривании препаратов под люминесцентным микроскопом с использованием запирающегося фильтра низкие концентрации флуоресцирующих соединений визуализируются изумрудно-зеленым цветом, высокие – желтым цветом. Микроскопия препаратов тимуса производилась под люминесцентным микроскопом при длине возбуждающего света 360 нм (люминесцентный микроскоп ЛЮМАМ-4А (ЛОМО, СССР).
Количественный уровень катехоламинов в тимусе определяли методом цитоспектрофлуориметрии с использованием люминесцентной фотометрической насадки ФМЭЛ-1А (ЛОМО, СССР) и выражали в условных единицах флуоресценции (усл. ед.).
Клетки, экспрессирующие белок p-53, выявляли иммуногистохимическим методом непрямого иммуноферментного анализа [8]. Применяли поликлональные антитела к белку апоптоза р-53 (Santa Cruze, CША). Согласно протоколу производителя окрашивание проводили ручным и аппаратным способами с использованием иммуногистохимических автоконтейнеров AUTOSTAINER-360 (THERMO, Великобритания) и Leica BOND-MAX (Германия). Продукты иммунной реакции визуализировались при помощи стрептавидин-биотинового пероксидазного метода («Dako», LSAB+Kit,HRP), раствор диаминобензидина («Dako», Liguid DAB+) применяли в качестве красящего соединения.
Статистическая обработка полученного цифрового массива проводилась с помощью программы Microsoft Office Excel, оценка статистической значимости различий средних величин проводилась с применением критерия Манна – Уитни. Определяли значимость различий показателей контрольных (введение физраствора) и опытных групп (введение ХГ) между собой и по сравнению с интактной группой: * – различия с контрольной группой, p < 0,05; ** – различия с контрольной группой, p < 0,001; ри – различия с интактной группой, ри < 0,05 и ри < 0,001. Средние значения (M) далее в тексте приведены со стандартной ошибкой среднего значения (m).
Результаты исследования. Люминесцентная микроскопия тимусной дольки мышей позволяет идентифицировать мозговое вещество (МВ), корковое вещество (КВ), границу между корковым и мозговым веществом. В корковом веществе долек тимуса и вокруг мозгового вещества дольки располагаются люминесцирующие гранулосодержащие клетки (ЛГК), при иммерсионном увеличении (х900) в них видны отдельные гранулы беловато-желтого цвета (рис. 1).

Рис. 1. Введение ХГ в течение четырех недель.
Катехоламинсодержащие клетки коркового вещества долек тимуса мыши.
Метод Фалька – Хилларпа. Микроскоп ЛЮМАМ-4А. Об.40. Ок.10
Люминесцентная микроскопия выявляет в тимусе и тучные клетки [2]. Также определяются адренергические нервные волокна, проникающие в дольки тимуса в виде периваскулярных сплетений. Нервные окончания располагаются в корковом веществе долек тимуса в непосредственной близости с ЛГК между корковым и мозговым веществом и ЛГК коркового вещества, они имеют изумрудно-зеленый цвет.
Поступление в организм физиологического раствора на разных сроках эксперимента визуально не изменяет ни люминесцентно-морфологическую картину долек тимуса мышей, ни яркость свечения гранул в содержащих их клетках. В свою очередь, введение хорионического гонадотропина сопровождается появлением на границе коркового и мозгового вещества долек тимуса второго ряда люминесцирующих клеток – «удвоением» кортико-медуллярной границы, при этом визуально увеличивались размеры мозгового вещества, а гранулосодержащие клетки казались менее яркими.
Проведенная цитоспектрофлуориметрия показала, что введение гормона существенно изменяет интенсивность люминесценции катехоламинов в изучаемых структурах тимуса, при этом для интактной группы и всех контрольных групп показатели были вполне сопоставимы (Таблица 1a, 1b). Данные таблицы показывают, что в подавляющем большинстве структур, содержащих катехоламины, на всех сроках введения гормона наблюдается снижение интенсивности их люминесценции.
Таблица 1а
Интенсивность люминесценции катехоламинов в структурах тимуса мышей
(усл. ед. х102, M±m) при введении хорионического гонадотропина (ХГ)
|
Структуры тимуса |
Интактная группа мышей ( I ) |
Длительность опыта |
|||
|
1 неделя |
2 недели |
||||
|
Группы мышей |
Группы мышей |
||||
|
III А ( ХГ ) |
II А (Физ. р-р) |
III Б (ХГ) |
II Б Физ. р-р |
||
|
ЛГК на границе КВ и МВ |
8,80±2,59 |
3,60±0,13** ри <0,001 |
8,10±0,24 |
4,83±1,92** ри <0,001 |
8,45±1,34 |
|
ЛГК КВ долек |
7,84±1,38 |
3,59±0,18** ри <0,001 |
7,15±0,36 |
6,27±2,43** ри <0,001 |
7,50±2,08 |
|
Лимфоциты МВ долек |
8,67±2,69 |
3,47± 0,12** ри <0,001 |
8,20±0,18 |
8,25±0,24** ри <0,001 |
8,45±1,06 |
|
Лимфоциты КВ долек |
9,90±0,55 |
3,81± 0,27* ри <0,001 |
9,55±0,46 |
5,29±2,09** ри <0,001 |
9,35±0,78 |
|
Адренергические нервы |
6,90±0,86 |
5,95±2,00* |
6,40±1,51 |
7,90±1,11* |
6,70±2,99 |
Примечание:
* p < 0,05; ** p < 0,001 – уровень достоверности различий по отношению к контрольной группе мышей;
ри < 0,05; ри < 0,001 – уровень достоверности различий по отношению к интактной группе мышей.
Таблица 1b
|
Структуры тимуса |
Интактная группа мышей ( I ) |
Длительность опыта |
|||
|
3 недели |
4 недели |
||||
|
Группы мышей |
Группы мышей |
||||
|
III А ( ХГ ) |
II А (Физ. р-р) |
III Б (ХГ) |
II Б Физ. р-р |
||
|
ЛГК на границе КВ и МВ |
8,80±2,59 |
2,73±0,9** |
8,70± 0,75 |
3,49± 0,07 ри<0,05 |
7,85±0,67 |
|
ЛГК КВ долек |
7,84±1,38 |
2,49±0,79** |
7,00±0,75 |
3,49±0,11 |
7,20±0,73 |
|
Лимфоциты МВ долек |
8,67±2,69 |
2,88±0,73** ри<0,001 |
8,75±0,28 |
3,52±0,08 ри<0,001 |
8,55±0,97 |
|
Лимфоциты КВ долек |
9,90±0,55 |
3,25±0,07** ри<0,05 |
9,60±0,22 |
3,54±0,07** ри<0,001 |
9,60±0,73 |
|
Адренергические нервы |
6,90±0,86 |
3,45±0,93* ри<0,001 |
5,90±0,29 |
2,80±1,39 ри<0,001 |
5,87±0,88 |
Интенсивность люминесценции катехоламинов в структурах тимуса мышей (усл. ед. х102, M±m) при введении хорионического гонадотропина (ХГ)
Примечание:
* p < 0,05; ** p < 0,001 – уровень достоверности различий по отношению к контрольной группе мышей;
ри < 0,05; ри < 0,001 – уровень достоверности различий по отношению к интактной группе мышей.
Иммуногистохимическая реакция с использованием антител к маркеру апоптоза белку р-53 позволила нам выявить клетки с коричневой окраской цитоплазмы и цитоплазматической мембраны разной степени интенсивности в корковом и мозговом веществах долек тимуса и произвести их подсчет (рис. 2, таблица 2).
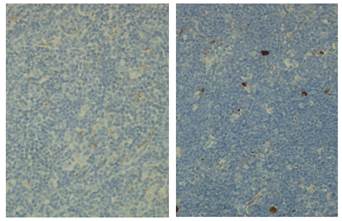
Рис. 2. Позитивная реакция на белок p-53 в клетках мозгового (слева) и коркового (справа) вещества долек тимуса мыши. Клетки, содержащие белок p-53, имеют коричневую окраску. Микроскоп Leica DM4000B. Об.40. Ок.10
Таблица 2
Количество клеток, содержащих белок р-53, в поле зрения в морфофункциональных зонах долек тимуса экспериментальных мышей, шт.
|
Корковое вещество долек |
Мозговое вещество долек |
|||
|
Группы мышей |
Интактные |
Получавшие ХГ |
Интактные |
Получавшие ХГ |
|
1 неделя |
4,0±0,5 |
3,6±0,5 |
0 |
0 |
|
2 недели |
3,0±0,3 |
12,0±0,9* |
0 |
6,7±0,4 |
|
3 недели |
4,0±0,6 |
18,2±0,8* |
0 |
3,6±0,3 |
|
4 недели |
4,0±0,4 |
25,2±1,3** |
0 |
2,5±0,2 |
* – различия с интактной группой статистически значимы, p < 0,05;
** – различия с интактной группой статистически значимы, p < 0,001.
Данные таблицы свидетельствуют о том, что имеет место прямая зависимость между длительностью введения хорионического гонадотропина и увеличением количества клеток, содержащих белок р-53 в корковом веществе долек тимуса мышей. Кроме того, обращает на себя внимание появление клеток, содержащих белок р-53, в мозговом веществе долек тимуса мышей, получавших гормон.
Обсуждение полученных данных. Поступление хорионического гонадотропина приводит к увеличению экспрессии белка р-53 в клетках коркового вещества долек тимуса прямо пропорционально длительности воздействия. На протяжении всего срока эксперимента интенсивность люминесценции катехоламинов в структурах тимусной дольки мышей опытных групп снижена по сравнению с интактными животными, что может свидетельствовать о возможном участии нейромедиаторных биогенных аминов, в частности катехоламинов, в процессах апоптоза в клетках тимуса мышей при действии хорионического гонадотропина. Результаты нашего исследования хорошо согласуются с имеющимися литературными данными. Так, обнаружена прямая связь между катехоламинергической иннервацией и экспрессией белков апоптоза: просходит усиление синтеза белка р-53 при обеднении иннервации в нейронах гипоталамуса [9]. Роль рецепторов к адреналину в развитии CD4+ лимфоцитов подчеркивается в работе W. N. Kin, V. M. Sanders [5]. Моделирование иммунного ответа in vitro показывает, что при добавлении в среды культивирования норадреналина наблюдается максимальное приближение результатов опытов к процессам, происходящим в живом организме. Роль катехоламинов в микроокружении лимфоцитов в становлении и развитии иммунного ответа рассмотрена и М. А. Самотруевой и соавторов [10]. В то же время литературный обзор, посвященный медиаторам стресса матери и плода во время беременности, свидетельствует, что стресс обеспечивается многими синергетическими механизмами передачи, к которым, наряду с кортизолом, можно отнести катехоламины, серотонин, цитокины и материнскую микрофлору [11]. Заслуживает внимания публикация, в которой роль катехоламинов в процессе влияния материнского стресса на развитие плода выделяется в качестве самостоятельной научной проблемы [12]. Проведенные нами исследования дают основание предположить, что, хорионический гонадотропин, изменяя выделение катехоламинов из периферических нервных волокон и тучных клеток, наряду с иммуномодулирующей функцией, наблюдаемой нами в тимусе лабораторных мышей, осуществляет еще и другую функцию – снижает для плода риск от возможных негативных последствий стресса, которым является для материнского организма беременность.
Заключение
Введение хорионического гонадотропина на всех сроках воздействия приводит к уменьшению интенсивности люминесценции в подавляющем большинстве катехоламинсодержащих структур тимуса лабораторных мышей. При этом в корковом веществе долек тимуса имеет место прямая зависимость между длительностью введения хорионического гонадотропина и увеличением количества клеток, содержащих белок р-53.



