Рак шейки матки (РШМ) продолжает оставаться наиболее частой злокачественной опухолью женских половых органов. В последние годы отмечена негативная тенденция за счет роста заболеваемости у женщин молодого возраста с ежегодным приростом на 2–7 % [2, 9].
Во многих онкологических клиниках инициальным лечением местно-распространенных форм рака шейки матки (МРРШМ) являются неоадъювантная химиотерапия (НАХТ) или химиолучевое лечение [12]. Однако стандартное внутривенное введение химиопрепаратов далеко не всегда позволяет перевести опухоль в резектабельное состояние и выполнить стандартное радикальное хирургическое вмешательство из-за формирования резистентности опухоли к цитостатикам [5,6].
Экстракорпоральные методы детоксикации, в частности, плазмаферез, может повысить эффективность цитостатической терапии за счет деблокирования рецепторного аппарата клетки и уменьшения резистентности к химиопрепаратам, неизбежно развивающейся в процессе любого лечения, особенно в условиях опухолевой интоксикации [11]. В исследованиях Г.А. Неродо, проведенных в Ростовском научно-исследовательском онкологическом институте, показано, что проведение сеанса плазмафереза перед неоадъювантной химиотерапией у больных асцитными формами рака яичников способствует оптимизации состояния общей реактивности организма, обеспечивая компенсацию эндогенной интоксикации и позволяя сохранять дозовую интенсивность химиотерапии у больных с высоким риском развития осложнений [7,8,10].
Вирус папилломы человека является обязательным этиологическим фактором рака шейки матки. При этом известно, что в случае развития рака шейки матки иммунный статус организма позволяет персистирующей папилломовирусной инфекции индуцировать начало и прогрессирование опухолевого процесса.
Ковчуром П.И. доказано положительное влияние иммуномодулятора «аллокин-альфа» на иммунный статус организма больных пре- и микроинвазивным раком шейки матки, что позволяет считать возможным применение этого препарата в комплексном лечении больных инвазивными формами местно-распространенных форм рака шейки матки [3].
Важным аспектом механизма действия плазмафереза и неспецифической иммунотерапии при проведении лекарственного лечения рака шейки матки T1b2-2bN0-1M0 стадий может служить формирование симптомокомплекса общей неспецифической адаптационной реакции (ОНАР), типы которой характеризуются различной направленностью морфо-функциональных изменений и состоянием неспецифической резистентности в организме: от патологических стрессорных (в острой и хронической форме) с низким уровнем резистентности до физиологических антистрессорных, соответствующих ОНАР тренировки, спокойной и повышенной активации с характерным высоким уровнем резистентности [1].
Цель исследования: изучить и сравнить структуру и характер интегральных адаптационных реакций больных раком шейки матки T1b2-2bN0-1M0 стадий при проведении различных модификаций неоадъювантной химиотерапии.
Материалы и методы
В представленной работе проанализирована структура общей неспецифической адаптационной реакции 47 больных местно-распространенными формами рака шейки матки T1b2-2bN0-1M0 стадий. Больные были репродуктивного возраста (от 25 до 48 лет). Всем больным лечение начинали с неоадъювантной химиотерапии по схеме: цисплатин, блеомицетин. В первой группе (12 больных) и во второй группе (15 больных) началу курса НАХТ предшествовал сеанс гравитационного лечебного плазмафереза. Отличием второй группы от первой явилось дополнительное проведение курса неспецифической иммунотерапии препаратом «аллокин-альфа», который начинали на следующий день после окончания курса химиотерапии (суммарная курсовая доза составила 6 мг). В третью группу вошли 20 больных, получавших только неоадъювантную химиотерапию по общепризнанной стандартной методике.
В процессе лечения идентификация структуры общей неспецифической адаптационной реакции проводилась индивидуально у каждой пациентки всех групп. Определяли тип общей неспецифической адаптационной реакции по морфологическому составу крови (формула Шиллинга), сигнальным параметрам порядка общей неспецифической адаптационной реакции – уровнем лимфоцитов, параметрами напряжения и неполноценности общей неспецифической адаптационной реакции – уровнем лимфоцитов, параметрами напряжения и неполноценности общей неспецифической адаптационной реакции – эозинофилов, моноцитов и общего числа лейкоцитов. Подсчет элементов вели в мазках крови, окрашенных по Романовскому – Гимза, используя метод миандров с обеих сторон мазка по 100 клеток.
Результаты и обсуждение
В исходном состоянии у больных первой группы доля реакций тренировки превосходила в 3 раза частоту выявления стресса и в 1,5 раза – других антистрессорных реакций.
Структура общей неспецифической адаптационной реакции после проведения дискретного плазмафереза включала исключительно антистрессорные реакции: увеличение в 5,5 раз частоты развития реакции спокойной активации и в 2,2 раза повышенной активации. На фоне отсутствия стресса и переактивации полученные данные свидетельствовали о физиологическом влиянии плазмафереза на адаптивный статус пациенток (рис.1).
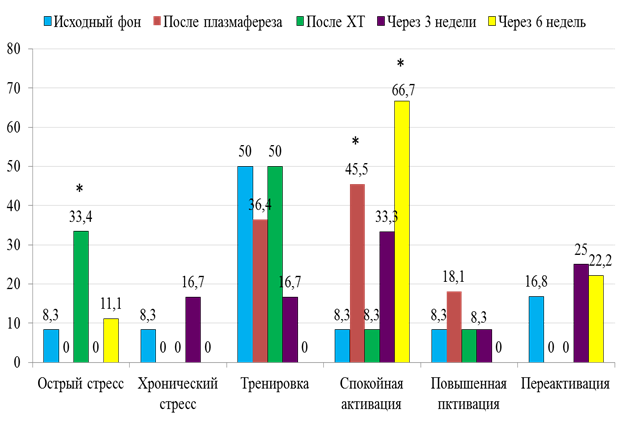
Рис.1. Структура адаптационных реакций у больных 1 группы.
* – различия достоверны по сравнению с исходным фоном
Непосредственно сразу после проведения курса неоадъювантной химиотерапии структура общей неспецифической адаптационной реакции в первой группе существенно изменилась в связи с формированием у трети пациенток острой формы стресса. В структуре антистрессорных реакций вновь преобладала реакция тренировки, а спокойная и повышенная активация выявлялись в единичных случаях. Через 3 недели в первой группе больных острой формы стресса не отмечали ни в одном случае, а частота хронического стресса была в 4,5 раза меньше, чем антистрессорных реакций. Из реакций физиологического типа самой частой была спокойная активация, при этом отмечено формирование переактивации, доля которой была в 3 раза больше, чем повышенной активации. Через 6 недель (от исходного фона) достоверно преобладала частота развития реакций спокойной активации, которая отмечена у большинства больных и была выше доли стрессорных реакций в 6 раз.
Включение в программу лечения сеанса дискретного плазмафереза во второй группе больных перед проведением курса неоадъювантной химиотерапии в сочетании с иммунотерапией сопровождалось изменением фоновой структуры общей неспецифической адаптационной реакции. Количество антистрессорных реакций уменьшилось за счет перехода в хроническую форму стресса. Ни в одном случае не отмечено острой формы стресса, при этом доля хронического стресса увеличилась в 2 раза. Изменения коснулись и структуры антистрессорных реакций: в 2 раза уменьшилась доля реакций тренировки, тогда как количество реакций спокойной активации достоверно возросло. Несмотря на увеличение доли хронического стресса, общегрупповая структура общей неспецифической адаптационной реакции свидетельствовала о достаточно высоком биоадаптивном потенциале организма перед проведением химиотерапии.
После проведения первого курса неоадъювантной химиотерапии ситуация коренным образом изменилась подобно той, что наблюдалась в первой группе больных, получавших химиотерапию без иммуномодуляторов. Применение иммунотерапии в схеме лечения позитивно отразилось на структуре общей неспецифической адаптационной реакции. Через 3 недели после проведения химиоиммунотерапии идентифицированы антистрессорные реакции тренировки и спокойной активации в 80 % случаев, причем частота последней превышала в 1,7 раза тренировку. Через 6 недель (т.е. через 3 недели после второго курса неоадъювантной химиотерапии) ситуация продолжала оставаться стабильной с той особенностью, что спокойная активация сменилась повышенной (рис. 2).
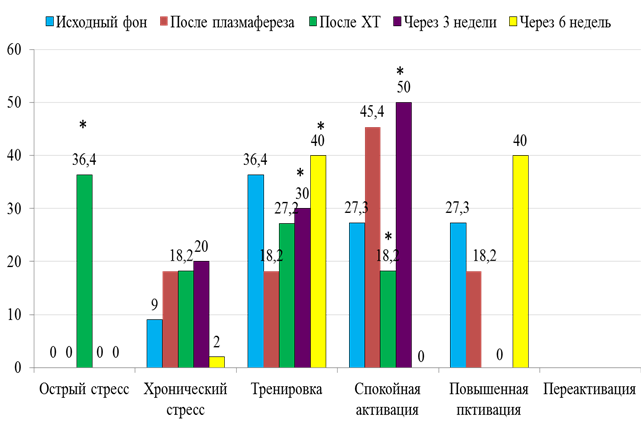
Рис. 2. Структура адаптационных реакций у больных 2 группы.
* – различия достоверны по сравнению с исходным фоном
Таким образом, применение иммунотерапии способствовало удержанию устойчивости антистрессорных реакций.
Достаточно выражено проявился эффект стрессогенности химиотерапии без предварительного плазмафереза в третьей группе больных. Формирование острого и хронического стресса увеличилось относительно исходного фона в 4 раза и составило 61,5 % общегрупповой структуры общей неспецифической адаптационной реакции. В структуре антистрессорных реакций доминировала реакция тренировки. Также соотношение адаптационных реакций подтверждало ингибирование защитных механизмов адаптации при проведении стандартной цитотоксической терапии.
Через 3 недели после проведения первого курса предоперационной химиотерапии в 46 % случаев были выявлены переходы из стресса в спокойную и повышенную активацию. По истечении 6 недель (т.е. после второго курса неоадъювантной химиотерапии) вновь возросла частота развития стресса в хронической форме (в 5,6 раз), не зарегистрирована реакция тренировки, а доля спокойной и повышенной активации в сумме превышала всего в 1,3 раза долю стресса (рис. 3).
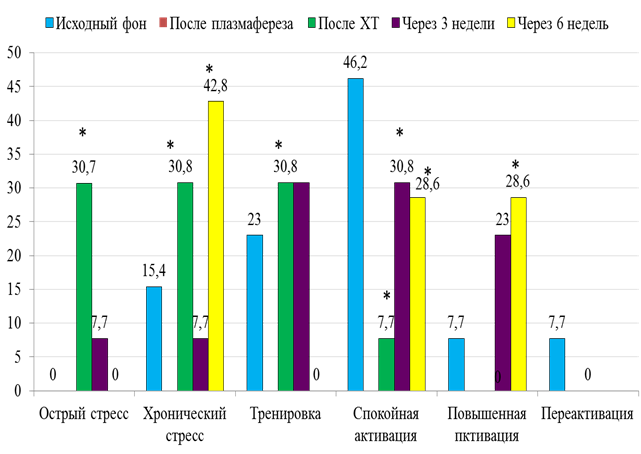
Рис. 3. Структура адаптационных реакций у больных 3 группы.
* – различия достоверны по сравнению с исходным фоном
Выводы
Исходя из вышеизложенного, можно заключить, что неоадъювантная химиотерапия в лечении больных местно-распространенными формами рака шейки матки IB-IIIB стадий с включением в программу лечения экстракорпоральных методов детоксикации, в частности, сеансов лечебного плазмафереза и иммунотерапии препаратом «аллокин-альфа» обеспечивает синергию и пролонгацию активности механизмов антистрессорной защиты, а также улучшение противоопухолевой устойчивости организма больной.
Упреждающая детоксикация является необходимым лечебным звеном при местно-распространенном злокачественном росте, так как позволяет сдерживать стрессогенное влияние химиотерапии на организм.
Включение в программу лечения неспецифической иммунотерапии способствует устойчивости антистрессорных реакций организма.



