Серьезным прогностически значимым осложнением сахарного диабета 1 типа (СД1) является диабетическая нефропатия (ДН), приводящая к хронической почечной недостаточности (ХПН) и являющаяся одной из основных причин смерти больных СД1 [11]. При формировании диабетического повреждения почек дисфункция тубулярного аппарата может предшествовать патологии клубочков, в связи с чем, обнаружение признаков тубулярного повреждения может являться маркером ранней стадии ДН [2]. Существует ряд молекул, которые отражают дисфункцию канальцев почек. По данным литературы к ним относятся N-ацетил-β-D-глюкозаминидаза, нейтрофильный желатиназо-ассоциированный липокаин, ретинол-связывающий белок, печеночная и сердечная формы белка, связывающего жирные кислоты [9]. Роль последнего у больных с ДН изучена недостаточно [7, 14].
Для диагностики диабетического повреждения почек применяется и ультразвуковое исследование (УЗИ) почечных артерий (ПА). Однако работ, характеризующих почечную гемодинамику у взрослых больных СД1 недостаточно [4].
Плохо освещена в литературе и роль радионуклидных методов исследования для диагностики ДН у больных с СД1 [12]. Вместе с тем, необходимо отметить, что динамическая нефросцинтиграфия (ДНСГ) является наиболее точным методом оценки скорости клубочковой фильтрации (СКФ) у лиц с заболеваниями почек, в том числе и у пациентов с СД1 [5].
Цель исследования – оптимизировать с помощью лабораторных и лучевых маркеров раннего повреждения почек алгоритм диагностики ДН у больных с СД1.
Материалы и методы
Исследование выполнено на базе НИИ кардиологии, Томский НИМЦ, кафедрах эндокринологии и диабетологии, лучевой диагностики и лучевой терапии ФГБОУ ВО СибГМУ Минздрава России в период с 2013-2016 гг. Протокол исследования одобрен Локальным Этическим комитетом ФГБОУ ВО СибГМУ Минздрава России (регистрационный номер протокола 3309; дата проведения заседания – 29 апреля 2013 г.).
В исследование было включено 118 пациентов. Все больные подписали информированное согласие на участие в исследовании.
Основная группа - 87 пациентов с СД1 типа (48 мужчин (55,2%) и 39 женщин (44,8%)) в возрасте 28,0 (24,0-36,8) лет, стаж заболевания которых составил 13,0 (7,0-20,0) лет. Диагноз СД устанавливался на основании диагностических критериев СД и других нарушений углеводного обмена (ВОЗ, 1999 г.). Критерии включения в основную группу: диагноз СД1, возраст от 18 до 55 лет, наличие добровольного информированного согласия на участие в исследовании. Критерии исключения: кетоацидоз, нефротический синдром, вирусные и аутоиммунные гепатиты в анамнезе, повышение уровня печеночных трансаминаз более чем в 2,5 раза по сравнению с верхней границей нормы любой этиологии, кардиоваскулярные заболевания (ИБС, сердечная недостаточность, врожденные пороки сердца, эмболия легочной артерии), инфекции мочевыводящих путей, гипотиреоз, нейродегенеративные заболевания головного мозга, терапия тестостероном, беременность. У 18 пациентов с СД1 (20,7%) была диагностирована артериальная гипертензия (АГ).
Контрольная группа - 31 здоровый доброволец (14 (45,2%) мужчин и 17 (54,8%) женщин) в возрасте 25,0 (24,0-27,0) лет без нарушений углеводного обмена и диагноза (АГ). Критерии исключения были аналогичны критериям для пациентов с СД1.
У больных с СД1 показатели HbA1C в 75,4% были выше целевого диапазона и в 24,6% -имели целевой уровень HbA1C. Все больные с СД1 получали заместительную терапию инсулином в базис-болюсном режиме препаратами аналогов инсулина ультракороткого и длительного действия (n=81; 93,1%) либо в режиме помповой инсулинотерапии (n=6; 6,9%).
Для оценки функции почек у пациентов с СД1 проводилось определение содержания креатинина и мочевины в сыворотке, протеинурии в ОАМ и в суточной моче, альбуминурии, расчет СКФ [5]. Уровень альбумина в моче оценивали иммунотурбидиметрическим методом (набор «Микроальбумин-Витал», Россия). В зависимости от величины альбуминурии пациенты с СД1 были разделены на подгруппы: категория А1 – нормоальбуминурия (НАУ, n=30), категория А2 – микроальбуминурия (МАУ, n=29) и категорию А3 – протеинурия (ПУ, n=28). Кроме того, в зависимости от длительности СД1 были выделены подгруппы пациентов, имеющих стаж болезни до 5 лет (n=17), 5-10 лет (n=14), 10-20 лет (n=34) и более 20 лет (n=22).
УЗИ почечных артерий (ПА) выполнялось на аппарате ALOKA SSD-5500 PROSOUND с использованием конвексного и спектрального датчиков с частотой сканирования 3,5 MHz. Оценка почечной гемодинамики осуществлялась методом импульсной допплерометрии (ИДМ) в стволовых, сегментарных, междолевых и дуговых ПА в правой и левой почках. Кроме того, были определены скоростные и резистивные показатели почечного кровотока с учетом общего количества обследованных почек, что позволило нивелировать влияние физиологической асимметрии кровотока в почках. Для количественной оценки результатов определялись максимальная (Vmax), минимальная (Vmin) скорости кровотока, индекс резистивности (RI), систоло-диастолическое соотношение (S/D).
С целью наиболее точной оценки СКФ пациентом с СД1 также проводилась ДНСГ на двухдетекторной гамма-камере (ОФЭКТ) Philips Bright View с применением радиофармпрепарата 99mTc-ДТПА (Пентатех, Россия), который вводился внутривенно в дозе 74 МБк. Проводилась оценка таких показателей, как время максимального накопления РФП (Tmax), период полувыведения РФП (T½), остаток РФП на 20 мин исследования, вклад каждой почки в фильтрацию, СКФ (общая и отдельно для левой и правой почки, нормализованная к площади поверхности тела 1,73 м2).
Пациентам основной и контрольной групп определялось содержание HFABP в моче (утренняя порция) методом ИФА с использованием наборов фирмы Вектор-Бест (Россия).
Статистическая обработка данных проводилась с помощью пакета статистических программ SPSS 11.5. Соответствие нормальному закону распределения признаков проверяли с помощью критерия Шапиро-Уилка. Количественные признаки, соответствующие нормальному распределению, представлены в виде среднего значения M и стандартного отклонения SD (M±SD), несоответствующие нормальному закону распределения - в виде медианы Ме и 25-го, 75-го перцентилей (Me(O1-Q3)). Качественные признаки представлены в виде количества наблюдений и процентных долей (n, %). Для межгруппового сравнения независимых выборок применяли непараметрический U-критерий Манна-Уитни либо параметрический t-критерий Стьюдента в зависимости от вида распределения. Для сравнения количественных признаков при количестве пар сравнения более двух использовалась поправка Бонферрони для исключения ошибки, связанной с множественным сравнением. Критический уровень значимости α при проверке статистических гипотез в данном исследовании принимался равным 0,05. Для определения диагностической эффективности HFABP как маркера ранней стадии ДН выполнялся ROC-анализ с оценкой диагностической чувствительности и специфичности.
Результаты
Отличий по возрасту, полу, антропометрическим данным между больными с СД1 и лицами контрольной группы не наблюдалось. Больные СД1 с НАУ, МАУ и ПУ были сопоставимы по полу, антропометрическим данным, содержанию HbA1C в сыворотке. Пациенты подгруппы ПУ были старше и имели статистически значимо более высокие показатели САД, ДАД, чем у больных с НАУ и МАУ.
Данные об уровне мочевой экскреции сердечной формы белка, связывающего жирные кислоты (HFABP), у пациентов с СД1 и лиц контрольной группы представлены нами в предыдущей публикации [6]. Наиболее существенными представляются статистически значимо более высокие показатели мочевой экскреции HFABP у больных СД1 на стадии НАУ по сравнению с лицами контрольной группы (p<0,001). Для определения диагностической эффективности мочевой экскреции HFABP как маркера раннего повреждения почек у больных СД1 был выполнен ROC-анализ, в ходе которого дифференциально-диагностическим критерием между пациентами с СД1 с НАУ и здоровыми добровольцами явился уровень HFABP в моче 0,123нг/ммоль и более (чувствительность 93%; специфичность 87%).
При анализе лучевых параметров следует отметить, что по сравнению с пациентами с СД1 с НАУ, показатели Vmax на уровне междолевых и дуговых ПА у пациентов с МАУ были выше (p=0,009; p=0,013, соответственно). У больных с СД1 и ПУ величины Vmax и Vmin были статистически значимо меньше, а величины RI и S/D больше на уровне всего артериального русла почек, чем у лиц с МАУ.
Данные сравнительного анализа показателей почечного кровотока у больных СД1 в зависимости от длительности болезни представлены в таблице. Отмечается достоверное повышение Vmax и Vmin на уровне стволовых (p<0,001; p=0,001, соответственно), сегментарных (p=0,001; p=0,034, соответственно), междолевых (p=0,011; p=0,021, соответственно) и дуговых (p<0,001; p=0,004, соответственно) ПА у лиц с СД1 со стажем 5-10 лет по сравнению с больными, страдающими заболеванием менее 5 лет.
Показатели УЗИ почечных артерий у пациентов с СД1 в зависимости от стажа заболевания
(по данным общего количества обследованных почек)
|
Калибр сосуда |
Стаж сахарного диабета 1 типа |
|||||
|
Параметр |
0-5 лет (n=34) |
5-10 лет (n=28) |
10-20 лет (n=68) |
>20 лет (n=44) |
||
|
Ствол почечной артерии |
Vmax, см/с |
76,0 (71,0-84,0) |
91,5 (81,5-99,5)* |
79,0 (71,0-95,8) ^ |
83,0 (67,0-99,0) ^ |
|
|
Vmin, см/с |
30,0 (27,0-32,0) |
33,0 (31,3-40,8)* |
28,0 (25,0-36,5)^ |
26,0 (22,0-32,0)^ • |
||
|
RI |
0,61±0,01 |
0,62±0,01 |
0,63±0,01 |
0,66±0,02*^• |
||
|
S/D |
2,61 (2,40-2,85) |
2,54 (2,29-2,97) |
2,75 (2,37-3,08) |
3,0 (2,57-3,63)* ^• |
||
|
Сегментарная почечная артерия |
Vmax, см/с |
45,0±1,47 |
51,3±1,22* |
47,8±1,13^ |
44,5±1,96 |
|
|
Vmin, см/с |
17,7±0,66 |
20,6±1,04* |
19,1±0,58^ |
15,5±0,93^• |
||
|
RI |
0,58±0,01 |
0,60±0,02 |
0,60±0,01 |
0,65±0,02*^• |
||
|
S/D |
2,43 (2,25-2,64) |
2,46 (2,16-2,93) |
2,49 (2,26-2,80) |
2,76 (2,39-3,50)* ^• |
||
|
Междолевая почечная артерия |
Vmax, см/с |
32,0 (29,8-38,0) |
38,0 (31,0-44,3)* |
32,0 (30,0-40,0) ^ |
30,5 (27,3-33,8) ^• |
|
|
Vmin, см/с |
14,0 (11,8-15,3) |
15,0 (13,5-20,3)* |
14,0 (12,0-16,0) ^ |
10,5 (9,0-12,0)* ^• |
||
|
RI |
0,58 (0,54-0,61) |
0,59 (0,53-0,65) |
0,59 (0,56-0,63) |
0,68 (0,61-0,70)* ^• |
||
|
S/D |
2,38 (2,17-2,61) |
2,43 (2,0-3,44) |
2,46 (2,14-2,78) |
2,91 (2,55-3,52)* ^• |
||
|
Дуговая почечная артерия |
Vmax, см/с |
22,0 (20,0-25,0) |
26,5 (24,3-31,3)* |
23,5 (20,3-29,8) ^ |
24,0 (22,0-30,8) ^ |
|
|
Vmin, см/с |
10,0 (8,0-11,0) |
12,0 (10,3-13,0)* |
10,0 (9,0-11,8) ^ |
8,5 (6,5-11,0) ^• |
||
|
RI |
0,58 (0,55-0,60) |
0,57 (0,54-0,62) |
0,58 (0,52-0,62) |
0,66 (0,57-0,71)* • |
||
|
S/D |
2,38 (2,22-2,50) |
2,33 (2,18-2,63) |
2,37 (2,10-2,66) |
2,91 (2,31-3,50)* ^• |
||
|
Примечание: - данные представлены в виде M±SD либо Me(Q1-Q3); *- p<0,05 по сравнению с подгруппой со стажем СД1 до 5 лет; ^ - p<0,05 по сравнению с подгруппой со стажем СД1 5-10 лет; • - p<0,05 по сравнению с подгруппой со стажем СД1 10-20 лет. |
||||||
Кроме того, была проведена оценка параметров почечной гемодинамики у больных СД1 с длительностью болезни до 2 лет и от 2 до 5 лет, по результатам которой получены статистически значимое более высокие показатели Vmin в сегментарных ПА (p=0,018), а также более низкие значения RI и S/D в сегментарных (p=0,002; p=0,002, соответственно) и междолевых ПА (p=0,008; p=0,039, соответственно) у пациентов со стажем СД1 от 2 до 5 лет по сравнению с больными, стаж заболевания которых был менее 2 лет.
На основании данных дуплексного сканирования ПА у больных СД1 в соответствии со стажем заболевания была создана схема УЗИ артерий почек, представленная на рис. 1.
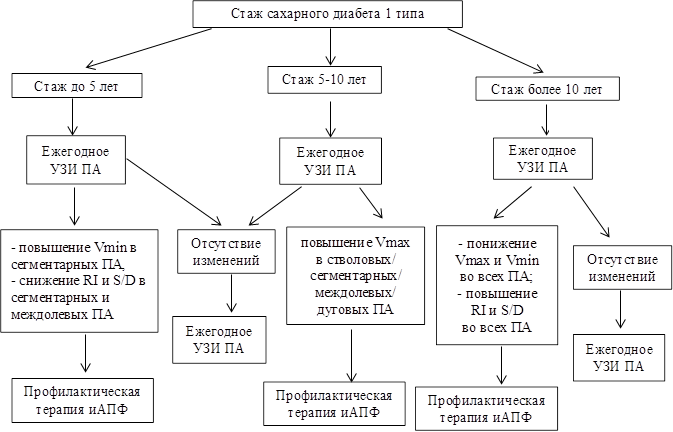
Рис. 1. Схема этапов УЗИ почечных артерий у больных с СД1 в зависимости от стажа заболевания
Кроме того, полученные в ходе настоящего исследования результаты позволили оптимизировать существующий алгоритм диагностики ДН [1]. Собственные данные, включающие исследование мочевой экскреции HFABP, проведение ультразвукового дуплексного сканирования ПА с определением Vmax, Vmin, RI и S/D и ДНСГ с оценкой СКФ, легли в основу рекомендации использования новых разработанных маркеров на ранних этапах развития ДН (рис. 2).
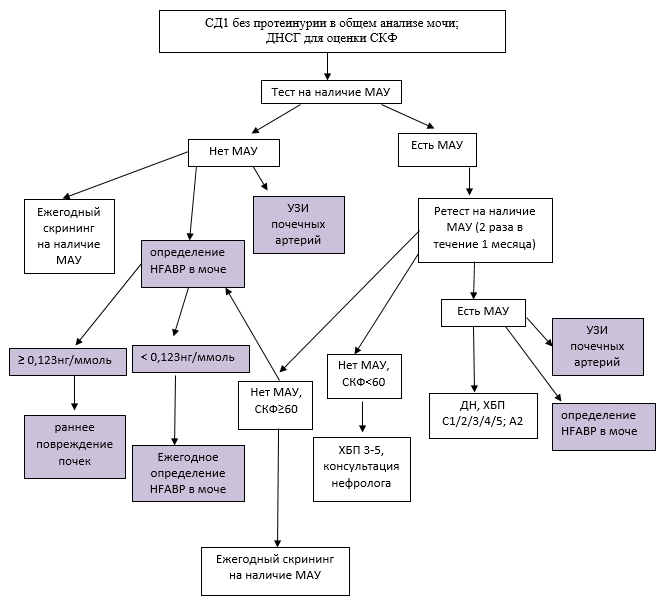
Рис. 2. Оптимизированный алгоритм диагностики ранней стадии ДН у больных СД1
(на основании существующего алгоритма диагностики [1] и собственных данных)
![]() – собственные данные
– собственные данные
Обсуждение
Анализируя данные проведенного исследования необходимо отметить, что наиболее существенным представляется статистически значимое повышение содержания HFABP в моче у пациентов с СД1, начиная со стадии НАУ (p<0,001), которое нарастало с увеличением альбуминурии. В исследовании F.L.Nauta et al. получены аналогичные данные, касающиеся мочевой экскреции HFABP у лиц с СД1. [10]. Данный результат может быть обусловлен тубулотоксическим эффектом альбумина в просвете дистального почечного канальца, хотя он и менее подвержен негативному действию альбумина [8]. При этом не исключается и тубуло-интерстициальное повреждение, которое может развиваться до структурно-функциональных нарушений клубочков почек.
В соответствии с современными представлениями нарушение внутрипочечной гемодинамики с развитием внутриклубочковой гипертензии являются патогенетической основой для формирования ДН [3]. В нашем исследовании получено повышение Vmax на уровне междолевых и дуговых ПА у пациентов с МАУ по сравнению с лицами с НАУ при отсутствии значимого повышения RI, что возможно, объясняется компенсаторной реакцией, связанной с повышением давления в афферентной артериоле с достаточным растяжением ее гладкомышечных волокон, способствующей сохранению должного внутрипочечного кровотока на начальном этапе развития ДН. Возможно, данный механизм лежит и в основе статистически значимого повышения Vmax и Vmin в стволовых, сегментарных, междолевых и дуговых ПА у лиц со стажем СД1 5-10 лет по сравнению с таковыми у больных с длительностью заболевания до 5 лет, выявленного в нашем исследовании, что делает необходимым проведение УЗИ почечных артерий на ранней стадии ДН.
Данные литературы, касающиеся изменения RI и S/D по мере прогрессирования ДН неоднозначны. Часть авторов утверждают, что у больных СД1 с ПУ имеет место снижение RI и S/D. Однако есть работы, в которых у лиц с СД по мере нарастания альбуминурии резистивные параметры почечных артерий, так же как и в нашем исследовании, увеличивались, что вероятно связано с такими патогистологическими изменениями, как гиалиноз почечных артерий, тубулярная атрофия, гломерулярный склероз, интерстициальный фиброз [13].
Заключение
С учетом выявленных лучевых и лабораторных маркеров нами предложен оптимизированный алгоритм диагностики ДН, а также схема этапов УЗИ почечных артерий в зависимости от стажа заболевания, которые позволяют обнаружить структурно-функциональные нарушения почек на ранних этапах заболевания, а также отслеживать нарастающие изменения почечной функции у больных с СД1.



