Почти 25 % больных сахарным диабетом страдает синдромом диабетической стопы. На фоне нарушения иннервации, нейроэндокринного статуса и трофики тканей создаются благоприятные условия для развития инфекционных осложнений, плохо поддающихся лечению. Вероятность выполнения высоких ампутаций при глубоких гнойно-некротических поражениях тканей достигает 30–70 %, при этом летальность колеблется от 28 до 40 %, а в последующие 5 лет выживает только 25–40 % пациентов [5]. Важную роль в генезе этого осложнения играет наличие у больных сахарным диабетом смешанного типа гипоксии, обусловленной, прежде всего, нарушением кислородно-транспортной функции крови и расстройствами микроциркуляции. Нарушение кислородно-транспортной функции крови определяется фракциями гликированного гемоглобина [3]. Кроме того, диабетическая микроангиопатия может вызвать нарушения микроциркуляции и затруднять диффузию кислорода через капиллярную мембрану в ткани [3].
Анестезиологическое обеспечение этой сложной категории больных затруднено в связи с наличием у них выраженной сопутствующей патологии. При этом «идеальный» метод обезболивания должен быть не только безопасным, но и влиять на патогенетические механизмы заболевания. В последние годы все шире используются методики нейроаксиальных анестезий, способных полностью блокировать ноцицептивную афферентацию, предотвращать нейровегетативные реакции и уменьшить число осложнений по сравнению с общей анестезией [2]. Однако многие пациенты с критической ишемией нижних конечностей получают антиагрегантную терапию, что является противопоказанием для выполнения нейроаксиальных блокад [12]. Кроме того, наличие очага инфекции или септициемии при выполнении нейроаксиальной блокады может приводить к развитию эпидурального абсцесса или менингита [11].
Проводниковая анестезия, благодаря своей эффективности и безопасности, приобрела широкое распространение при операциях на конечностях. Безусловно, этот вид обезболивания предпочтителен для периоперационного обезболивания при неоднократных вмешательствах у больных с синдромом диабетической стопы [7,8]. Кроме того, считается, что проводниковая анестезия вследствие десимпатизации способна улучшить кровоток в блокированной конечности, улучшить трофику тканей и течение послеоперационного периода [7,1]. Однако нет объективных данных, насколько действительно проводниковая блокада способна улучшить кровоток и напряжение кислорода в тканях блокированной конечности у больных с синдромом диабетической стопы.
Цель исследования. Изучить влияние проводниковой анестезии на микроциркуляцию и напряжение кислорода в пораженной конечности у пациентов с синдромом «диабетическая стопа».
Материалы и методы. Проведенное открытое проспективное нерандомизированное исследование было одобрено локальным этическим комитетом ФГБУ «ПФМИЦ» Минздрава России. В исследование после получения письменного информированного согласия было включено 9 пациентов, среди них 2 женщины и 7 мужчин.
У всех больных синдром диабетической стопы развился на фоне инсулинопотребного диабета II типа с поражением одной конечности и выраженным болевым синдромом в покое. Средний возраст пациентов составил 57 (от 47 до 74) лет. Критериями исключения были: возраст старше 80 лет, наличие врожденных и приобретенных коагулопатий, наличие в анамнезе аллергических реакций на амидные анестетики, выявление алкоголизма или наркомании, отсутствие готовности к сотрудничеству со стороны пациента.
Всем больным выполняли блокаду седалищного нерва в положении лежа на боку по В.Ф. Войно-Ясенецкому. Поиск нерва осуществляли при помощи электростимулятора Stimuplex HNS 12 (B. Braun) при силе тока 1–1,5 мА. При появлении моторного ответа силу тока снижали до 0,6–0,8 мА и при сохранении индуцированного мышечного ответа после проведения аспирационной пробы и положительного электротеста (исчезновение сокращений после введения первых двух миллилитров анестетика) вводили раствор 0,375 % наропина (Astra Zeneca) в объеме 20 мл.
Для оценки транскутанного напряжения кислорода использовали транскутанный газовый анализатор TCM 4 series (Radiometer, Дания), для оценки микроциркуляции – аппарат ЛАКК-М (Лазма, Россия). В мониторе TCM 4 применяется электрохимический принцип измерения, позволяющий определить степень насыщения тканей кислородом. Комбинированный электрод совмещает в одном корпусе электрод Кларка для измерения TcpO2 (transcutaneus partial O2, транскутанное напряжение кислорода) и электрод Северингауза для измерения TcpCO2 (transcutaneus partial CO2, транскутанное напряжение углекислого газа). Электрод прикрепляли к обезжиренной коже тыла стопы с помощью специального клейкого кольца. Измерение производится в тонком слое электролита, наносимого внутрь кольца. Электрод нагревается до заданной температуры (обычно 43–44 градуса), что усиливает локальный кровоток, обеспечивает артериализацию капиллярной крови и увеличивает проницаемость кожи для газов. Полученные значения демонстрируют напряжение кислорода и углекислого газа в коже исследуемого участка. В норме на коже тыльной поверхности стопы TcpO2 составляет более 40 мм рт. ст.
Исследование проводили методом лазерной доплеровской флоуметрии (ЛДФ) с использованием прибора ЛАКК-М. Полученный при ЛДФ сигнал характеризует кровоток в микрососудах в объеме около 1 мм3 ткани. Регистрируемый при ЛДФ показатель микроциркуляции (М) представляет собой уровень перфузии объема ткани за единицу времени и измеряется в относительных единицах (перфузионных единицах – пф. ед.). Для анализа используется среднее арифметическое значение показателя микроциркуляции. Этот параметр характеризует средний поток эритроцитов в единице объема ткани в зондируемом участке в интервале времени регистрации. Для кожи тыльной поверхности стопы в норме показатель микроциркуляции составляет более 7 перф. ед.
Фиксирующие элементы приборов находились в области иннервации седалищного нерва на тыльной поверхности не поврежденной кожи стопы в области III–IV плюсневых костей. Оценка изменения показателей транскутанного напряжения кислорода и микроциркуляции проводилась после наступления сенсорного и моторного блока (через 30–40 минут после блокады) и через 24 часа после выполнения блокады.
Результаты
Как следует из данных, представленных в таблице, исходный уровень TcpO2 у пациентов составил 37 (11; 60) мм рт. ст. при исходном показателе микроциркуляции 6,8 (3,9; 15,2) перфузионных единиц. На этом этапе из 9-ти больных у 6-ти наблюдался компенсированный тканевой метаболизм (уровень TcpO2 более 30 мм рт. ст.), у 2-х – субкомпенcированный (TcpO2 = 20-30 мм рт. ст.) и у 1-го больного – декомпенсированный (TcpO2 < 20 мм рт. ст.). У всех больных показатель микроциркуляции был менее 7 перфузионных единиц, кроме одного, имевшего завышенный показатель микроциркуляции в результате исходной гиперемии исследуемого участка.
Динамика показателей TcpO2 и показателя микроциркуляции (М)
|
Показатели |
Этапы исследования |
||
|
Исходный уровень (n=9) |
После развития сенсорного и моторного блока (n=9) |
Через 24 часа после блокады (n=9) |
|
|
TcpO2 (мм рт. ст.) |
37 (11; 60) |
28 (13; 48) |
46 (28; 68)* |
|
М (перф. ед) |
6,8 (3,9; 15,2) |
6,4 (4.2; 12,3) |
10,8 (6,8; 18,7)** |
Примечание : * – р <0,05 по сравнению с исходными значениями; ** – p<0,05 по сравнению с этапом после развития блокады.
Через 30–40 мин после выполнения блокады у всех пациентов болевой синдром был полностью купирован, но уровень транскутанного напряжения кислорода в коже стопы снизился (р≥0,05) на 24 %, до 28 (13; 48) мм рт. ст. (рис. 1), а показатель микроциркуляции не увеличился по сравнению с исходным и составил 6,4 (4.2; 12,3) перфузионных единиц (рис. 2). При этом число пациентов с компенсированным типом кровотока (уровень TcpO2 более 30 мм рт. ст.) уменьшилось с 6-ти до 4-х.
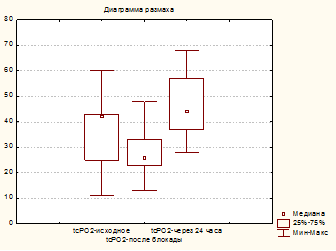
Рис.1. Динамика TcpO2 мм рт. ст. на этапах исследования
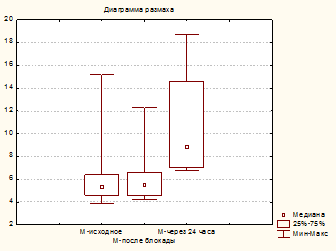
Рис. 2. Динамика показателя среднего значения микроциркуляции, перф ед.
Через 24 часа после выполнения блокады уровень TcpO2 вырос на 24 % по сравнению с исходными значениями (с 37 (11; 60) до 46 (28; 68) мм рт.ст.) и на 64 % – по сравнению с его значениями после выполнения блокады (с 28 (13; 48) до 46 (28; 68) мм рт. ст.). Показатель микроциркуляции также увеличился на 59 % от исходных значений (с 6,8 (3,9; 15,2) до 10,8 (6,8; 18,7) перфузионных единиц). При этом только у одного больного с исходно компенсированным типом кровотока наблюдали снижение тканевого метаболизма до уровня субкомпенсации. У остальных больных значения TcpO2 были выше 30 мм рт. ст., в том числе и у 3-х пациентов с исходной суб- и декомпесацией кровотока.
Особо следует отметить, что у этих 3-х больных с исходным декомпенсированным или субкомпенсированным уровнем тканевой гипоксии был отмечен максимальный рост TcpO2, в 2–4 раза, по сравнению с исходным. Напротив, у больных с исходно компенсированной степенью тканевой гипоксии повышение TcpO2 было менее выраженным.
Обсуждение
По мнению ряда авторов, проводниковая анестезия нервов нижней конечности приводит к улучшению кровоснабжения и микроциркуляции дистального русла у больных сахарным диабетом и стабилизирует течение раневого процесса и сокращает сроки заживления [7; 1]. Как установили В.Н. Кохно и соавторы, использование проводниковой анестезии значимо уменьшает число повторных оперативных вмешательств у больных с синдромом «диабетическая стопа» [1].
Однако публикаций, показывающих, насколько действительно проводниковая блокада способна улучшить кровоток и напряжение кислорода в тканях блокированной конечности у больных с синдромом диабетической стопы, в доступной литературе мы не встретили. Хотя в настоящее время динамическая оценка транскутанного напряжения кислорода у больных с синдромом диабетической стопы является наиболее информативным методом оценки достаточности тканевого метаболизма и выбора тактики лечения [6].
Только в одном исследовании на здоровых добровольцах при выполнении им блокады плечевого сплетения было установлено значимое повышение уровня TcpO2 [14]. Показано также положительное влияние блокады плечевого сплетения у больных с отморожениями верхних конечностей: отмечалось уменьшение сосудистого спазма и шунтирования кровотока [13]. Однако микроциркуляция в верхних конечностях более интенсивная, чем в нижних, что не позволяет предположить схожую динамику изменений TcpO2 при выполнении проводниковой анестезии на нижних конечностях, особенно у пациентов с синдромом диабетической стопы и нарушениями микроциркуляции.
Установлено, что у пациентов с нейропатической формой синдрома диабетической стопы вследствие развития полинейропатии возникает прекапиллярная вазоконстрикция, что приводит к увеличению прекапиллярного давления и усилению артериовенозного шунтирования [9]. При ишемической форме происходит уменьшение объема артериального притока и нарушение симпатической регуляции, а при смешенной – снижение эндотелиальной секреции и нарушение процесса регуляции активации нейрогенного и миогенного механизмов контроля кровотока [9]. Кроме того, ухудшение транспорта кислорода эритроцитами определяется фракциями гликированного гемоглобина, а диабетическая микроангиопатия затрудняет диффузию кислорода через капиллярную мембрану в ткани [3]. Также у больных сахарным диабетом развиваются нарушения эндотелиальной функции и сосудистой регуляции, выражающиеся в снижении синтеза оксида азота вследствие негативного влияния гипергликемии, свободных жирных кислот и резистентности к инсулину. Все это увеличивает продукцию активных форм кислорода, нарушающих функции эндотелия [3].
Результаты данного исследования показали, что, возможно, в связи с наличием у пациентов с синдромом диабетической стопы сложных механизмов нарушения транспорта кислорода к тканям, трофические эффекты проводниковой анестезии проявляются не сразу, а через некоторое время. Подобного мнения придерживаются и Devulder J. и соавт. (2011) [10], считающие, что симпатическая блокада с целью улучшения кровотока у пациентов с сосудистыми заболеваниями должна проводиться только после интенсивного консервативного лечения, направленного на улучшение метаболизма.
Выводы
1. У пациентов с синдромом диабетической стопы и гнойно-некротическими осложнениями сахарного диабета проводниковая анестезия седалищного нерва длительно действующим амидным анестетиком приводит к значимому увеличению показателя среднего значения микроциркуляции и напряжения кислорода в тканях через сутки после выполнения блокады.
2. Необходимы дальнейшие исследования трофических эффектов проводниковой анестезии у больных с синдромом диабетической стопы для определения продолжительности лечебного эффекта блокады и его влияния на течение репаративных процессов у этой сложной категории больных.



