В последние годы во всем мире особое внимание уделяется ухудшению экологической обстановки. Причем темпы развития антропогенных изменений окружающей среды значительно опережают адаптационные возможности организма человека [3; 4]. Повышенный уровень содержания различных токсичных веществ, в том числе тяжелых металлов [6; 10], в выбросах и стоках промышленных предприятий приводит к их накоплению в окружающей среде и поступлению в организм человека [3; 8]. Несмотря на пристальное внимание к проблеме неблагоприятного воздействия экологических факторов, их влияние на развитие аутоиммунных заболеваний кожи (АИЗК) практически не исследовано; отсутствует оценка риска для здоровья населения с учетом территории его проживания.
В этой связи целью исследования явилось определение риска развития и распространенности АИЗК в зависимости от уровня антропогенного загрязнения территорий проживания.
Материалы и методы исследования
Эколого-эпидемиологическое исследование проведено на трех территориях промышленных городов Оренбургской области (1-я территория – г. Медногорск, 2-я территория – г. Оренбург, 3-я территория – г. Бугуруслан), отличающихся уровнем антропогенного загрязнения. При гигиенической оценке окружающей среды, формирующейся в реальных условиях проживания, исследовано содержание химических веществ, загрязняющих воздушную среду, почву, питьевую воду по данным региональной системы социально-гигиенического мониторинга, данных управления по гидрометеорологии и мониторингу окружающей среды. Анализ загрязнения атмосферного воздуха проводился в соответствии с ГОСТ 17.2.3-01-86 и РД 52.04.186-89 с определением суммарного показателя загрязнения атмосферного воздуха – К воздух. Анализ почвы на исследуемых территориях осуществлялся в соответствии с СанПин 2.1.7.1278-03 «Санитарно-эпидемиологические требования к качеству почвы»; для металлов и микроэлементов, имеющих ПДК, рассчитывались средние уровни содержания в долях ПДК, оценка степени химического загрязнения почвы дана по суммарному показателю (К почвы), который определен как сумма коэффициентов концентраций отдельных компонентов загрязнения.
Для оценки качества питьевой воды была проведена выкопировка данных результатов исследования проб из водопроводной сети в соответствии с ГОСТ 24481-80. Качество питьевой воды оценивалось по 24 показателям на соответствие СанПин 2.1.4.1074-01. На основании полученных данных рассчитаны суммарные уровни антропогенной нагрузки на исследуемые территории.
Оценка риска здоровью населения, подвергающемуся различному уровню антропогенного воздействия, произведена в соответствии с руководством Р 2.1.10.1920-04 «Руководство по оценке риска для здоровья населения при воздействии веществ, загрязняющих окружающую среду». Распространенность аутоиммунных заболеваний на исследуемых территориях проведена путем выкопировки данных из счетов-реестров медицинских учреждений Оренбургской области, направленных на оплату в Территориальный фонд обязательного медицинского страхования с исключением повторяющихся персональных данных. Показатели заболеваемости представлены в виде среднего за пятилетний период (2011–2015 гг.) числа случаев на 10000 населения и 95%-ного доверительного интервала (95% ДИ).
В рамках реализации риска развития аутоиммунных заболеваний кожи и доказательства роли загрязнителей, в том числе тяжелых металлов, проведен модельный эксперимент. Исследование по оценке влияния тяжелых металлов на пролиферативную и апоптотическую активность кератиноцитов выполнено на 25 самцах мышей линии C57BL/6 в возрасте 6–7 недель, с исходной массой 15–17 г. Мыши были распределены на 4 опытные и контрольную группу по 5 особей в каждой. Экспериментальные животные I опытной группы в качестве питьевой воды получали водный раствор сульфата цинка 0,1238 г/л (50 мг/л в пересчёте на цинк); II опытной группы – водный раствор сульфата никеля 0,0026 г/л (1 мг/л в пересчёте на никель); III опытной группы – водный раствор бихромата натрия двухосновного 0,001433 г/л (0,5 мг/л в пересчёте на хром); IV опытной группы – водный раствор ацетата свинца (трёхводный) 0,00054 г/л (3 мг/л в пересчёте на свинец). Животные контрольной группы получали чистую питьевую воду. Исследование выполнено на фоне индукции анагена путем депиляции волос с кожи спины животных [12] восковыми мини-полосками WaxStrips «Beauty formulas» (Drammock International LTD., Великобритания) под эфирным наркозом, произведенной на 17-й день эксперимента. На 9-е сутки после депиляции, соответствующие позднему анагену [11], все животные были выведены из эксперимента путем декапитации под эфирным наркозом. Морфологическому исследованию подлежали образцы кожи, ранее подвергнутой депиляции размером 10,0 х 15,0 мм. После забора их помещали в 10%-ный нейтральный формалин и фиксировали при комнатной температуре в течение суток, затем после стандартной гистологической проводки заливали в парафин. Эксперимент проводился с разрешения Локального этического комитета ГБОУ ВПО «ОрГМУ» МЗ РФ (протокол № 131 от 15.12.2015 г.), с соблюдением «Правил проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1977 г.) и «Правил лабораторной практики в Российской Федерации» (Приказ МЗ РФ от 19.06.2003 г. № 267).
Пролиферативную и апоптотическую активность кератиноцитов определяли иммуногистохимическим методом на гистологических срезах кожи толщиной 5 мкм и оценивали путем расчета индекса пролиферации (ИП) и индекса апоптоза (ИА). Выявление пролиферирующих эпителиальных клеток, основанное на экспрессии их ядрами белка Ki-67 [1], проводилось с использованием кроличьих моноклональных антител к Ki-67 (clone SP6) (Cell marque, США) с визуализацией Ki-67-позитивных клеток согласно протоколу фирмы-производителя (Cell marque, США). Апоптотические клетки выявлялись путем идентификации каспазы-3, с использованием первичных антител Human CPP 32 (caspase-3) Clone JHM62 согласно протоколу фирмы-производителя (Spring BioScience, США). Подсчет клеток проводился не менее чем в 15 полях зрения при увеличении × 600. Ki-67-позитивные клетки распознавались по наличию ядра коричневого цвета, каспаза-3-позитивные – по темно-коричневой зернистости в ядре и цитоплазме. Оценивались клетки покровного эпителия и эпителиальные клетки волосяных фолликулов – наружной и внутренней оболочек влагалища фолликула волоса, без учета зоны матрикса, где из-за скопления гранул меланина меченые ядра клеток трудно различимы. Для каждого поля зрения рассчитывали индекс пролиферации и индекс апоптоза, которые представляли собой долю позитивно окрашенных клеток к общему количеству клеток, выраженному в процентах [5]. Данные для каждой группы представлены в виде средней арифметической и стандартной ошибки средней (М±m), и 95%-ного доверительного интервала (95% ДИ). Сравнение данных каждой из опытных групп и контрольной проводилось с помощью критерия Манна-Уитни (1947). В том случае, если доверительные интервалы для средних значений сравниваемых показателей имели трансгрессию, различия между ними считались статистически незначимыми [9].
Результаты исследования и их обсуждение
В результате проведенных исследований установлено, что загрязнение атмосферного воздуха 1-й территории характеризуется превышением ПДК диоксида азота в 1,62 раза, диоксида серы в 1,53 раза, никеля в 2,1 раза, кадмия в 1,5 раза. На 2-й территории отмечалось превышение ПДК в атмосферном воздухе формальдегида в 2,0 раза, 3,4-бенз(а)пирена в 2,1 раза, диоксида азота в 1,16 раза, свинца в 2,0 раза. В атмосферном воздухе 3-й территории ни один из выявленных загрязнителей не превышал ПДК по среднесуточным концентрациям. При анализе структуры загрязнения атмосферного воздуха металлами наибольший вклад вносили на 1-й территории никель (32%), кадмий (23%), хром (15%), марганец (12%); на 2-й территории соответственно свинец (38%), никель (26%), марганец (10%), хром (9%); на 3-й территории металлами-загрязнителями были свинец (58%), кадмий (17%), хром (15%).
В питьевой воде, которой пользуется население, проживающее на трех исследуемых территориях, идентифицированы такие поллютанты, как хлориды, свинец, кадмий, никель, железо, фториды, хром, нитраты, алюминий, содержание которых было в пределах допустимого уровня. В связи с тем что почва является аккумулирующей средой, то по уровню ее загрязнения можно дополнительно судить о состоянии атмосферного воздуха и воды, как контактирующей и аккумулирующей среды. Выявлено, что на 1-й территории приоритетными загрязнителями почвы являются свинец (Кс.=8,2), медь (Кс.=5,6), цинк (Кс.=3,22); на 2-й территории – хром (Кс.=1,58), никель (Кс.=1,55), марганец (Кс.=1,36), свинец (Кс.=1,2); на 3-й территории концентрации поллютантов не превышали ПДК или Кларка.
Оценка величины антропогенной нагрузки на организм населения, определенная концентрацией загрязнения атмосферного воздуха, почвы и воды в исследуемых территориях, представленная на рисунке 1, свидетельствует о том, что суммарное воздействие комплекса загрязнителей на население 1-й территории в 4,2 раза выше, чем на 3-й территории и в 1,2 раза выше, чем на 2-й территории.
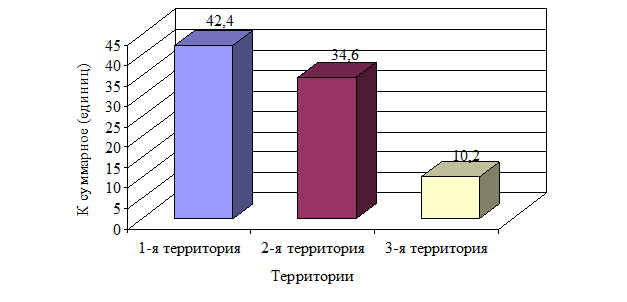
Рис. 1. Суммарная антропогенная нагрузка на организм населения, проживающего на трех исследуемых территориях
С целью оценки последствий влияния многокомпонентных загрязнителей на здоровье населения проведен расчет неканцерогенного риска. Установлено, что с учетом рассчитанных коэффициентов опасности (HQ) наибольший вклад в риск развития неонкологических заболеваний на 1-й территории проживания вносят медь (HQ=6,5), цинк (HQ=3,2), диоксид азота (HQ=1,53), диоксид серы (HQ=1,29). На 2-й территории соответственно сероводород (HQ=2,6), марганец (HQ=1,83), цинк (HQ=0,93); на 3-й территории – свинец (HQ=0,83), хром (HQ=0,54), марганец (HQ=0,22).
Анализ данных, представленных в таблице, свидетельствует о том, что самые высокие суммарные риски от загрязнителей были на 1-й территории, где суммарный индекс опасности для критических органов и систем составил 19,68; на 2-й территории – 13,56 и на 3-й территории соответственно был равен 4,64. Важно отметить, что при исключении такого органа-мишени, как органы дыхания, имеют место высокие индексы опасности поражения иммунной системы, которые на всех трех территориях проживания были примерно одинаковыми и составляли от 1,76 до 1,96.
Суммарные индексы опасности для критических органов и систем организма населения, проживающего на исследуемых территориях
|
Критические органы и системы |
Суммарные индексы опасности (HI) |
||
|
1-я территория |
2-я территория |
3-я территория |
|
|
Органы дыхания |
13,96 |
8,72 |
1,24 |
|
Кровь |
1,47 |
0,72 |
0,61 |
|
ЦНС |
0,43 |
1,22 |
0,12 |
|
Иммунная система |
1,96 |
1,80 |
1,76 |
|
Системные поражения |
1,86 |
1,10 |
0,91 |
|
Суммарный индекс |
19,68 |
13,56 |
4,64 |
Подтверждением роли химических загрязнителей в риске развития аутоиммунных заболеваний кожи является распространенность последних среди населения, проживающего на трех исследуемых территориях. Установлено, что средние показатели числа аутоиммунных заболеваний кожи у населения за последние пять лет составили на 1-й территории проживания 6,69 случая на 10000 населения (95% ДИ 3,66–9,71 случая на 10000 населения), на 2-й территории – 6,97 случая на 10000 населения (95% ДИ 6,28–7,65 случая на 10000 населения) и на 3-й территории – 6,96 случая на 10000 населения (95% ДИ 4,65–9,26 случая на 10000 населения). Анализ полученных данных позволяет предположить, что, вероятно, помимо общего уровня антропогенной нагрузки на организм, имеют значение качественные показатели загрязнения, их доза и степень кумуляции в организме.
Апробация гипотезы в проведенных экспериментальных исследованиях позволила показать, что поступление в организм животных I опытной группы раствора сульфата цинка стимулировало пролиферативную активность кератиноцитов (рис. 2).
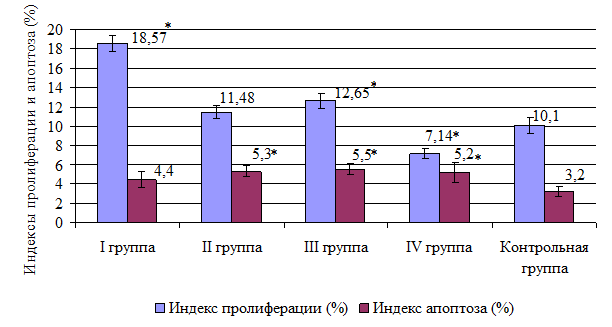
Рис. 2. Индексы пролиферации и апоптоза эпителиальных клеток кожи мышей подопытных групп (планки погрешностей обозначают 95%-ный доверительный интервал; * – p<0,01)
Индекс пролиферации (ИП) кератиноцитов мышей I опытной группы составил 18,57±0,34% (95% ДИ 17,68–19,4%), превысив на 85,7% ИП кератиноцитов мышей контрольной группы, равный 10,1±0,33% (95% ДИ 9,39–10,95%). При этом введение сульфата цинка не привело к изменению апоптотической доминанты эпителиальных клеток кожи. Противоположные эффекты были получены при введении мышам раствора сульфата никеля. Введение этого вещества животным II опытной группы привело к увеличению ИА кератиноцитов на 65,6%, составив 5,3±0,21% (95% ДИ 4,79–5,87%) против 3,2±0,22% (95% ДИ 2,67–3,73%) у животных контрольной группы, не оказав влияния на пролиферативный ответ кератиноцитов. Поступление в организм мышей III опытной группы раствора бихромата калия активировало как апоптоз кератиноцитов, так и их пролиферацию. Так, ИА кератиноцитов у мышей III опытной группы превысил аналогичный показатель у животных контрольной группы на 71,9% и составил соответственно 5,5±0,22% (95% ДИ 4,92–6,07%) и 3,2±0,22% (95% ДИ 2,67–3,73%). Индекс пролиферации кератиноцитов у мышей III опытной группы был равен 12,65±0,29% (95% ДИ 11,89–13,4%), что на 26,5% превышало ИП кератиноцитов у животных контрольной группы (10,1±0,33% (95% ДИ 9,39–10,95%)). Поступление в организм животных IV опытной группы раствора ацетата свинца активировало апоптоз кератиноцитов. Индекс апоптоза у животных этой группы по сравнению с аналогичным показателем у мышей контрольной группы был выше на 62,5% и составил 5,2±0,37% (95% ДИ 4,16–6,23%). В то же время воздействие ацетата свинца оказало угнетающее влияние на пролиферативную активность кератиноцитов. Индекс пролиферации кератиноцитов мышей VI опытной группы составил 7,14±0,21% (95% ДИ 6,55–7,72%), что было ниже на 28,6% ИП кератиноцитов мышей контрольной группы, равного 10,1±0,33% (95% ДИ 9,39–10,95%).
Анализ полученных данных свидетельствует о том, что активация апоптоза, индуцируемого бихроматом натрия, сопровождается увеличением пролиферативной активности кератиноцитов, которое, вероятно, носит компенсаторный характер. Это согласуется с результатами отдельных авторов, полученных на примере других тканей [7]. Однако активация апоптоза в случае поступления в организм животных сульфата никеля не сопровождается усилением пролиферации, а при введении ацетата свинца пролиферативный ответ кератиноцитов подавляется. Активация апоптоза рассматривается рядом исследователей в качестве фактора, способствующего возникновению аутоиммунных реакций [13; 15], что связывают с экстернализацией внутриклеточных аутоантигенов и неспособностью фагоцитов к полноценному удалению апоптотического материала в случае массивного апоптоза [14].
Таким образом, полученные данные свидетельствуют о том, что загрязнение окружающей среды территорий проживания влияет на развитие аутоиммунных заболеваний кожи, при этом такие приоритетные загрязнители, как хром, никель, свинец, приводят к изменению пролиферативного и апоптотического ответа кератиноцитов, подтвержденному экспериментальными данными.



