Костная ткань занимает одно из первых мест по метастазированию рака молочной железы, легкого, желудка, предстательной железы и др. Только в 2010 г. было зарегистрировано 1757 новых случаев сарком костей. Кроме того, в современных условиях модернизации здравоохранения и увеличения объемов амбулаторной помощи ожидается рост заболеваемости, впервые выявленной [1,2,4]. Многие опухоли костной ткани, несмотря на доброкачественный характер, могут приводить к развитию летальных осложнений. Например, при остеомах лобной или решетчатой пазух в большинстве случаев развивается пневмоцефалия [5]. Опухоли костей, особенно злокачественные, слабо чувствительны к лучевой и химиотерапии, поэтому основным методом их лечения является хирургический. Учитывая частую локализацию патологического процесса в костях конечностей, долгое время самой распространенной операцией была ампутация или экзартикуляция. Сейчас в большинстве случаев предпочтение отдается органосохраняющим операциям [2,6]. Для замещения образующихся дефектов костной ткани после резекции опухоли наиболее часто используются аутотрансплантаты. Однако они имеют ряд недостатков: ограничение объема трансплантата, невозможность замещения всего сегмента конечности, повреждение донорского участка. Альтернативой является использование естественных алло- и ксенотрансплантатов, однако количество несращений достигает 33 % [1, 2, 11], высока вероятность гистонесовместимости тканей и передачи вирусных инфекций, необходимо наличие и постоянное пополнение костного банка [9,10]. Также используются титановые, углеродные, керамические имплантаты. Однако при их применении отмечается высокая частота асептической нестабильности и некроза в месте контакта «кость-имплант» [7,10]. Кроме того, имеющиеся технологии и трансплантаты отличаются высокой стоимостью, не позволяют спроектировать и математически адаптировать имплантат к воспринимающему ложу, не соответствуют прецизионно объемным и физическим характеристикам планируемого для замещения дефекта, имеют высокую частоту развития нестабильности, не позволяют заместить целые сегменты имплантатом из костнозамещающего вещества, что чаще всего необходимо при лечении пациентов с онкологическими заболеваниями. Одна из возможностей избежать осложнения и достичь отличных результатов лечения – разработка технологий прецизионной 3D печати персонифицированных имплантатов. Однако исследований в данной области практически нет [3,14,15].
Цель исследования − оценка клинико-рентгенологических результатов оперативного лечения пациентов с онкологическими заболеваниями с использованием персонифицированных прецизионных костнозамещающих имплантатов, создаваемых с помощью аддитивных технологий 3D печати.
Материалы и методы. Работа основана на проведении клинического и рентгенологического обследований 26 пациентов с остеоонкологией, которым в ФГБУ «ПФМИЦ» Минздрава России в период с 2015 по 2016 год было выполнено 26 операций, связанных с удалением опухоли и замещением образовавшегося костного дефекта персонифицированным прецизионным имплантатом. Из них было 12 мужчин, средний возраст которых составил 49 ±3,5 лет (95 % ДИ 39-55), и 14 женщин, средний возраст которых 52±2,8 года (95 % ДИ 42-61). Локализация остеоонкологии у 6 пациентов – бедренная кость, 15 – большеберцовая кость, 5 – пяточная кость. Для оценки отдаленных результатов лечения выполнялось анкетирование пациентов с использованием опросников SF 36 [13], шкалы Эннекинга [8] и визуальной аналоговой шкалы (ВАШ) [12]. Обследование проводилось в сроки 3, 6 и 12 месяцев после оперативного лечения. Все пациенты до операции пользовались дополнительными средствами опоры, и у них имелся выраженный болевой синдром. Доброкачественные опухолевые поражения были диагностированы у 18 человек, злокачественные − у 8 (табл.1).
Таблица 1
Диагностированные заболевания и используемые имплантаты при лечении
|
Классификация
|
Диагноз |
Количество пациентов |
|
|
Используемые имплантаты |
|||
|
Костный цемент |
«Рекост» |
||
|
Доброкачественные образования |
Энхондрома |
4 |
3 |
|
Онкобластокластома |
2 |
2 |
|
|
Ксантома |
1 |
1 |
|
|
Неостеогенная фиброма |
1 |
- |
|
|
Костные кисты |
3 |
1 |
|
|
Злокачественные образования |
Хондросаркома |
1 |
1 |
|
Остеогенная саркома |
1 |
1 |
|
|
Метастатические поражения рака молочных желез, легких, почек и матки |
2 |
2 |
|
|
Итого |
15 |
11 |
|
После верификации диагноза выполнялось удаление патологического образования с последующей пластикой костного дефекта персонифицированным прецизионным имплантатом. Для этого на первом этапе после установки клинико-рентгенологического и при необходимости морфологического диагноза производили компьютерную томографию биологического объекта при сканировании с минимальным шагом (чаще всего не более 2 мм) координатного стола в режиме высокого разрешения (в зависимости от исследуемого органа) при неподвижном положении пациента на протяжении получения полного набора томограмм. Из массива томографических данных отбирали при помощи установки уровня отсечки, задавая коэффициент градиента интенсивности эмпирически от 0 до 225, информацию для восстановления образа костных структур определенной плотности. Затем на созданной компьютерной трехмерной модели кости выполняли резекцию опухоли с захватом 0,2–0,4 см неповрежденной костной ткани. После этого производили гибридное параметрическое моделирование компьютерной модели имплантата, включающее реконструкцию недостающих фрагментов костной ткани. Далее на основе полученных объемных параметров имплантата создавали компьютерную модель его матрицы и формировали в ней два отверстия: одно − для доставки жидкого костнозамещающего вещества, другое – для эвакуации воздуха. При необходимости добавляли поддержку и отправляли дистанционно или через жесткий носитель на FDM 3D принтер для ее производства. На втором этапе изготовленную матрицу заполняли жидким костнозамещающим веществом. После его отвердения матрицу разбирали, а оставшийся имплантат стерилизовали и помещали в упаковку.
При значительных объёмах дефекта (более 5 см2) дополнительно с костнозамещающим материалом применялась костная «аллостружка». При необходимости выполнялся «шунтирующий» профилактический остеосинтез. Радикальность резекции опухоли подтверждалась интраоперационным экспресс-исследованием материала с торцов опила.
Исследование проведено в соответствии с Хельсинкской декларацией (принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия)) и одобрено локальным этическим комитетом ФГБУ «ПФМИЦ» Минздрава России. Все пациенты дали письменное информированное согласие.
Результаты и обсуждение. У всех пациентов уже через 3 месяца после операции наблюдалась положительная динамика в виде купирования болевого синдрома и улучшения статико-локомоторной функции. По данным обследования пациентов с использованием опросника SF 36 отмечалось значительное улучшение всех показателей, особенно самооценки общего состояния здоровья, физической функциональности, влияния эмоционального состояния на ролевое функционирование.
У всех пациентов с доброкачественными образованиями была восстановлена опороспособность. По шкале SF-36 общие показатели составили для «Физического компонента здоровья» 33,5 (31±10,5) баллов, для «Психологического компонента здоровья» 50 (46±8,5) баллов. Все пациенты вернулись к обычной жизни и труду. Улучшения показателей в послеоперационном периоде наблюдались по классификации Эннекинга и ВАШ (таблица 2).
Таблица 2
Результаты анкетирования пациентов до и после оперативного вмешательства
|
Анкета |
Доброкачественные образования |
Злокачественные образования |
||
|
До операции, баллы |
Через 12 месяцев после операции, баллы |
До операции, баллы |
Через 12 месяцев после операции, баллы |
|
|
SF 36 |
33,5 (31±10,5) |
70 (76±8,5) |
10,5 (10±3,5) |
40 (36±6) |
|
Шкала Эннекинга |
9 (8±3) |
24 (25±4) |
5 (4±3) |
16 (15±4) |
|
ВАШ |
7 (6 ±2) |
2 (1±2) |
8 (7±2) |
5 (4±2) |
Пациенты, которым выполнялись сегментарные резекции по поводу злокачественных поражений, смогли вернуться к обычной жизни и труду в 38 % случаев (3 человека). Опороспособность нижних конечностей была восстановлена у 4 пациентов (50 %). Остальные передвигались с применением дополнительных средств опоры (двое пациентов использовали трость, один – костыли, один – ходунки).
Осложнение было только у одного пациента в виде инфекционно-воспалительного процесса после оперативного лечения энходромы пяточной кости с замещением дефекта прецизионным персонифицированным имплантатом из костного цемента. После медикаментозной терапии процесс был купирован. При осмотре пациента через 1 год послеоперационных осложнений не выявлено, пациент передвигается без дополнительных средств опоры, жалоб не предъявляет.
Клинический пример. Больная З., 55 лет. Диагноз: метастаз рака тела матки. Жалобы при поступлении: боль и опухолевидное образование нижней трети правой голени. Оценка по шкале ВАШ – 8 баллов. Оценка по шкале SF 36 − 39 баллов, по шкале Эннекинга – 10 баллов. На рентгенографии было выявлено патологическое образование на уровне средней трети большеберцовой кости правой голени, размерами 1х2х1 см (рис. 1).
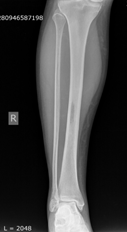
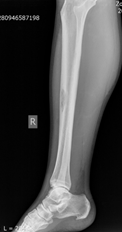
Рис.1. Рентгенография правой голени до операции
Выполнена сегментарная резекция патологического очага с последующим замещением костного дефекта персонифицированным прецизионным имплантатом из костнозамещающего материала «Рекост» (Рис. 2).
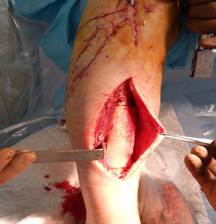
Рис. 2. Этап замещения дефекта индивидуальным костнозамещающим имплантатом
При обследовании пациентки через 1 год: ВАШ – 3 балла, SF 36 − 70 баллов, шкала Эннекинга – 25 баллов. По данным компьютерно-томографического и рентгенологического обследований миграции имплантата не наступило, отмечается наличие краевой остеоинтеграции. Пациентка передвигается без дополнительных средств опоры (Рис. 3, 4).
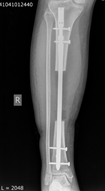
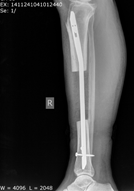
Рис. 3. Рентгенография правой голени через 1 год после операции

Рис.4. Функциональный результат через 1 год после операции
При рентгенологическом обследовании у всех пациентов не было выявлено признаков нестабильности имплантата, что, по нашему мнению, обусловлено наличием прецизионного соответствия его размерам костного дефекта, применению костнозамещающих материалов в технологии создания имплантатов.
Заключение. Применение индивидуальных костнозамещающих имплантатов, созданных с помощью аддитивных технологий 3D печати, позволило улучшить клинико- рентгенологические результаты оперативного лечения пациентов с доброкачественными и злокачественными опухолями костей нижних конечностей. У всех пациентов после операции наблюдалась положительная динамика в виде купирования болевого синдрома, улучшения статико-локомоторной функции и нормализации показателей по данным обследования по ВАШ, SF 36, шкале Эннекинга. Использование прецизионных индивидуальных костнозамещающих имплантатов в оперативном лечении пациентов с онкологическими заболевания, по нашему мнению, позволит расширить показания к органосохраняющим операциям в онкоортопедии, снизить частоту ампутаций.
Исследование выполнено при финансовой поддержке «Фонда содействия инновациям» («Участник молодежного научно-инновационного конкурса» («УМНИК») 16-3, договор код 0021917).



