Создание новых, высокоэффективных транспортных форм лекарственных препаратов — задача актуальная. Особенно это востребовано в лечении онкологических заболеваний, где достижение необходимого терапевтического эффекта всегда сопряжено с использованием высоких доз препаратов и, как следствие, токсическим действием на органы и функциональные системы организма [8]. Выбор транспортной системы имеет большое значение, так как это существенно влияет на фармакокинетику и фармакодинамику препаратов [9].
В литературе широко представлены работы по созданию систем доставки лекарственных средств, в том числе полимерные наночастицы, липосомы, вирусные наночастицы, переносчики на основе металлоорганических соединений [4, 5]. Анализ состояния исследований в данной области указывает на использование в качестве перспективного переносчика биологически активных соединений, в том числе лекарственных препаратов, основного белкового компонента липопротеинов высокой плотности – аполипопротеина А-I (апоА-I). Являясь веществом амфифильной природы, апоА-I способен связывать и транспортировать как жирорастворимые [3], так и водорастворимые соединения [11]. В работах Kreuter J. et al. и Wohlfart S. et al. показана ключевая роль апоА-I в составе наночастиц при транспорте лекарственных препаратов через гематоэнцефалический барьер (ГЭБ). Механизм поглощения этих частиц связывают с наличием скевенджер рецепторов класса В типа I (SR-BI) на поверхности эндотелиальных клеток головного мозга [13]. Ранее нами была показана способность апоА-I образовывать устойчивые комплексы с противоопухолевыми препаратами — актиномицином Д, винбластином. Рассчитаны качественные и количественные характеристики этого взаимодействия. Показана возможность препаратов в составе комплексов проникать в опухолевые клетки [1].
Целью данной работы является исследование способности аполипопротеина А-I выступать в качестве транспортного средства противоопухолевых препаратов доксорубицина и мелфалана.
Материалы и методы
Аполипопротеин А-I выделяли из фракции липопротеинов высокой плотности (ЛПВП). Делипидирование проводили охлажденной смесью хлороформ—метанол (1:1) из расчета 20 мл смеси на 1 мл ЛПВП с последующей многократной отмывкой эфиром. Для получения апоА-I суммарные белки ЛПВП в растворе 3% Ds-Na и 0,1%-ного меркаптоэтанола наносили на колонку (1,6 х 100 см) с Сефарозой 6В-CL («Pharmacia», Швеция) и элюировали 5 мМ Трис-НСl буфером, рН 8,6, содержащим 6 М мочевину, 0,01% азид натрия и 1 мМ фенилметансульфонилфторид. Скорость потока — 10 мл/ч, скорость самописца – 9 мм/ч. Профиль элюции регистрировали на УФ-детекторе 2151 «LKB» (Швеция) при длине волны 280 нм. Проверка чистоты апоА-I осуществлялась с помощью электрофореза в 10% ПААГ с Ds-Na. Белковые полосы визуализировали 0,1% Кумасси G-250 в смеси метанола и 10% уксусной кислоты (1:1). В качестве маркеров использовали набор низкомолекулярных белков-стандартов (фосфорилаза — 94 кДа, альбумин — 67 кДа, овальбумин — 43 кДа, карбоангидраза — 30 кДа и лактальбумин — 14,4 кДа) [10].
Обессоливание апоА-I проводили методом гель-фильтрации (колонка: 40 ´ 0,8 см, Сефадекс G-25 («Pharmacia», Швеция), элюент: 5мМ трис-НСl буфер, рН 7,4, содержащий 0,15 М NaCl, скорость элюции – 30 мл/ч, скорость самописца – 9 см/ч). Профиль элюции регистрировали на УФ-детекторе при длине волны 280 нм. Концентрация обессоленного белка составляла 0,2 мг/мл.
Изучение спектров поглощения противоопухолевых препаратов в оптической области электромагнитного излучения проводили на спектрофотометре Evolution 300 (Thermo Fisher Scientific, США).
В работе использовали 1 мМ маточные растворы доксорубицина и мелфалана (AppliChem, Германия). Взаимодействие апоА-I с противоопухолевыми препаратами изучали методом спектрофлуориметрии при длине волны возбуждения 285 нм и эмиссии в диапазоне от 300 до 450 нм (Шиматзу) [7]. Титрование проводили добавлением аликвот противоопухолевого препарата (по 10 мкл) к 2 мл апоА-I. Расчет константы связывания осуществляли по методу Аттала и Лата [6].
Для подтверждения возможности попадания комплекса апоА-I—цитостатик в опухолевые клетки использовали флуоресцентный маркер – флуоресцеинизотиоцианат (ФИТЦ). АпоА-I метили 1%-ным раствором ФИТЦ в 0,1 М Na2HP04. Процесс конъюгации проводили при 4ºС в течение 18 ч в 0,1 М бикарбонатном буфере (рН 9,0) и в молярном соотношении белок/краситель 10/1 [12]. От свободной метки освобождались методом гель-фильтрации. Эксперименты проводили на клетках асцитной карциномы Эрлиха. Выделение клеток из перитонеального экссудата проводили на 10-й день после перевивания. Под легким эфирным наркозом мышей забивали с помощью дислокации шейных позвонков, вскрывали брюшную полость в нижнем латеральном отделе. Собирали перитонеальный экссудат и вносили в центрифужные пробирки. Центрифугировали в течение 10 мин при 150g для осаждения клеточных элементов. Осадок клеток трижды промывали большими объемами холодного раствора Рингера—Кребса. Подсчет клеток проводили в камере Горяева. Жизнеспособность клеток оценивали по исключению трипанового синего [13].
Эксперименты на лабораторных животных проводили в соответствии с «Правилами работ с использованием экспериментальных животных» (приказ Министерства здравоохранения СССР от 12.08.1977 № 755 и приложение к приказу № 565 от 04.10.1977), с соблюдением принципов Хельсинкской декларации Всемирной медицинской ассоциации (2000). Животные содержались на стандартной диете и имели свободный доступ к воде. Представленная работа одобрена комитетом по биоэтике НИИ биохимии.
Полученные данные подвергали статистическому анализу с использованием программы StatPlus 2009 Professional 5.8.4., (США). Статистическую значимость полученных результатов оценивали с помощью t-критерия Стьюдента при уровне значимости p<0,05.
Результаты и обсуждение
Метод тушения триптофановой флуоресценции позволяет адекватно оценить способность белковой молекулы взаимодействовать с веществами небелковой природы. При этом можно зарегистрировать не только факт образования комплекса, но и возможные конформационные изменения белка [10]. Анализ спектров аполипопротеина А-I (апоА-I) с исследуемыми препаратами показал снижение триптофановой флуоресценции для доксорубицина – 89%, для мелфалана – 97%. Снижение флуоресценции можно охарактеризовать как результат образования комплекса апоА-I—противоопухолевый препарат [11]. На рисунке 1 представлены кривые тушения для комплекса с доксорубицином.
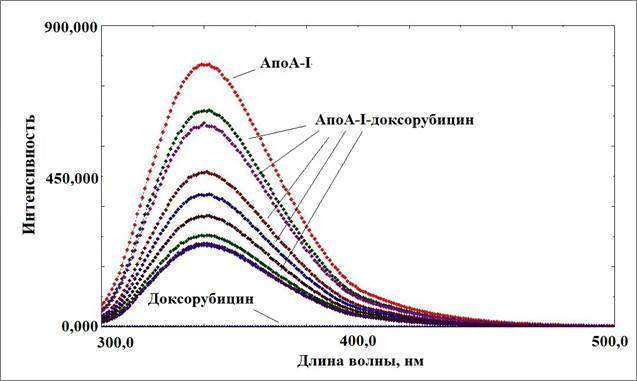
Рис. 1. Изменение спектров триптофановой флуоресценции аполипопротеина А-I при образовании комплекса с доксорубицином
На рисунке видны кривые тушения собственно аполипопротеина А-I , а также снижение интенсивности флуоресценции при добавлении равных аликвот доксорубицина. Похожий график был получен для аполипопротеина А-I с мелфаланом. Изучение временной зависимости тушения флуоресценции при одномоментном добавлении насыщающих количеств препаратов показало, что полное связывание комплексообразующих областей апоА-I наблюдалось уже через 15 мин от начала титрования. Аналогичная картина была получена для комплекса аполипопротеина А-I с мелфаланом. На основании кривых тушения флуоресценции были рассчитаны константы ассоциации при взаимодействии апоА-I с доксорубицином и мелфаланом. Расчетные величины составили 7±0,2 х 105 М-1 и 6,3±0,35 х 106 М-1 соответственно. Было определено количество молекул связанных лигандов на 1 молекулу комплексообразователя. Для апоА-I-доксорубицин – это 27 молекул доксорубицина, а для апоА-I-мелфалан – 48 молекул мелфалана на 1 молекулу апоА-I.
Для подтверждения процесса комплексообразования, а также оценки устойчивости комплекса апоА-I—цитостатик мы использовали метод гельфильтрации на сефадексе G-25. Предварительно мы просканировали исследуемые противоопухолевые препараты на спектрофотометре Evolution 300 для измерения спектров поглощения этих соединений в оптической области электромагнитного излучения. Концентрации препаратов были подобраны экспериментально, с учетом разрешающей способности прибора. Для доксорубицина были определены два максимума поглощения на длинах волн 288 нм и 447 нм. Для мелфалана также были определены два максимума поглощения на длинах волн 264 нм и 343 нм (рис. 2).
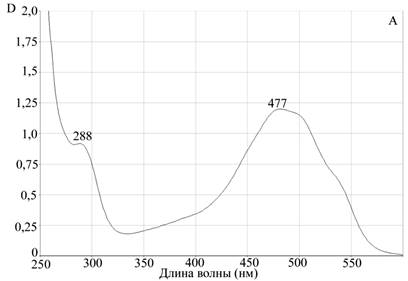
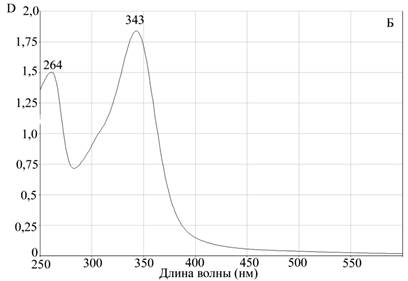
Рис. 2. Данные сканирующей спектрофотометрии.
Спектры поглощения А — доксорубицина, Б — мелфалана
Для исследования возможности комплексообразования мы использовали максимально удаленные от апоА-I пиковые характеристики поглощения. Для белковой молекулы максимум поглощения соответствует 280 нм, поэтому для получения более объективных данных мы брали для доксорубицина величину 477 нм, а для мелфалана 343 нм.
На рисунке 3 представлен профиль элюции комплекса апоА-I с доксорубицином.
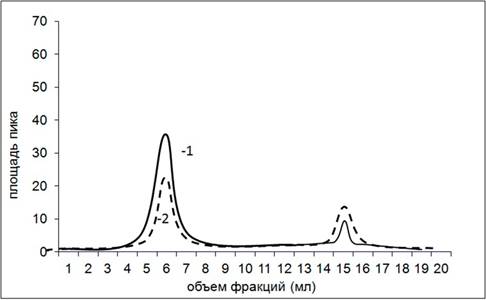
Рис. 3. Хроматографический профиль элюирования апоА-I с доксорубицином.
1 — длина волны 280 нм; 2 — длина волны 477 нм
На рисунке 3 видно, что доксорубицин, так же как и белок, поглощает в области 280 нм, кривая 1, второй пик – 13–15 мл. При проведении элюирования на длине волны 477 нм мы получили два пика: один совпал с пробой, в которой вышел апоА-I, – это первый пик (4–7 мл), кривая под номером 2. Избыток несвязавшегося препарата вышел позже – пик 2 (14–16 мл). Для комплекса апоА-I с мелфаланом была получена аналогичная картина с визуализацией препарата на длине волны 343 нм.
На культуре клеток асцитной карциномы Эрлиха методом флуоресцентной микроскопии, при использовании в качестве метки репортера флуоресцинизотиоционата (ФИТЦ), показана возможность проникновения исследуемых комплексов в цитоплазму и ядра опухолевых клеток. На рисунке 4 можно увидеть культуру опухолевых клеток, которым в инкубационную среду был добавлен апоА-I без маркера (А). На рисунке 4(Б) комплекс апоА-I, меченного ФИТЦ c доксорубицином, и 4(В) комплекс апоА-I, меченного ФИТЦ c мелфаланом.
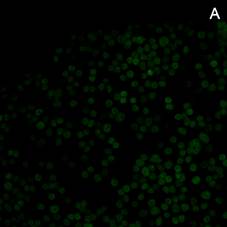

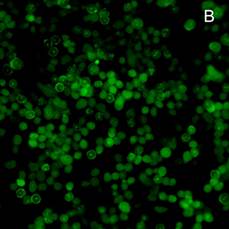
Рис. 4. Флуоресцентная микроскопия (ув. 200). А – клетки карциномы Эрлиха при добавлении апоА-I без маркера (ФИТЦ). Б – клетки карциномы Эрлиха в присутствии комплекса апоА-I, меченного ФИТЦ c доксорубицином, В – клетки карциномы Эрлиха в присутствии комплекса апоА-I, меченного ФИТЦ c мелфаланом. Время инкубации 3 ч
Яркое зеленое свечение в цитоплазме и ядрах клеток (рисунки 4(Б) и 4(В)) подтверждает возможность проникновения комплексов апоА-I—цитостатик в опухолевые клетки [12]. При этом количество флуоресцирующих клеток уже через 1,5 ч инкубации достигает порядка 23–31%, а через 3 ч это значение увеличивается до 68–75% (расчет производили на 100 визуализируемых опухолевых клеток).
Выводы
Проведенные исследования говорят о том, что аполипопротеин А-I обладает способностью образовывать стабильные комплексы с противоопухолевыми препаратами доксорубицином и мелфаланом. Рассчитанные константы связывания указывают на то, что взаимодействие белок—лиганд нельзя назвать высокоспецифическим, однако это может оказаться положительным моментом при освобождении препарата в клетках-мишенях. Количество молекул противоопухолевых препаратов, связанных на 1 молекулу комплексообразователя, представляет широкий диапазон регулирования дозировки препарата. Также показана принципиальная возможность проникновения исследуемых комплексов в цитоплазму и ядра клеток асцитной карциномы Эрлиха. Полученные результаты позволяют считать реальной возможность использования апоА-I в качестве транспортной формы доксорубицина и мелфалана.



