В современной клинической практике с каждым годом возрастает резистентность микроорганизмов к применяемым антибактериальным препаратам, что затрудняет лечение перипротезной инфекции и в итоге приводит к неудовлетворительным результатам лечения [1].
Повсеместное и неоправданное использование антибиотиков во второй половине ХХ века привело к появлению полирезистентностности микроорганизмов к различным видам химических антибактериальных средств, при этом создание новых эффективных и нетоксичных антимикробных средств в фарминдустрии занимает длительное время. В этой связи существует постоянная потребность поиска альтернативных средств антимикробной терапии, а также выбора оптимальных путей их доставки и депонирования, что имеет прикладное значение при выполнении хирургических вмешательств в травматологии и ортопедии для защиты имплантируемой конструкции от возможной инфекции области хирургического вмешательства.
Используемые в настоящее время методы антибактериальной профилактики, а также хирургический метод профилактики формирования липополисахаридной биопленки, продуцируемой пленкообразующими штаммами микроорганизмов на поверхности имплантируемых медицинских изделий и систем, заключающийся в максимально полном иссечении окружающих имплантат инфицированных тканей, не всегда приводят к гарантированной санации области хирургического вмешательства, что в дальнейшем влечет за собой её реинфекцию со всеми вытекающими последствиями, и в частности – повторным формированием среды для жизнедеятельности патогенной микробиоты в области произведенного хирургического вмешательства.
Важным аспектом рассматриваемой проблемы является возможность исходного наличия патогенной микробиоты в окружающих имплантат тканях либо её присоединения гематогенным путем в дальнейшем, что ведет к колонизации имплантата микроорганизмами. Ряд возбудителей, таких как S. aureus и его метициллинустойчивые штаммы, способны продуцировать липополисахаридные биопленки в местах своей адгезии (рис. 1) на поверхности металлов, протезов сосудов и других видов имплантатов медицинского назначения, что требует значительного увеличения рабочих концентраций антибиотиков и ухудшает возможность доставки антибактериальных терапевтических средств в воспалительный очаг за счет барьерных свойств бактериальной биопленки, защищающей бактерии от внешних воздействий.
Появление к настоящему времени все большего количества сведений о регуляции бактериальной адгезии, вирулентности и формирования биопленок, бактериальных межклеточных сигналов и механизмах энергетического обмена и биохимических реакций в клетках бактерий привело к расширению понимания дальнейшей стратегии и смещению акцентов в сторону превентивных мер, направленных в первую очередь на предупреждение колонизации имплантируемых устройств и систем патогенными микроорганизмами, нарушению формирования либо непосредственному повреждению биопленок с блокированием межклеточных сигналов [4] и дестабилизации систем поддержания гомеостаза патогенных микроорганизмов [12], наряду с применением неспецифических бактерицидных препаратов или их комбинаций.
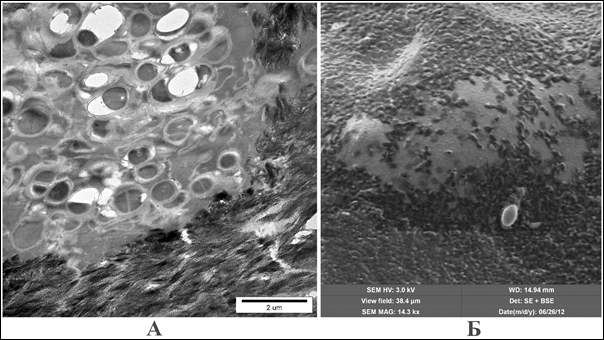
Рис. 1. Электронная микроскопия образцов биоматериала. А – Биопленка, образованная S. aureus, выделенная с поверхности ортопедического металлоимплантата. Трансмиссионная электронная микроскопия (фото сделано авторами). Б – Сплошная колонизация имплантата из чистого титана Ps. aeruginosae. Сканирующая электронная микроскопия (фото сделано авторами)
Одним из существующих на сегодняшний день методов борьбы с бактериальными инфекциями, лишенных таких недостатков антибиотиков, как снижение концентрации агента с течением времени и возможные аллергические реакции, являются естественные вирусы, инфицирующие бактерии – бактериофаги [6]. В силу особенностей строения и активности бактериофаги способны преодолевать экзополимерный субстрат биопленок, вызывая значительные изменения в самих биопленках [13] и уничтожать бактерии внутри биопленки, что в случае антибиотиков возможно далеко не для каждого антибиотика. Именно поэтому применение литических бактериофагов в травматологии и ортопедии представляет большой интерес с точки зрения фаготерапии инфекций, вызванных антибиотикорезистентными и биопленкообразующими штаммами бактерий.
Цель исследования. Определить характер изменений величин индикаторов инфекционного процесса (С-реактивного белка и величины скорости оседания эритроцитов) и частоту рецидивов инфекционного процесса при выполнении сравнительного исследования рутинной антибиотикотерапии инфекционных осложнений после эндопротезирования тазобедренного сустава в сравнении с комбинированной антибиотико- и фаготерапией, назначаемых в течение первых 14 суток от момента ревизионного хирургического вмешательства.
Материалы и методы. В настоящее пилотное проспективно-ретроспективное нерандомизированное сравнительное гипотезопорождающее исследование было включено 28 пациентов с инфекционными осложнениями после эндопротезирования тазобедренного сустава, из них в группу исследования были включены проспективно 12 пациентов (8 женщин и 4 мужчин, средний возраст составил 58,4±16,9 лет), которым было проведено хирургическое лечение в объеме одноэтапного цементного ревизионного эндопротезирования тазобедренного сустава с одновременным назначением этиотропного лечения инфекции в виде фаготерапии и антибиотикотерапии.
В группу сравнения было включено ретроспективно 16 пациентов (7 женщин и 9 мужчин, средний возраст составил 55,0±11,0 лет), которым было проведено хирургическое лечение в объеме одноэтапного цементного ревизионного эндопротезирования тазобедренного сустава с одновременным назначением этиотропного лечения инфекции в виде антибиотикотерапии.
Для систематизации больных использовали классификации Coventry-Fitzgerald и Parvizi J. et al. [12, 13]. При проведении диагностических мероприятий критерием наличия перипротезной инфекции (ППИ) были лабораторные признаки синдрома системного воспаления (увеличение содержания С-реактивного белка (СРБ), ускорение скорости оседания эритроцитов (СОЭ), которые оценивали на 2-3, 7 и 10-14 сутки после операции, а также положительный результат бактериологического исследования. По результатам бактериологического исследования структура возбудителей ИОХВ в группах исследования и сравнения по этиологии выглядела следующим образом (Табл. 1).
Таблица 1
этиологическая структура возбудителей ИОХВ в группах исследования и сравнения по результатам бактериологического анализа
|
Возбудитель Кол-во случаев |
S.epidermidis (MSSE) |
S.epidermidis (MRSE) |
S.aureus (MSSA) |
Enterococcus faecalis |
Прочие |
|
Группа исследования |
6 |
3 |
3 |
0 |
0 |
|
Группа сравнения |
4 |
3 |
6 |
2 |
4 |
Примечание к таблице 1: у ряда пациентов в образцах биоматериала были идентифицированы одновременно несколько микроорганизмов.
В случае развития ранней перипротезной инфекции пациенты были госпитализированы в короткий срок с момента манифестации клинической картины, тогда как пациенты с поздней перипротезной инфекцией поступали с задержкой в 2-3 недели, поскольку проходили лечение по месту жительства.
Фаготерапию в настоящем исследовании применяли путем введения бактериофагов производства ФГУП НПО «Микроген» (Россия) через дренажи, выводимые накожно после выполнения хирургического вмешательства. Штаммы фагов применяли этиотропные по отношению к выявленным микроорганизмам.
При выполнении микробиологического исследования после идентификации патогенного микроорганизма и определения антибиотикограммы проводили тестирование чувствительности выявленных микроорганизмов к соответствующему коммерческому бактериофагу производства ФГУП НПО «Микроген» (Россия) (обычно не менее 2-х партий бактериофагов) [1] и контроль за проводимой фаготерапией проводили согласно разработанному нами способу «Способ оценки эффективности фаготерапии при лечении инфекционных заболеваний» (приоритетная справка №2016132090 от 03.08.2016) [3]. Титр бактериофагов в биоматериале пациента определяли через сутки, на четвертый день и на десятые сутки после начала фаготерапии.
Хирургическое лечение у пациентов обеих групп выполняли одноэтапно – удаление эндопротеза и проведение цементного реэндопротезирования с обязательной прессутизацией цемента.
Операцию завершали дренированием раны, дренажи устанавливали субфасциально к шейке бедренного компонента и выводили через отдельный прокол на боковой поверхности бедра, а саму рану послойно ушивали с применением внутрикожных швов.
Средняя длительность госпитализации пациентов группы исследования в настоящем исследовании составила 29,75±11,871 дней, в группе сравнения – 23,53±8,56 дней.
Пациентам группы исследования в течение 10 суток после завершения операции в дренажи вводили коммерческий бактериофаг к выделенному микроорганизму объемом до 20 мл; у пациентов группы сравнения бактериофаг не применяли.
Поскольку монотерапию бактериофагами у пациентов группы исследования в настоящем исследовании не применяли, то всем пациентам этой группы в послеоперационном периоде была дополнительно назначена этиотропная антибактериальная терапия на срок до 12 недель по следующим схемам:
В стационарных условиях (первые две недели) – парентерально вводили ванкомицин в дозе 1,0 г два раза в сутки, внутривенно капельно и цефазолин в дозе 2,0 г три раза в сутки, внутривенно капельно [14].
После выписки, на амбулаторном этапе пациентам были назначены пероральные антибиотики по следующим схемам:
1. Ципрофлоксацин в дозе 0,5г х два раза в сутки в течение 21 дня и рифампицин в дозе 450мг х два раза в сутки в течении 10 недель;
2. Триметоприм/сульфаметоксазол в дозе 480 мг два раза в сутки в течение 1 месяца, затем доксициклин в дозе 100 мг два раза в сутки в течение 8 недель.
В группе сравнения антибиотикотерапию назначали с учетом чувствительности микроорганизмов к препаратам по следующим схемам:
В стационаре:
1. Цефазолин 2,0 г три раза в сутки на срок до 2 недель;
2. Ванкомицин 1,0 г два раза в сутки на срок до 4 недель + даптомицин 0,5 г один раз в сутки на срок до 3 недель;
3. Ципрофлоксацин 0,4 г два раза в сутки на срок до 4 недель;
4. Цефазолин 2,0 г три раза в сутки + даптомицин 0,5 г один раз в сутки на срок до 2 недель;
5. Ванкомицин 1,0 г х два раза в сутки на срок до 1 недели и цефазолин 2,0 г три раза в сутки на срок до 3 недель;
6. Ванкомицин 1,0 г х два раза в сутки + рифампицин 0,6 г один раз в сутки на срок до 2 недель.
После выписки пациентам этой группы назначали ципрофлоксацин в дозе 0,5г х два раза в сутки в течение 3-5 недель либо рифампицин 0,3 г один раз в сутки в течение 3 месяцев.
Обработку полученных результатов исследования проводили при помощи программного обеспечения SPSS v19.0 путем вычисления описательных статистик и сравнения значений переменных, относящихся к дискретной шкале. Все описательные статистики представлены в виде непараметрических статистик - медианы (Мe) и нижнего и верхнего квартилей [Q1; Q3], за исключением возраста пациентов и сроков их пребывания в стационаре, которые представлены в виде средней и стандартного отклонения. С учетом малого размера популяционной выборки сравнения проводили непараметрическими методами: внутригрупповые сравнения проводили парным ранговым методом Уилкоксона с поправкой на множественность сравнений, для проведения межгрупповых сравнений использовали метод Уилкоксона-Манна-Уитни.
Различия сравниваемых величин при внутригрупповом сравнении анализировали с учетом поправки на множественность сравнений и считали значимыми при значениях, не превышающих порогового уровня двунаправленной статистической значимости (α = 0,05 / 5 = 0,01). При межгрупповом сравнении пороговым уровнем двунаправленной статистической значимости считали α = 0,05.
Результаты и их обсуждение. При выполнении микробиологического контроля в первые 14 дней после операции лишь у двух из 12-ти пациентов группы исследования на 4-ые сутки фаготерапии была идентифицирована смена патогенного микроорганизма, что потребовало отмены ранее назначенной фаготерапии и смены антибактериальной терапии с назначением другого антибиотика на срок до 12 недель.
У остальных 10-ти пациентов группы исследования в образцах раневого отделяемого роста ранее идентифицированного патогенного микроорганизма не отмечено. Анализ титра бактериофага в соответствии с предложенным нами способом показал, что содержание бактериофагов в раневом отделяемом достигало значений ≥104 БОЕ/мл в первые трое суток после начала фаготерапии (при этом концентрация бактериофагов в ежесуточно вводимом пациентам через дренажи препарате была терапевтической и составляла не менее 106 БОЕ/мл). Фаготерапию при этом продолжали в течение 10 суток после операции, учитывая изменение содержания контролируемых маркеров воспаления в образцах биоматериала пациентов.
Что касается изменений величин контролируемых параметров в настоящем исследовании, то оно характеризовалось следующими изменениями: при внутригрупповом сравнении в каждой из двух изучаемых групп пациентов было установлено, что содержание СРБ и величина СОЭ возросли уже на 2-3 сутки после хирургического вмешательства, однако впоследствии происходило их постепенное снижение до конца срока наблюдений. При этом в группе исследования содержание СРБ продемонстрировало статистически значимое снижение в интервале времени с 7-ых до 10-14-ых суток практически в 2,2 раза (p = 0,009), и аналогичным образом значимое различие было зарегистрировано в этой же группе по величине СОЭ в указанном промежутке времени – отмечено снижение в 1,18 раза (p=0,001) (табл. 2, рис. 2 и 3). Что касается группы сравнения, то при анализе внутригрупповых изменений контролируемых параметров величин СОЭ и содержания СРБ статистически значимых различий не отмечено.
В ходе выполнения межгруппового сравнения при сопоставлении полученных в группе исследования результатов с таковыми в группе сравнения статистически значимых различий во всех временных точках измерений не отмечено (табл. 2), но тенденция изменений медиан контролируемых параметров была такова, что медианные значения СРБ в обеих группах к 10-14-ым суткам практически сравнялись (14,79 и 12,73 мг/мл соответственно), тогда как величины СОЭ сохраняли относительно постоянные уровни, хоть и с тенденцией к снижению. Более того, для величин СОЭ была отмечена тенденция к повышенным значениям СОЭ в группе исследования на протяжении всего исследования, а на 7-ые сутки было зарегистрировано недостоверное увеличение в 1,5 раза (р = 0,061), практически на границе принятого нами уровня α для межгрупповых сравнений, что позволяет предполагать, что с увеличением размера популяционной выборки в группе исследования возможно получение статистически значимых различий по данному параметру в указанной временной точке измерений.
Отдельно необходимо остановиться на антибиотикорезистентности выделенных из биоматериала пациентов штаммов микроорганизмов. Всего было идентифицировано шесть таких пациентов: по три пациента из групп исследования и сравнения соответственно (табл. 3), у всех этих пациентов в качестве возбудителя был выделен метициллинрезистентный штамм S.epidermidis (MRSE) (табл. 1). Однако из-за малочисленности таких пациентов в рассматриваемой популяционной выборке, дополнительный анализ по контролируемым параметрам величин СОЭ и СРБ с внутригрупповой градацией пациентов по резистентности микроорганизмов к антибиотикотерапии мы не проводили.
Общий взгляд на изменение значений контролируемых в исследовании параметров говорит о разнонаправленности изменений величин СОЭ и СРБ в группах пациентов с течением времени: прогрессирующая тенденция к снижению содержания СРБ, при одновременной тенденции к сохранению после хирургического лечения практически неизменных величин СОЭ в обеих группах пациентов. Однако в отличие от такого параметра, как величина СОЭ, которая может изменяться из-за множества различных факторов, включая пол и возраст пациента, на уровень СРБ не влияет ни один из известных факторов, кроме наличия и степени выраженности инфекционного воспаления [8], поскольку содержание СРБ обычно существенно возрастает при инфекционных процессах, в т.ч. при остеомиелите и перипротезной инфекции [11]. Период полувыведения из плазмы и уровень катаболизма СРБ являются постоянными величинами почти при любых условиях, поэтому содержание СРБ в плазме определяется только уровнем его синтеза, который, в свою очередь, зависит исключительно от наличия и тяжести инфекционного процесса [8].
Зарегистрированная в нашем исследовании между группами пациентов общая тенденция к увеличению содержания СРБ на 2-3 сутки, выражавшаяся в увеличении среднего содержания СРБ у пациентов группы исследования, позволяет предполагать более выраженную остроту инфекционного процесса у пациентов, получавших комбинированную фаго- и антибиотикотерапию, равно как и дает возможность предполагать рост содержания маркеров острофазовых реакций (к которым относится и СРБ) в ответ на введение бактериофагов, которые способны вызвать резкое сокращение популяции патогенных микроорганизмов, что может сопровождаться выбросом значительного количества бактериальных токсинов во внутреннюю среду организма и спровоцировать сильный острофазовый ответ иммунной системы.
Таблица 2
Средние величины содержания контролируемых маркеров воспаления в течение 10-14 суток после операции в группе исследования (n=12) и в группе сравнения (n=17) (данные представлены в виде Me [Q1; Q3])
|
Параметр |
Группа исследования (фаготерапия + АБТ), СРБ, мг/л |
Группа сравнения (АБТ), СРБ, мг/л |
Группа исследования (фаготерапия + АБТ), СОЭ, мм/ч |
Группа сравнения (АБТ), СОЭ, мм/ч |
|
До операции |
27,29 [20,50; 38,82] |
35,5 [14,90; 50,33] |
51,50 [35,25; 82,00] |
44,5 [31,50; 86,75] |
|
Уровни значимости (межгрупповое сравнение) |
0,698 |
0,846 |
||
|
2-3 сутки после операции |
94,15 [46,22; 160,24] |
51,5 [31,77; 112,90] |
72 [43,75; 100,75] |
53 [31,50; 80,00] |
|
Уровни значимости (внутригрупповое сравнение) |
До операции – через 2-3 суток: p = 0,049 |
До операции – через 2-3 суток: p = 0,065 |
До операции – через 2-3 суток: p = 0,025 |
До операции – через 2-3 суток: p = 0,632 |
|
Уровни значимости (межгрупповое сравнение) |
0,165 |
0,156 |
||
|
7 сутки после операции |
38,92 [17,80; 54,79] |
23,72 [16,70; 51,52] |
78,5 [63,75; 96,00] |
52 [27,25; 90,75] |
|
Уровни значимости (внутригрупповое сравнение) |
До операции – через 7 суток: p = 0,519; через 2-3 суток – через 7 суток: p = 0,02 |
До операции – через 7 суток: p = 0,860; через 2-3 суток – через 7 суток: p = 0,025 |
До операции – через 7 суток: p = 0,02; через 2-3 суток – через 7 суток: p = 0,278 |
До операции – через 7 суток: p = 0,991; через 2-3 суток – через 7 суток: p = 1,0 |
|
Уровни значимости (межгрупповое сравнение) |
0,537 |
0,061 |
||
|
10-14 сутки после операции |
14,79 [10,87; 26,22] |
12,73 [9,00; 31,97] |
66,5 [53,50; 79,50] |
43,5 [31,25; 76,75] |
|
Уровни значимости (внутригрупповое сравнение) |
До операции – через 10-14 суток: p = 0,064; Через 7 суток – через 10-14 суток: p = 0,009 |
До операции – через 10-14 суток: p = 0,159; Через 7 суток – через 10-14 суток: p = 0,025 |
До операции – через 10-14 суток: p = 0,248; Через 7 суток – через 10-14 суток: p = 0,001 |
До операции – через 10-14 суток: p = 0,668; Через 7 суток – через 10-14 суток: p = 0,073 |
|
Уровни значимости (межгрупповое сравнение) |
1,0 |
0,133 |
Примечание: АБТ – антибиотикотерапия
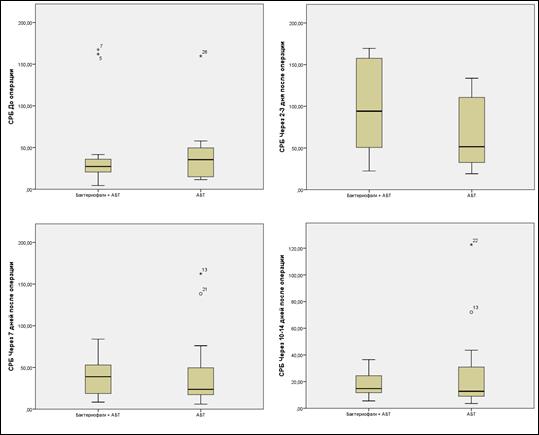
Рис. 2. Коробчатая диаграмма величин СРБ в группах пациентов с градацией по типу лечения (фаготерапия + антибиотикотерапия (АБТ) и терапия антибиотиками)
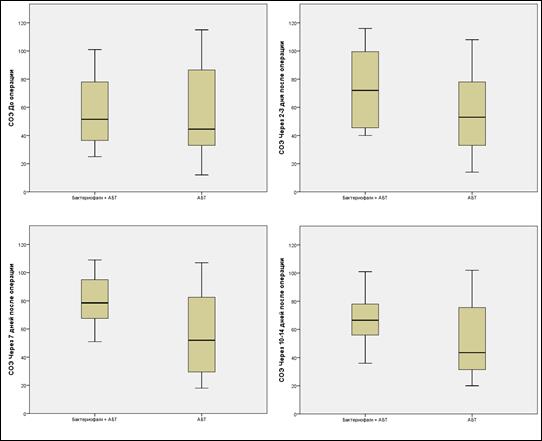
Рис. 3. Коробчатая диаграмма величин СОЭ в группах пациентов с градацией по типу лечения (фаготерапия + антибиотикотерапия (АБТ) и терапия антибиотиками)
При этом надо отметить, что тенденция к последовавшему на 10-14-ые сутки после ревизионной операции более быстрому (исходя из величин верхнего квартиля) снижению содержания СРБ в группе исследования, наряду с отсутствием экстремально высоких значений (тогда как в группе сравнения с 7 по 10-14 сутки сохранялись два статвыброса свыше 60 мг/л), косвенно указывала на возможно более эффективное подавление инфекционного процесса при использовании комбинированной фаго- и антибиотикотерапии. Другим немаловажным фактором является то, что использованные нами на стационарном этапе лечения в группе исследования антибиотики не являются биопленкопроникающими, и хотя мы не проводили анализ штаммов микроорганизмов на предмет их способности к биопленкообразованию, вероятность биопленкообразования полностью исключать нельзя, особенно с учетом длительности течения инфекционного процесса у изученных пациентов до выполнения им ревизионного хирургического вмешательства – в таком случае воздействие на микроорганизмы, содержащиеся в различных слоях биопленки, могли оказать только бактериофаги, которые обладают специальными ферментами, позволяющими им проникать сквозь биопленку и разрушать её липополисахаридную структуру [7, 15].
Что касается характеристики частоты рецидивов ППИ в исследуемой популяции, то за полугодовой период наблюдений в группе исследования был зарегистрирован лишь один рецидив ППИ (при этом фаготерапия не была проведена в полном объеме из-за смены микроорганизма со S.epidermidis MSSE на S.haemolyticus MRSH на 4-ые сутки послеоперационного периода, несмотря на проводимую антибактериальную терапию), тем самым частота рецидивов составила (1*100)/12 = 8,3%, тогда как группе сравнения за этот же промежуток времени было зарегистрировано четыре рецидива ППИ, а частота рецидивов составила (4*100)/16 = 25%, что практически в три раза больше, чем в группе исследования.
Таким образом, принимая во внимание то, что рецидив ППИ был зарегистрирован лишь у одного пациента, то итоговая частота эффективности комбинированной фаго- и антибиотикотерапии (выраженная в частоте безрецидивных случаев в изучаемой популяции) в настоящем пилотном исследовании составила 100% – ((1*100%)/12) = 91,7%, а итоговая частота эффективности антибиотикотерапии без применения бактериофагов составила 100 – ((4*100)/16) = 75%.
Впрочем, необходимо упомянуть также о том, что причины появления таких тенденций различия в результатах лечения могут быть связаны в том числе и с различными схемами антибиотикотерапии, которые были применены в группах пациентов, что является одним из ограничений данного исследования (наряду с небольшой популяционной выборкой), поэтому логичным продолжением данного пилотного исследования было бы изучение результатов лечения ППИ у большей по размеру популяции пациентов с идентичными схемами антибиотикотерапии и наличием либо отсутствием бактериофагов в схеме лечения ППИ.
Все вышесказанное позволяет выдвинуть гипотезу о том, что использование фаготерапии в комбинации с антибиотикотерапией, при условии должного статистического обоснования расчета для увеличения популяционной выборки пациентов, получавших такую комбинированную терапию, может продемонстрировать статистически значимое различие по такому маркеру воспаления, как СРБ, в интервале времени 10-14 дней после хирургического вмешательства, однако для этого необходимо одновременное подтверждение посредством микробиологического исследования (анализ титра бактериофагов для контроля эффективности фаготерапии и утилизации самих бактериофагов в очаге инфекции в ходе проведения фаготерапии).
Выводы:
1. В группе исследования после проведенного лечения частота рецидивов перипротезной инфекции в течение полугода наблюдений составила 8,3%, тогда как группе сравнения за этот же промежуток времени частота рецидивов была практически в три раза больше, составив 25%.
2. Тенденция к более быстрому (исходя из величин верхнего квартиля) снижению в интервале времени 10-14 дней наблюдения после ревизионного хирургического вмешательства величины содержания СРБ в группе исследования относительно группы сравнения позволяет предполагать более эффективное подавление инфекционного процесса при использовании комбинированной фаго- и антибиотикотерапии, однако статистическое подтверждение этой гипотезы требует увеличения популяционной выборки таких пациентов.



