Остеоартроз – самая распространенная форма заболевания суставов, обусловленная дегенеративными изменениями в тканях, сопровождающаяся болью, потерей формы и функции сустава [3, 6]. Применение эндопротезирования с целью восстановления функций суставов часто является временным решением, поскольку износ эндопротеза происходит в среднем в течение 10 лет, после чего необходима операция по его замене [3]. С каждым последующим оперативным вмешательством усиливаются риски осложнений и сокращения срока фиксации эндопротеза у оперированных больных [2]. Решение проблемы замещения дефектов хрящевой ткани могло бы отсрочить или даже предотвратить применение операций эндопротезирования, что особенно актуально для молодых пациентов. В настоящее время разрабатываются матрицы с трехмерной структурой, пригодные для заселения аутологичными клетками пациента. Для удовлетворительных результатов заселения матриц хондроцитами необходимо изучить кинетические параметры их роста в культуре с тем оптимизировать условия культивирования клеток и получить их достаточное количество за приемлемое время, поскольку хондроциты сравнительно медленно пролиферируют in vitro.
На свежевыделенных из ткани хондроцитах показано, что патологический процесс, развивающийся при остеоартрозе изменяет фенотипические черты хондроцитов, что проявляется в изменении экспрессии генов версикана, коллагена II типа, KLF4, коллагена I типа у хондроцитов, выделенных из хряща разных топографических зон коленного сустава, различающихся по степени дегенеративных изменений [1]. Это свидетельствует о том, что состояние хрящевой ткани, из которой планируется получать хондроциты, является одним из определяющих факторов наращивания их количества в культуре. Является ли изменения фенотипических характеристик хондроцитов под воздействием патологического процесса у пациентов с остеоартрозом непреодолимыми в процессе культивирования, - неясно. Поэтому цель нашей работы состояла в исследовании жизнеспособности и динамики роста культуры хондроцитов, полученных из хрящевой ткани коленного сустава больных гонартрозом, различающейся по степени дегенеративных изменений.
Для этого мы исследовали выход клеток, полученных из разных зон коленного сустава, динамику их адгезии к поверхности культуральной посуды и роста культуры.
Материалы и методы
Хондроциты выделяли из разных топографических зон коленного сустава, различающихся по степени дегенеративных изменений хрящевой ткани от 8-ми пациентов обоего пола в возрасте 58-72 лет с посттравматическим гонартрозом. Давность заболевания составляла более 10 лет. Все лица, участвовавшие в исследовании, подписали добровольное информированное согласие на исследование их биоматериала. Из исследования пациентов исключали по следующим критериям: установленные металлоконструкции в теле, кроме зубных имплантатов, наличие на момент обследования острых форм или обострения хронических форм инфекционных заболеваний, наличие гнойно-некротических заболеваний, инфицированность вирусами гепатитов В, С, D и ВИЧ, наличие в анамнезе или на момент исследования заболеваний, имеющих аутоиммунную этиологию, злокачественных заболеваний, наличие кардиосклероза, гипотиреоза, стеатогепатоза, ишемической болезни сердца, остеомиелита, ожирения (ИМТ>35), активное злоупотребление психоактивными веществами в анамнезе (включая алкоголь), психические заболевания, а также отказ от участия в исследовании (не подписанное информированное согласие).
Клетки получали путем лизирования кусочков хряща объемом около 1 мм3 раствором 0.2% колагеназы коллагена типа II («Gibco», США) в соотношении 1:9 (w/v) на полной среде DMEM/F12 («Биолот», Россия), содержащей 15% FBS («Gibco», США), 42.19 ед./мл пенициллина, 0.042 мг/мл стрептомицина («Биолот», Россия), 0.053 мг/л амфотерицина В («Biowest», Франция) в конечных концентрациях в течение 18 часов в термошейкере при 37°С. Полученные клетки дважды отмывали PBS и рассевали на 0 пассаж в количестве 23х104 клеток на 1 см2 поверхности во флаконы с площадью роста 25 см2 («TPP», Швейцария).
Пролиферацию клеток оценивали путем подсчета клеток в гемоцитометре под микроскопом MC 700 («Micros», Австрия) после снятия теплым раствором трипсина-версена через 7, 14 и 21 сутки культивирования.
Достоверность различий оценивали с помощью критерия Манна-Уитни.
Результаты и обсуждение
Корреляции количества хондроцитов, выделяемых из разных зон коленного сустава больных гонартрозом с данными об их содержании в хрящевой ткани, полученными в ходе гистохимического и гистоморфометрического исследования [4] отсутствовали. Ранее мы показали, что максимальное содержание хондроцитов в хряще больных гонартрозом наблюдается в минимально измененной дегенеративным процессом зоне со снижением их количества на 11% в зоне с умеренными изменениями [4]. Ярко выраженное снижение содержания клеток – на 66% было обнаружено в хрящевой ткани в наиболее пораженной зоне коленного сустава [4]. Наибольший выход клеток, в расчете на 1 грамм ткани, как и ожидалось, был получен при лизировании хряща наиболее сохраненной зоны коленного сустава – заднего края внутреннего мыщелка бедра (Рис. 1А). Он превышал выход клеток из других зон в 1.5 раза. Различий в выходе клеток между хрящевой тканью медиального и латерального мыщелка большой берцовой кости не обнаружено (Рис. 1А). Отсутствие корреляций содержания клеток в хряще и выхода их при лизировании ткани может быть связано с особенностями ферментативного расщепления ткани коллагеназой II типа, что в свою очередь определяется природой и соотношением расщепляемых субстратов, т.е. строением ткани в этих зонах. Потеря протеогликанов и усиление коллагеновой сети делает хрящевую ткань более плотной, и таким образом, снижает доступность субстрата для лизирующего фермента. Косвенные данные [4] указывают на то, что в хряще из более поврежденных зон коленного сустава больных гонартрозом, происходит замещение коллагена II типа коллагеном I типа, субстратная специфичность к которому у коллагеназы II типа, использованной нами для выделения клеток, меньше. Вследствие снижения содержания более специфичного субстрата в ткани может возрастать скорость расщепления коллагеназой другого субстрата, одновременно являющегося и целевым продуктом выделения – выделяемых клеток.
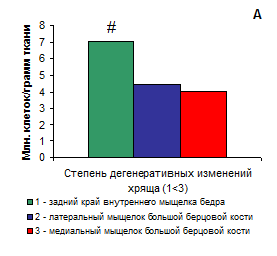
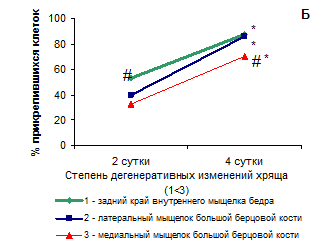
Рис. 1. Выход (А) и адгезия (Б) хондроцитов из хрящевой ткани разных топографических зон коленного сустава. Для построения графиков использовались численные значения медиан в группах сравнения
# p<0.05 по сравнению с другими зонами
*p<0.05 по сравнению с предыдущим периодом
Опираясь на то, что в зоне медиального мыщелка большой берцовой кости наблюдается наибольшее фиброзирование хряща с учетом минимального числа клеток в этой зоне, определяемого гистоморфометрически [4], мы рассчитывали на минимальный выход клеток из этой зоны. Однако полученные данные по числу клеток, выделенных из 1 грамма ткани хряща медиального мыщелка большой берцовой кости, не отличались от данных менее поврежденной зоны коленного сустава – хряща латерального мыщелка большой берцовой кости. Не исключено, что в этом сыграло роль нарушение тинкториальных свойств хрящевого матрикса, его разволокненности в зоне с максимальными дегенеративными изменениями [4], благодаря чему, увеличилась площадь поверхности лизируемых частиц ткани. Очевидно, это способствовало росту доступности субстрата для фермента, а значит, за счет конкурентного ингибирования могла замедлиться реакция расщепления мембранных белков клеток и, таким образом, снизиться повреждаемость хондроцитов. Таким образом, выход жизнеспособных клеток определяется не только их содержание в ткани, но и ее строением.
Исследование адгезии хондроцитов из разных топографических зон коленного сустава у больных гонартрозом к поверхности показало, что скорость адгезии клеток примерно одинакова, но полнота адгезии разная (Рис. 1Б). На 2-е сутки культивирования, доля прикрепленных хондроцитов из заднего края внутреннего мыщелка бедра выше, по сравнению с другими зонами. К 4-м суткам количество прикрепленных клеток из заднего края внутреннего мыщелка бедра и латерального мыщелка большой берцовой кости составляет 85-87%, в то время как из наиболее поврежденного хряща медиального мыщелка большой берцовой кости прикрепилось менее 70% клеток. Таким образом, хондроциты, выделенные из этой зоны, имеют сниженный потенциал адгезии, что может быть связано как с особенностями самих клеток [4, 3], в том числе с их эпигенетическими изменениями [10, 12] или сниженной адаптируемостью, так и с результатом воздействия лизирующего ткань фермента. Очевидно, воздействие коллагеназы на клетки выражается в отсроченном снижении их жизнеспособности на стадии прикрепления к культуральной поверхности. Таким образом, после первой смены среды при культивировании хондроцитов из наиболее дегенерировавшей зоны хряща – медиального мыщелка большой берцовой кости, жизнеспособных клеток остается меньше, чем в культурах клеток из других зон, на 15%.
Чтобы выяснить, приводит ли такое снижение концентрации клеток в процессе культивирования на стадии адгезии к уменьшению биомассы клеток в дальнейшем, мы исследовали динамику роста клеточных культур из 3-х разных топографических зон коленного сустава.
Пик количества клеток из всех зон приходился на 14 сутки культивирования (Рис. 2). Изучение динамики пролиферации клеток разных топографических зон показало, что пациентов можно разделить на 2 группы (Рис. 2 А, Б). Так, хондроциты из минимально поврежденной зоны, - заднего края внутреннего мыщелка бедра, у пациентов первой группы (Рис. 2 А) показали более высокую скорость роста уже на 7 сутки культивирования. Количество культивируемых хондроцитов, выделенных из этой зоны, было выше по сравнению с количеством хондроцитов из других зон на протяжении 21-х суток эксперимента в 1.6-2.2 раза. И хотя период удвоения популяции клеток во всех зонах составил 3-4 суток, прирост количества клеток из хряща минимально измененной дегенеративными процессами зоны был в 1.4-2.1 раз больше по сравнению с другими зонами и к 14-м суткам составил 584%. Возможно, что в данном исследовании из-за больших интервалов подсчета клеток не были установлены сроки, в которые могло происходить уменьшение их численности или замедление пролиферации. О существовании таких периодов свидетельствует и удлиненный интервал лагфазы в культурах хондроцитов из более поврежденных зон коленного сустава. Тем не менее, мы предполагаем, что пациентов первой группы потенциал восстановления хрящевой ткани высок, и даже клетки из максимально поврежденной зоны способны к восстановлению при определенных условиях.
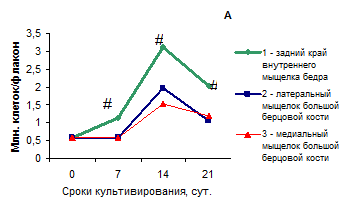
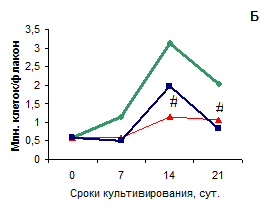
Рис. 2. Прирост количества клеток во времени у пациентов двух групп, различающихся по пролиферации клеток из разных топографических зон коленного сустава
Для построения графиков использовались численные значения медиан в группах сравнения. А – первая группа, Б – вторая группа (описание в тексте). # p<0.05 по сравнению с другими зонами
У пациентов второй группы (Рис. 2 Б) скорость роста культуры и количество хондроцитов в динамике культивирования не различима у клеток, полученных из зон с минимальной (задний край внутреннего мыщелка бедра) и средней степенью (латеральный мыщелок большой берцовой кости) дегенеративных изменений, в то время как хондроциты из максимально измененной зоны показали сниженную способность к росту: время удвоения популяции у этих клеток было увеличено в 2 раза, по сравнению с клетками из менее поврежденных зон хряща коленного сустава. Это свидетельствует о том, что у таких пациентов хондроциты в зоне медиального мыщелка большой берцовой кости существенно отличаются по фенотипическим чертам, причины чего предстоит выяснить. Такими причинами могут быть особенности структуры хрящевой ткани вследствие индивидуальных различий у пациентов с разной биомеханикой тела, длительностью заболевания, полом, возрастом [7] и другими факторами, а также их сочетанием. Не исключено, что вклад в различие пролиферации хондроцитов вносит их способность в культуре синтезировать неодинаковое количество компонентов внеклеточного матрикса. Известно, что на пролиферацию хондроцитов оказывают влияние синтезируемые ими протеогликаны. Большие протеогликаны, такие как агрекан и версикан создают микроокружение для клеток и путем электростатических взаимодействий с факторами роста и другими сигнальными молекулами могут модулировать транспорт этих между клетками [6, 11]. Малые протеогликаны, такие как декорин, структурируют сеть коллагена, что влияет на жесткость микроокружения клеток и, безусловно, на передачу механических стимулов, регулирующих метаболизм клеток in vivo [5, 8]. Основываясь на ранее полученных данных, свидетельствующих о разной степени экспрессии компонентов внеклеточного матрикса выделенными хондроцитами из разных топографических зон коленного сустава больных гонартрозом [4], мы предполагаем, что такое положение вещей может сохраняться при культивировании хондроцитов по крайней мере у некоторых пациетов. Необратимость таких изменений подтверждается сниженной способностью к росту хондроцитов в культуре у части пациентов.
Заключение
Проблема замещения дефектов и восстановления хряща в настоящее время стоит достаточно остро. Клетки из разных топографических зон коленного сустава больных гонартрозом с разной степенью дегенерации хряща, различаются по адгезивным и пролиферативным свойствам. Проведенное исследование показало, что использование хряща из заднего края внутреннего мыщелка бедра является перспективным для получения хондроцитов с целью аутотрансплантации, поскольку при выделении хондроцитов из этой зоны хряща наблюдается максимальный выход клеток, которые при этом характеризуются наибольшим приростом в динамике культивирования. Сниженная жизнеспособность и/или пролиферация в культуре хондроцитов из максимально разрушенной зоны коленного сустава, выражающаяся в почти постоянном количестве клеток в ходе культивирования на протяжении всего исследования, наблюдается не у всех больных посттравматическим гонартрозом. Следовательно, не исключено, что при создании соответствующих условий у части пациентов хондроциты из этой зоны хряща коленного сустава могут быть достаточно жизнеспособными, однако, какое количество и какой состав матрикса они при этом могут синтезировать, неясно, и поэтому требует изучения.
Работа выполнена на средства гранта Президента Российской Федерации для государственной поддержки молодых российских ученых №МК-6370.2015.7



