Показания для проведения вентрального спондилодеза с использованием передних шейных пластин и опорных имплантатов в настоящее время достаточно широкие. К ним относятся заболевания, приводящие к нестабильности позвоночника за счет поражения либо повреждения передней и средней опорных колонн (тел позвонков, межпозвонковых дисков, передней и задней продольной связки). Подобные состояния развиваются вследствие травмы, дегенеративных поражений, новообразований, инфекции. Причиной к поиску новых способов фиксации позвонков послужили неудовлетворительные результаты хирургического лечения повреждений шейного отдела позвоночника, связанные, как правило, с несостоятельностью спондилодеза в отдаленном периоде – отсутствием костного сращения и прогрессированием нестабильности [1-3]. Одна из причин этого – несовершенство применяемых методов стабилизации позвоночника [7].
Цель исследования: изучить эффективность фиксации позвоночных сегментов наноструктурированными керамическими имплантатами при выполнении вентрального межтелового спондилодеза.
Материалы и методы
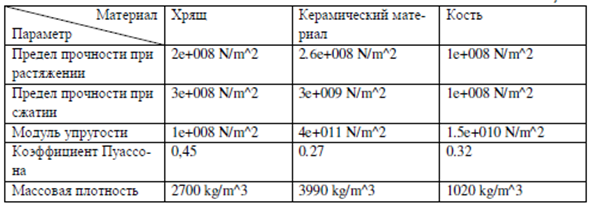
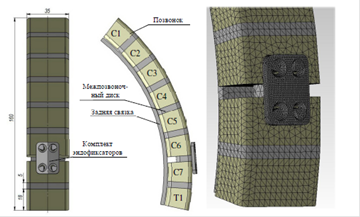
В качестве материала исследования послужили минипиги, которым проведен вентральный спондилодез на поясничном уровне с использованием наноструктурированных имплантатов: эндофиксатора межтелового, изготовленного из пористой биоинертной керамической композиции Al2O3-ZrO2 с покрытием из гидроксиапатита (Ca10(PO4)6(OH)2), с наличием упрочняющих добавок (Y2O3, Cr2O3, SrO, ZrO2) с пористостью в диапазоне от 15 до 25% и керамической пластины с винтами, изготовленными из монолитной (плотной) биоинертной керамической композиции Al2O3-ZrO2. Предварительно проведено моделирование напряженно-деформированного состояния комплекта керамических эндофиксаторов. Для этого разработана объемная модель подвижного отдела позвоночника, геометрия представлена на рис. 1 а, б. В модели учитывались физико-механические свойства материалов, представленных в таблице.
Физико-механические свойства материалов
А Б
Рис. 1. Модель подвижного отдела позвоночника: А – прямая и боковая проекции позвоночника; Б – модель фиксации позвоночного сегмента
Расчет проведен в программной среде Solid Works Simulation методом конечных элементов (МКЭ) с использованием линейного статистического анализа.
Эксперимент in vivo осуществлялся согласно этическим нормам, регламентирующим эксперименты на животных в соответствии с международными и российскими нормативно-правовыми документами. Все экспериментальные исследования на животных проводили в условиях специализированной ветеринарной операционной с соблюдением правил асептики и антисептики и выполняли в несколько этапов. Эксперимент проведен на 8 половозрелых самцах-минипигах массой от 40 до 60 кг. Всем животным смоделирован и проведен под общей анестезией вентральный межтеловой спондилодез на уровне L4-L5 и L6-L7 из внебрюшинного доступа. После достижения передней поверхности поясничного отдела позвоночника локализовывалась и обнажалась передняя поверхность тел поясничных позвонков (на уровне L7-L6 и L5-L4) со смежными межпозвонковыми дисками. На уровне L6-L7 при помощи дискотома, костной ложки, кюретки, костных щипцов осуществлялась тотальная дискэктомия в пределах задней продольной связки с частичной резекцией задних лимбов смежных тел позвонков. Используя шаблон и шабер соответствующего типоразмера формировался межтеловой паз, в который внедрялся соответствующих размеров керамический имплантат с уложенной внутрь аутокостью. Далее на переднюю поверхность позвоночника на уровне L6-L7 с использованием шаблона укладывалась пластина, которая фиксировалась через отверстия керамическими винтами в тела смежных позвонков. Подобным образом проводились манипуляции на уровне L4-L5. Рана ушивалась послойно. Сразу после экспериментальных операций проводилась контрольная рентгенография на операционном столе. Спустя 3 месяца после проведенных операций проводилась эвтаназия лабораторных животных с последующим забором оперированных сегментов позвонков для проведения рентгенологических, гистологических исследований. Забранные макропрепараты очищались от мягких тканей, подвергались визуальной оценке и МСКТ-исследованию. После чего проводилась их фиксация, декальцинация и окрашивание для подготовки к световой микроскопии. Первая проводилась путем экспозиции препаратов в забуференном (pH=7,4) 10%-ном растворе формалина в течение 3 суток с последующей дофиксацией в течение 1 суток в растворе, одна часть которого состояла из 1,5%-ного раствора параформа, а вторая – из 1,5%-ного раствора глютарового альдегида.
Декальцинация осуществлялась путем экспозиции препаратов в растворе Трилон «Б», после чего керамические имплантаты были удалены, что позволило в дальнейшем произвести сечение имплантационного ложа и изучить пограничную зону «керамика - кость». По окончании подготовки препаратов они окрашивались гематоксилином-эозином и пикрофиксином по Ван Гизону [23].
Для оценки результатов исследования использовались следующие методы:
- рентгенологический (оценка положения винтов, пластины, межтелового кейджа, определение уровня проведенной стабилизации);
- МСКТ-исследование (оценка степени костного блока по классификации G.H. Tan et al. [14], оценка проседания межтелового имплантата, оценка наличия резорбции вокруг имплантата, оценка целостности имплантатов);
- гистологическое исследование (оценка биосовместимости на основании оценки наличия признаков воспаления вокруг имплантатов, качество сформированной ткани костных блоков).
Результаты
Результаты, полученные при моделировании нагрузок в эксперименте, позволили сделать вывод, что в заданных условиях напряжения при сгибании, разгибании и наклонах разрушение имплантатов-эндофиксаторов не возникает. Максимальное напряжение в пластине, в случае изгиба назад, составит порядка 250 MПа, в шурупах 280 МПа. Те же самые показатели отмечены в случае изгиба вперед. Боковые наклоны вызвали напряжение на пластине и винтах порядка 120 МПа. Стоит отметить, что расчет проведен для крайних случаев положения позвоночника, а при использовании ограничивающих движение устройств нагрузки были в полтора-два раза меньше. Полученные результаты были использованы для изготовления заданной прочности, дизайна межтелового имплантата, пластины и винтов.
При оценке рентгенограмм поясничного отдела позвоночника в прямой и боковой проекциях, выполненных сразу после операции, во всех случаях отмечено удовлетворительное положение винтов, пластин и межтеловых кейджей. Подтвержден правильный уровень фиксации у каждой особи.
У всех животных отмечено заживление послеоперационной раны и хорошая активность в течение 3 месяцев жизни после операции.
Данные МСКТ через 3 месяца подтвердили формирование костно-керамических блоков разной степени выраженности во всех 16 случаях спондилодеза: 1 степень блока по G.H. Tan et al. [14] отмечена в 75% (12 случаев), 2 степень в 25% (4 случая).
В этих 4 случаях (25%) отмечено проседание имплантата и резорбция вокруг имплантатов.
В 100% случаях имплантаты сохранили свою целостность с момента установки.
И лишь в одном случае была отмечена миграция винта (выкручивание на 2 витка), но костный блок при этом состоялся.
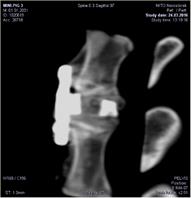
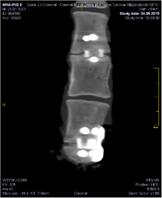
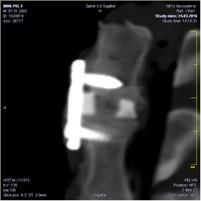
А Б В
Рис. 2. МСКТ контроль блока позвонков через 3 мес. после операции:
А – сагиттальный срез на уровне L4-L5; Б – фронтальный срез на уровне L4-L7;
В – сагиттальный срез на уровне L6-L7
При макроскопической оценке стоит отметить высокую прочность костно-керамического блока. Вынужденно приходилось разрушать межтеловые керамические имплантаты для получения доступа к аутотрансплантату в межтеловом промежутке. При извлечении керамических межтеловых имплантатов отмечалось их плотное сращение с прилежащей костной поверхностью тел смежных позвонков. Выявлено удовлетворительное положение винтов, пластин и межтеловых имплантатов. Макроскопически отмечался костный блок (рис. 3А).

Рис. 3. Фотографии макро- и микропрепаратов (окр. ГЭ х 200):
А – макропрепарат межтелового костного блока на уровне L6-L7; Б – микропрепарат аутотрансплантата в зоне контакта с телом позвонка на уровне межтелового промежутка L3-L4 - сформированная костная ткань; В – микропрепарат (зона контакта передней поверхности кости и пластины - инертная фиброзная капсула); Г – микропрепарат губчатой кости тела позвонка L4 на границе с межтеловым керамическим имплантатом
При световой микроскопии через 3 месяца в области аутокостного трансплантата сформирована плотная грубоволокнистая костная ткань с наличием в межбалочных промежутках остеогенной и миелоидной ткани. Это позволяет говорить о перестройке зоны контакта, врастании костной ткани, сформированной из трансплантата, в костную массу тела позвонка, что символизирует формирование единой костной системы между телами позвонков. Здесь же частички керамики в виде черных включений. Между телами позвонков сформировался костный блок (рис. 3Б). На границе контакта передней поверхности тела позвонка и пластины образовалась инертная фиброзная капсула без признаков воспаления (рис. 3В). Негативная реакция и воспалительные изменения в структуре костного мозга в месте контакта с керамическим межтеловым имплантатом отсутствовали (рис. 3Г).
Обсуждение
Травма шейного отдела позвоночника была и остаётся одним из самых тяжёлых состояний с высокой летальностью и инвалидностью. По данным различных авторов, она составляет 19-50% по отношению к общему количеству всех его повреждений, а нижнешейный отдел травмируется в 77,7% всех случаев травмирования шейного отдела [1; 6]. Даже не осложнённые травмы приводят к выходу на инвалидность до 23,5% пострадавших, а осложнённые – практически 100%, из них 77% становятся инвалидами 1 и 2 групп. Летальность при травмах шейного отдела позвоночника составляет 15-32,6% [22]. Вовлечённость в контингент пострадавших преимущественно здоровых людей молодого, трудоспособного возраста определяет медицинскую и социальную значимость проблемы оптимизации лечения больных с травматическим повреждением шейного отдела позвоночника. Впервые металлическая пластина с винтами для фиксации шейного отдела позвоночника при переднем доступе была использована J. Bohler в 1964 году, и результаты были опубликованы в Германии тремя годами позже (Bohler J., 1967) [12]. В дальнейшем эта методика широко распространялась и активно внедрялась благодаря работам Orozco, Caspar, Е. Morsher, Lawri [20], которые модернизировали передние фиксирующие пластины Orozco / АО / ASIF, Caspar / Aesclap и ORION systems.
По данным ряда авторов, артродез с использованием только аутокости на субаксиальном уровне достигается в 77-99% случаев при стабилизации одного уровня, частота артродеза при многоуровневой стабилизации аутокостью снижается [26]. Исследователи в ряде случаев отмечали, что в процессе перестройки костные трансплантаты меняют свою прочность [1; 26] в сторону снижения ее, и тем самым уменьшается их способность нести вертикальную нагрузку, которую они несут в самом начале после установки в межтеловые промежутки. В результате этого происходит сминание трансплантата, что приводит к локальной кифотической деформации шейного отдела позвоночника, чреватой вертебромедуллярным конфликтом и последующим ускорением дегенеративных изменений в смежных дисках [3; 19]. Возникшая необходимость увеличить опороспособность после выполнения вентрального спондилодеза была решена с разработкой и использованием биоинертных опорных имплантатов, изготавливаемых из металла (преимущественно титановых сплавов), пористых металлических имплантатов (танталовых, титановых), пластмассовых дериватов, допущенных к использованию в медицине (полиметилметакрилат, высокомолекулярный полиэтилен, PEEK), керамики (корундовая, диоксид-циркониевая керамика) [17]. Применение межтеловых имплантатов из прочных материалов при выполнении вентрального спондилодеза на нижнешейном уровне с фиксацией вентральными пластинами привело к значительному снижению случаев дислокации конструкции, несостоятельности костного блока, клинически значимых и выявляемых рентгенологически поломок винтов, миграции их [17].
Несмотря на достаточную устойчивость металлоимплантатов к воздействию агрессивных биологических сред, миграция металлов с поверхности имплантатов в ткани организма, равно как и вялотекущие процессы коррозии, всё же происходят и обусловлены, прежде всего, разнородностью состава, высокой электропроводностью и электролитической активностью применяемых в медицине сплавов. Известно, что процесс коррозии всегда носит электрохимический характер. Биологические жидкости, проникающие в структуры имплантата, вступают в контакт с различными металлами, входящими в состав сплава, из которого изготовлен имплантат, что приводит к генерации электрических токов из-за разности потенциалов между коррозирующими с разной скоростью металлами, создавая тем самым гальваническую пару и инициируя высвобождение ионов металлов и продуктов их деградации [19]. Предположительно коррозия происходит из-за примесей в используемом сплаве имплантата. Например, материалы из чистого титана генерируют вокруг себя более низкий уровень электрического тока, тогда как материалы из сплавов титана производят вокруг себя более высокий уровень коррозионного тока [19].
С одной стороны, коррозия может явиться причиной снижения механической прочности имплантата, с другой − может приводить к появлению токсичных продуктов коррозии, не только отравляющих клетки локально в парапротезной зоне, но и создающих токсические концентрации в органах, приводя к нарушению их функции [15]. Некоторые авторы обращают внимание на патогенез ослабления фиксации имплантата и перипротезную потерю костной массы на фоне коррозии и изнашивания металла. Появляющиеся при таких условиях металлические ионы приводят к неблагоприятному клеточному ответу на продукты деградации металла в виде активации иммунной системы вследствие формирования комплексов с эндогенными белками, приводящими к развитию воспалительных, токсических, аллергических реакций и образованию вокруг них фиброзной капсулы [15]. В 73% случаев применения металлических имплантатов (у мужчин) наблюдаются: иммунодепрессия, изменения иммунореактивности и другие иммунные сдвиги, что повышает вероятность послеоперационных осложнений (по данным Kirkpatrick J.S. с соавторами, 2005 г.) Эти же авторы обнаружили, что если никель, входящий в состав сплава металлоимплантата, полностью выводится из организма, то кобальт – на 80-90%, а хром – всего на несколько процентов, кроме того, в 15% случаях никель и в 8% случаях хром являются аллергенами для человека.
Титан и его сплавы остаются предметом выбора в качестве материалов для имплантатов из-за превосходной биологической совместимости, механических свойств и коррозионной стойкости благодаря наличию на своей поверхности так называемой стабильной оксидной пленки. Однако в определенных условиях, например при нанесении царапин в процессе установки имплантата и/или при придании определенной формы и размеров металлическим имплантатам во время операции на позвоночнике, целостность стабильной защитной оксидной пленки может быть нарушена, что приводит к прямому контакту между металлом и агрессивной окружающей биологической средой, вызывая процессы коррозии [15]. Исследования, проведенные in vitro, показали что металлы, присутствующие в имплантатах, вызывают апоптоз (программированную гибель клеток) и повышают остеокластическую активность кости и, как следствие, приводят к уменьшению прочности спондилодеза вследствие ухудшения репаративных свойств кости [15]. Главный недостаток всех металлоимплантатов – их высокая электропроводность и относительная неустойчивость к воздействию агрессивных биологических сред, что не только запускает процессы коррозии, но и становится причиной миграции ионов металлов с поверхности имплантатов в ткани организма. При накоплении металлов в больших концентрациях запускаются механизмы токсического поражения, с нарушением функции практически всех органов и подавлением иммунитета, канцерогенеза, тератогенного эффекта и т.д. Малые концентрации во многом определяют невысокий уровень тканевой интеграции металлоимплантатов с реализацией сценариев их миграции, утраты фиксации, с возникновением осложнений, подчас носящих фатальный характер. Металлические имплантаты, вызывая интерференцию при помещении их в магнитное поле, являются причиной появления артефактов при проведении МРТ-исследований, снижая их диагностическую ценность, что крайне важно для пациентов, нуждающихся в МРТ-мониторинге состояния спинного мозга и его корешков [16].
Использование биоинертных материалов в реконструктивно-восстановительной хирургии выявило еще ряд недостатков, связанных с тем, что кость не может врасти в имплантат, и место контакта заполняется волокнистой соединительной тканью, которая механически охватывает инородное тело, что снижает прочностные свойства фиксации.
Способность к интеграции с костной тканью может быть достигнута нанесением биоактивных покрытий на поверхность имплантатов либо использованием керамики на основе гидроксиапатита. В то же время в публикациях, связанных с применением межтеловых керамических имплантатов (кейджей) из гидроксиапатита (ГАП), отмечается, что хрупкость становится причиной их разрушения в 27% случаев [11]. Результаты использования кейджей из корундовой керамики более обнадеживающие. Более чем десятилетний опыт применения кейджей из корундовой керамики для фиксации шейных сегментов с хорошими исходами в 85% случаев был продемонстрирован Kiwerski J. c коллегами, эти керамоимплантаты не обладали остеоиндуктивными свойствами [8]. Нагрузка, приложенная к хрупкой керамике, приводит к очень быстрому росту микротрещин и, как следствие, к разрушению. Это явление особенно заметно при динамической нагрузке: ударах, толчках и т.д. Таким образом, не только зона контакта «керамика – кость», но и сам керамический имплантат при определенных условиях может являться областью вероятного перелома. Низкой трещиностойкости, присущей керамике на основе Al2O3, лишен керамический материал, изготовленный из оксида циркония (ZrO2) с добавками оксидов магния или иттрия [9].
Присущая керамическим материалам хрупкость свидетельствует о малых упругих и пластических деформациях в процессе их эксплуатации. Вследствие этого керамические материалы не способны к релаксации напряжений и весьма чувствительны к поверхностным и внутренним дефектам. Вследствие чего при рабочих напряжениях, которые меньше средней прочности керамики, на дефектах детали могут возникать локальные напряжения, по своей величине превосходящие прочность материала и приводящие к разрушению изделия.
Структурная организация межтелового имплантата (его пористость) также очень важны и во многом определяют сроки консолидации. Toth J.M. c соавторами в 2006 г. установили, что с увеличением пористости уменьшается продолжительность костной интеграции имплантатов [25]. Так, уже через 3 месяца после имплантации у образцов с 50%-ной пористостью отмечено сращение в 67% случаев, а при 70%-ной пористости уже в 83% случаев, в то время как у костных трансплантатов и керамических имплантатов с 30%-ной пористостью не было отмечено ни одного сращения [4; 5; 7; 25; 27].
Экспериментальные и клинические исследования, выполненные под руководством Г.Х. Грунтовского, позволили исследователям Харьковского НИИТО разработать керамические имплантаты из ГАП и алюмооксидной плотной и пористой разновидностей керамик для моно- и полисегментарной фиксации позвоночника. Методики позволяют добиться надежной стабилизации из переднего доступа за счет конструктивных особенностей имплантатов и отработанной оперативной техники [1; 2]. Однако, несмотря на достигнутые успехи, проблемы применения позвоночных имплантатов из корундовой керамики, касающиеся их хрупкости и недостаточной костной интеграции плотной корундовой керамики, не решены и по сей день.
Заключение
Полученные данные позволяют предположить высокую биоактивность пористой керамики в составе межтелового имплантата. В зоне контакта пластины и передней поверхности тел позвонков не выявлено морфологических признаков цитотоксической активности, во всех случаях отмечен плотный контакт вновь образованной кости с поверхностью пластины без врастания. Эти данные позволяют говорить о биоинертности пластины и винтов, при этом плотная керамика обладает достаточными прочностными свойствами для удержания позвонков в условиях физиологической активности до момента формирования костно-керамического блока.



