Аполипопротеин А-I (apoA-I) человека является основным белковым компонентом липопротеинов высокой плотности (ЛПВП) и имеет широкий спектр физиологических функций, включающих участие в регуляции метаболизма холестерина и уровня липидов в крови, а также обладающих противовоспалительными и антиокислительными свойствами. [5, 8]. Кроме того, apoA-I в составе ЛПВП осуществляет в организме транспорт витаминов, стероидных гормонов и различных ксенобиотиков [2]. Эти свойства apoA-I и ЛПВП делают их перспективными кандидатами в качестве антисклеротических препаратов, а также как природных переносчиков противоопухолевых препаратов гидрофобной природы, антибиотиков и диагностических агентов. Функциональная значимость ЛПВП и их белкового компонента apoA-I для терапевтических и исследовательских целей обусловливает необходимость разработки и совершенствования методов его получения.
Выделение apoA-I из сыворотки крови человека имеет ряд недостатков, таких как низкий выход белка, высокая стоимость из-за ограниченных объемов доступной донорской крови, опасность вирусной контаминации и другие, что не позволяет достичь промышленных объемов производства и существенно ограничивает применение нативного apoA-I в медицине. Получение рекомбинантного apoA-I человека методами генной инженерии представляется наиболее перспективным подходом к достижению крупномасштабного производства этого белка.
Получение рекомбинантного химерного apoA-I в клетках E. сoli зачастую характеризуются низким выходом белка и его загрязненностью эндотоксинами. С этой точки зрения получение рекомбинантого apoA-I в системе дрожжей Pichia pastoris представляет особый интерес, поскольку позволяет получать очищенные от эндотоксинов белки, секретируемые в культуральную жидкость и с гораздо большим выходом, чем в E. сoli. Feng M.Q. с соавт. получали рекомбинантный apoA-I в дрожжах Pichia pastoris, однако выход секретируемого белка apoA-I составил всего 90 мг на литр, что является недостаточным для промышленного производства [3].
В данной работе для получения зрелого apoA-I человека предлагается использовать рекомбинантный химерный белок SUMO3-apoA-I, включающий с N-конца аминокислотную последовательность убиквитин-подобного белка SUMO3 человека, слитую с С-конца с аминокислотной последовательностью зрелого белка apoA-I человека. Предполагается, что SUMO3-специфичная протеаза SP2 будет распознавать аминокислотную последовательность SUMO3 в N-концевой области химерного белка и осуществлять высокоспецифичный гидролиз пептидной связи между С-концевым аминокислотным остатком SUMO3 и N-концевым аминокислотным остатком целевого белка в составе химера.
Материалы и методы
Реактивы: акриламид, N,N’-метилен-бисакриламид, додецилсульфат натрия (SDS), персульфат аммония, N, N, N’, N’-тетраметилэтилендиамин (ТЕМЕД), бромфеноловый синий, 2-меркаптоэтанол, этилендиаминтетрауксусная кислота (ЭДТА), канамицин, агароза, изопропил-β-D-1-тиогалактопиранозид (ИПТГ) корпорации «Sigma-Aldrich» (США). Дрожжевой экстракт, пептон, агар фирмы «Difco» (Великобритания). Ni-NTA-сефароза 6В-CL, набор для выделения ДНК из агарозного геля фирмы «Qiagen» (США). Набор для ПЦР с полимеразой REDTaq фирмы «Sigma-Aldrich» USA. Набор для ПЦР с использованием высокоточной полимеразы Phusion (ThermoFisher Scientific USA). Набор для лигирования фрагментов ДНК c применением ДНК-лигазы фага T4 фирмы «Сибэнзим» (РФ, Новосибирск). ТХУ (трихлоруксусная кислота), фенол, хлороформ, этиловый, изоамиловый и изопропиловый спирты, кислоты, щелочи, соли квалификации «ХЧ» или «ОСЧ» производства «Реахим» (Россия). Эндонуклеазы рестрикции – от компании «Сибэнзим» (РФ, Новосибирск).
Штамм Escherichia coli: BL 21 (DE3) {F– ompT gal dcm lon hsdSB(rB- mB-) λ(DE3 [lacI lacUV5-T7 gene 1 ind1 sam7 nin5])}.
Штамм Pichia pastoris: X-33
Плазмидные ДНК: рJ201 (DNA2.0, США), pPsecSUMO3 (Lifesensors, USA).
Методы
Проектирование синтетического гена apoA-I
Нуклеотидная последовательность синтетического гена apoA-I человека была спроектирована и оптимизирована по кодоновому составу для экспрессии в P. pastoris с использованием компьютерной программы «Gene designer» (фирма “DNA 2.0”, США). Кроме того, в проектируемом гене apoA-I человека были выявлены и заменены пары кодонов, которые, по данным [4], затрудняют или даже останавливают трансляцию мРНК. Оптимизированный ген зрелого белка АпоА1 был синтезирован и клонирован по сайтам рестрикции XhoI и SalI в составе коммерческого плазмидного вектора pJ201.
Конструирование рекомбинантной плазмиды pPsecSUMO3-apoA-I
Синтетический ген зрелого apoA-I был амплифицирован с вектора pJ201-apoA-I методом ПЦР с помощью термостабильной полимеразы Phusion. При амплификации использовали праймеры, достраивающие на 5’-концах 2-х цепей ампликона сайты рестрикции BsmBI и XbaI: праймер №1 5’-CAGCGTCTCTAGGTGATGAGCCACCACAGTC-3’ и праймер №2 CGTCTAGATCATTGCGTGTTTAACTTCTTAGTG-3’ Ампликон гена apoA-I гидролизовали эндонуклеазами рестрикции BsmBI и XbaI и с помощью ДНК-лигазы фага Т4 встраивали в плазмиду pPsecSUMO3, предварительно линеаризованную рестриктазой BsmBI. Полученной лигазной смесью трансформировали клетки E.coli BL21 (DE3). Отбор клонов, содержащих рекомбинантную плазмиду pPsecSUMO3-apoA-I, проводили на агаризованной среде LB, содержащей 50 мкг/мл зеоцина. Наличие целевой ДНК-вставки определяли методом ПЦР колоний. Клон, содержащий плазмиду pPsecSUMO3-apoA-I, использовали для её препаративной наработки.
Получение штамма дрожжей Pichia pastoris – продуцента рекомбинантного химерного белка SUMO3-apoA-I
Трансформацию компетентных клеток дрожжей Pichia pastoris шт. X-33 проводили плазмидой pPsecSUMO3-apoA-I, предварительно гидролизованной рестриктазой BstXI. Отбор трансформированных клонов осуществляли на селективной агаризованной среде ЛБ, содержащей 500 и 2000 мкг/мл зеоцина. Отобранные колонии дрожжей выращивали в течение 2 суток на орбитальном шейкере при 300 об/мин в среде BMGY, после чего вносили индуктор метанол до 0,5 %. По окончании индукции клетки осаждали центрифугированием при 3500 g в течение 20 мин при +4 0С. Белки из супернатантов осаждали 5 % ТХУ. Осадки промывали ацетоном и анализировали электрофорезом в SDS-ПААГ. Клон, продуцирующий наибольшее количество целевого химерного полипептида, отбирался для дальнейшей работы.
Получение химерного полипептида SUMO3-apoA-I
Клон продуцент химера SUMO3-apoA-I выращивали в 50 мл среды BMGY в течение 2 суток на орбитальном шейкере при 300 об/мин, после чего вносили индуктор метанол до 0,5%. На 4-е сутки после индукции клетки осаждали центрифугированием, а в супернатант вносили сульфат аммония до конечной концентрации 60 % от насыщения. Преципитаты белка осаждали центрифугированием при 14000 об/мин 20 минут при комнатной температуре. Полученный осадок, содержащий главным образом рекомбинантный химерный белок SUMO3-аpoA-I человека, растворяли в фосфатно-солевом буфере (PBS) и диализовали против PBS в течение ночи при +40C.
Гидролиз химера SUMO3-apoA-I с высвобождением зрелого аpoA-I человека
Для ферментативного гидролиза химерного белка SUMO3-apoA-I использовали ранее полученный нами фрагмент (240 а.о.) рекомбинантной SUMO3-специфичной протеазы SP2 (SP2f), содержащий аминокислотные остатки с 342 по 582 полноразмерного фермента (589 а.о.). Химерный белок SUMO3-аpoAI инкубировали с SP2f в PBS c 2 mM дитиотреитола в молярном соотношении химерный белок/фермент 200/1 в течение 3-х часов при +30 оС. Выделение и очистку зрелого белка apoA-I проводили с помощью аффинной хроматографии на колонке со смолой Ni-NTA в нативных условиях.
Результаты и обсуждение
Конструирование рекомбинантной плазмиды pPsecSUMO3-apoA-I и получение штамма продуцента химерного белка SUMO3-apoA-I
Оптимизированный для экспрессии в Pichia pastoris ген зрелого apoA-I был клонирован в составе вектора pJ201. Полученная плазмида pJ201-apoA-I была использована в качестве ДНК-матрицы при амплификации гена зрелого apoA-I. Ампликон был клонирован в составе плазмиды pPsecSUMO3. Колонии, выросшие на селективной агаризованной среде ЛБ, содержащей 50 мкг/мл зеоцина, отбирали с помощью ПЦР с праймерами № 1 и № 2 на наличие целевых генов. Штамм дрожжей Pichia pastoris – продуцента рекомбинантного химерного белка SUMO3-apoA-I, получали путем трансформации дрожжей Pichia pastoris линеаризованной плазмидной ДНК pPsecSUMO3-apoA-I. Отбор рекомбинантных клонов проводили на агаризованной среде LB, содержащей антибиотик зеоцин в концентрации от 500 мкг/мл до 2000 мкг/мл. Отобранные клоны исследовали на способность продуцировать целевой рекомбинантный белок с помощью электрофореза лизата клеток, индуцированных метанолом. По результатам электрофореза был отобран клон, продуцирующий наибольшее количество рекомбинантного химерного белка SUMO3-apoA-I (около 600 мкг/мл культуральной жидкости).
Ранее мы исследовали прямую экспрессию зрелого гена apoA-I в клетках Pichia pastoris [1]. При таком варианте экспрессии наблюдалось появление в культуральной среде наряду с целевым белком множества белков, синтезируемых Pichia pastoris (рис.1,А). Это свидетельствовало о имеющем место лизисе дрожжевых клеток, обусловленном, по-видимому, мембранолитическим действием apoA-I. В случае получения белка SUMO3-apoAI лизиса дрожжевых клеток не наблюдалось и в культуральной жидкости присутствовал главным образом целевой белок SUMO3-apoAI (рис.1,Б).

Рис.1. Электрофореграмма белков культуральной жидкости, полученной при экспрессии генов зрелого белка аpoA-I человека и химерного полипептида SUMO3-аpoA-I в клетках P. pastoris. (А) М – маркёр молекулярных масс; 1 – экспрессия гена зрелого белка аpoA-I человека (Б) М – маркёр молекулярных масс; 1 и 2 – экспрессия гена химерного белка SUMO3-аpoA-I человека, 1 – образец культуральной жидкости, 2 – образец культуральной жидкости, сконцентрированной в 5 раз
Получение зрелого аполипопротеина A-I человека путем ферментативного гидролиза рекомбинантного химерного белка SUMO3-аpoA-I протеазой SP2f
Выращивание клеток клона-продуцента химера SUMO3-apoA-I и индукцию синтеза белка проводили, как описано в методах. Белок осаждали сульфатом аммония, полученный осадок растворяли и диализовали против PBS. Чистота полученного рекомбинантного химерного белка SUMO3-аpoA-I человека составляла не менее 85 % по результатам электрофоретического анализа (рисунок не представлен).
Зрелый аполипопротеин A-I человека получали путем ферментативного гидролиза рекомбинантного химерного белка SUMO3-аpoA-I протеазой SP2f. Эта протеаза распознаёт аминокислотную последовательность SUMO3 в N-концевой области химерного белка и осуществляет высокоспецифичный гидролиз пептидной связи между С-концевым аминокислотным остатком SUMO3 и N-концевым аминокислотным остатком целевого белка в составе химера [6, 7]. Как видно из рис. 2, с увеличением количества протеазы повышается эффективность гидролитического расщепления белка SUMO3-аpoA-I с образованием целевого зрелого аpoA-I человека. Для наиболее полного гидролиза необходимо практически эквивалентное количество протеазы, однако, даже при этих условиях гидролизу подвергается не более 70 % молекул химера. Необходимость в избыточном внесении фермента может быть связана с недоступностью сайта протеолиза в химерном полипептиде, обусловленной конформацией этого белка. В пользу такого заключения свидетельствуют результаты наших ранних экспериментов, в которых был продемонстрирован полный гидролиз химерного полипептида SUMO3-GFP низкими концентрациями этой же рекомбинантной протеазы (данные не представлены).
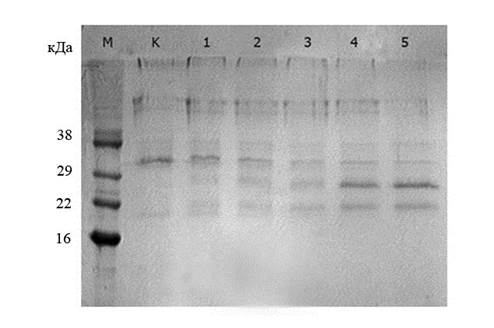
Рис.2. Электрофореграмма продуктов гидролиза химерного белка SUMO3-apoA-I протеазой SP2f. М – маркер молекулярных масс; К – контроль (химер SUMO3-apoA-I не подвергнутый гидролизу протеазой SP2f; (1-5) – химер SUMO3-apoA-I, гидролизованный разными количествами протеазы SP2f: (1) – однократным количеством, (2) – 2-х кратным, (3) – 3-х кратным, (4) – 6-ти кратным, (5) – 10-ти кратным
По данным электрофоретического анализа хроматографически очищенный рекомбинантный зрелый белок apoA-I по молекулярной массе (28,3 кДа) соответствовал природному apoA-I человека, его чистота составила не менее 90 % [рис. 3] с выходом около 400 мг/л.
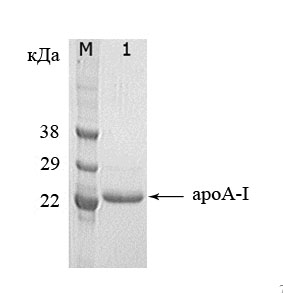
Рис.3. Электрофореграмма образца рекомбинантного зрелого белка apoA-I человека, полученного на конечной стадии очистки. М – маркёр молекулярных масс; 1 – зрелый рекомбинантный apoA-I
Заключение
Получение нативного аполипопротеина А-I человека в промышленных масштабах является актуальной задачей медицинской биотехнологии. Существующие способы получения рекомбинантного apoA-I генно-инженерными методами с помощью экспрессии в клетках E. coli имеют существенные недостатки, такие как: загрязнение целевого белка бактериальными эндотоксинами, сложность, трудоёмкость и сравнительно высокая экономическая затратность процедуры выделения и очистки, а также, как правило, низкий выход конечного целевого белка.
В настоящей работе в целях получения зрелого рекомбинантного apoA-I человека была предпринята попытка создания штамма Pichia pastoris – продуцента химерного полипептида SUMO3-apoA-I. Предполагалось, что синтезированный химер за счёт сигнальной последовательности SUMO3 будет эффективно секретироваться в культуральную жидкость, а входящий в его состав apoA-I не будет вызывать лизиса клеток. Получение же зрелого apoA-I можно будет осуществлять с помощью гидролиза химера SUMO3-специфической протеазы.
Результаты экспериментов свидетельствуют, что рекомбинантный химер SUMO3-apoA-I высокоэффективно синтезировался в клетках дрожжей Pichia pastoris, секретировался в культуральную жидкость и не вызывал лизиса клеточных мембран штамма-продуцента. Гидролиз данного химера SUMO3-специфической протеазой позволил получить зрелый apoA-I человека, соответствующий по молекулярной массе нативному белку apoA-I. Для обеспечения протеолиза всех молекул химерного полипептида потребуются дополнительные исследования по подбору оптимальных условий реакции и оптимизации конструкции рекомбинантной SUMO3-специфической протеазы. Все это позволит существенно улучшить способ получения зрелого apoA-I человека, который будет положен в основу создания технологии промышленного производства белка для нужд медицины.



