Хорошо известно, что основную массу ядерных белков в клетках эукариот, в том числе и эритроцитов рыб, составляют гистоны, которые в своем количественном выражении могут составлять в пересчете на сухую массу ядерного препарата до 40% [1]. Эти важные белки обеспечивают не только плотную упаковку молекул ДНК в хромосомах [4], но и ряд других функций, связанных с экспрессией генов и перестройкой хроматина. Такая перестройка обеспечивает участие гистонов в эпигенической регуляции таких ядерных процессов, как транскрипция, репликация и репарация [7]. Несмотря на то что гистоны были открыты еще в 1884 г. Альбрехтом Косселем в экстрактах ядер эритроцитов птиц [2], ядерные белки эритроцитов рыб до сих пор изучены фрагментарно и требуют расширенных и углубленных исследований. Поэтому цель данной работы состояла в изучении особенностей белкового состава ядер эритроцитов некоторых хрящевых и костистых черноморских рыб и идентификации ядерных белков методом матрично-активированной лазерной десорбции/ионизации (МАЛДИ).
Материал и методы
Исследовали препараты ядерной фракции эритроцитов двух видов рыб: хрящевой рыбы — морского кота (Dasyatis pastinaca L.) и костистой рыбы — ставриды (Trachurus mediterraneus ponticus, Aleev). Для выделения эритроцитов у морского кота пробу крови получали от одной рыбы, для ставриды получали смешанную пробу крови от 5–10 рыб. Кровь в количестве до 10 мл переносили в физиологический раствор, приготовленный для хрящевых (0,22М NaCl + 0,3M мочевина + 0,05М Tрис – НСl буфер pH 7,4) и для костистых рыб (0,18M NaCl + 10 мM TPИС – НСl буфер pH 7,4) в соотношении 1 : 10 и центрифугированием в рефрижераторной центрифуге К-23 при 1500–2000 об/мин осаждали форменные элементы крови. Затем отмытые от плазмы эритроциты в соотношении 1 : 3 помещали в 40%-ный раствор сахарозы +1 мМ PMSF. Полученную суспензию трижды замораживали при –17°С и оттаивали для разрушения плазматической мембраны клеток. После этих процедур суспензию разводили 1 : 10 раствором для отмывания эритроцитов с добавлением 1 мМ PMSF. Ядерную фракцию эритроцитов отделяли центрифугированием в течение 2 мин при 1000–1500 об/мин. Ядра эритроцитов рыб гемолизировали в 5 мМ Трис-HCl буфере (pH = 7,4) + 1 мМ PMSF в течение 50–60 мин при температуре +4°С. Неразрушенные ядра эритроцитов отделяли от супернатанта центрифугированием в течение 2 мин при 1000–1200 об/мин. Затем супернатант, содержащий ядерные белки, центрифугировали 15 мин на рефрижераторной центрифуге К-24 (Германия) при 15 000 g. Полученный осадок ядерных белков отделяли от надосадочной жидкости и отмывали его от гемоглобина. Препарат содержал некоторую часть примеси плазматической мембраны эритроцитов. Однако, как показали электофореграммы, она не мешала идентификации гистонов. До проведения электрофореза полученный препарат ядерной фракции эритроцитов замораживали при –17°С. Вертикальный электрофорез в ПААГ с ДСН полученных препаратов проводили по стандартной методике (сайт: molbiol.ru) в разрешающих гелях 12,5%-ной и 15%-ной плотности на аппарате. Пластинки гелей окрашивали раствором, содержащим: coomassie R 250 – 1 г, С2H5OH – 180 мл, H2O – 180 мл, СH3COOH (лед.) – 40 мл. Полученные электрофореграммы сканировали и при помощи компьютерной программы «Электрофор — Менеджер» производили их денситометрию [6]. Значения Rf использовали для определения молекулярного веса (Mr) путем сравнения подвижности фракций с подвижностью смеси белков с известной Mr. В качестве белков сравнения пользовались стандартным набором маркеров фирмы Sigma (США). Программа «Электрофор — Менеджер» автоматически определяла относительную электрофоретическую подвижность (Rf) и площадь пиков, которые распечатывались в виде протокола эксперимента.
Образцы белковых фракций гелевых пластинок отбирали пластиковыми наконечниками и помещали в стерильные пробирки. Идентификацию ядерных белков (Top-down) проводили методом матрично-активированной лазерной десорбции/ионизации (МАЛДИ, Matrix Assisted Laser Desorption/Ionization, MALDI) [5] на масс-спектрометре ultrafleXtreme (Bruker) фирмы (Helena, EU) в г. Москва.
Результаты и обсуждение
Электрофореграммы с денситограммами белков ядерной фракции эритроцитов морского кота и ставриды (рис. 1, 2) показали сходство полипептидных профилей и незначительно различались по общему количеству идентифицированных фракций (14 и 10 фракций), но не различались по количеству «мажорных» белков (по 6 фракций соответственно).
А![]()
Б 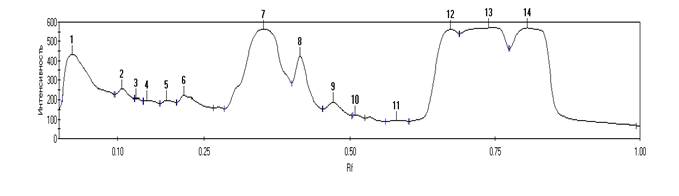
В
Г ______________________________________________________________
Результаты обработки денситограммы
__________________________________________________________________________
№ пика Rf Высота Площадь Площадь % ^=^ Rs
1 0.02 227 12337.67 7.16 1 - 2 2.659198
2 0.11 66 1655.94 0.96 2 - 3 0.8807716
3 0.13 21 293.25 0.17 3 - 4 0.8857092
4 0.15 18 435.25 0.25 4 - 5 1.994931
5 0.18 24 577.71 0.34 5 - 6 1.181247
6 0.21 52 1707.53 0.99 6 - 7 2.01685
7 0.35 421 33280.68 19.31 7 - 8 0.8927923
8 0.42 293 9216.86 5.35 8 - 9 1.612415
9 0.47 72 2340.57 1.36 9 - 10 1.587716
10 0.51 11 173.64 0.10 10 - 11 2.9704
11 0.58 07 60.51 0.04 11 - 12 2.510697
12 0.67 477 23333.48 13.54 12 - 13 1.162541
13 0.74 488 45886.38 26.63 13 - 14 0.9036151
14 0.81 492 41008.59 23.80
___________________________________________________________________________
Общая 2669 172308.06 100
Рис. 1. Электрофореграмма (А) и денситограмма (Б) ядерных белков эритроцитов морского кота (Dasyatis pastinaca L.); (В) — трек свидетелей для определения относительного молекулярного веса белков; (Г) – результаты обработки денситограммы программой «Электрофор — Менеджер»
А![]()
Б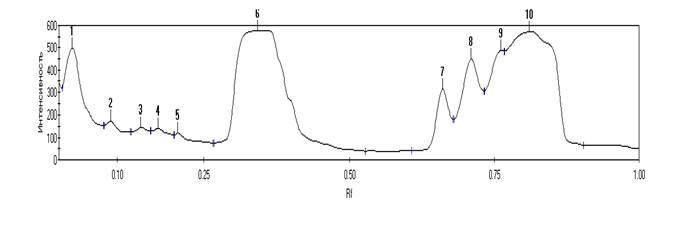
В
Г __________________________________________________________________________
Результаты обработки денситограммы
__________________________________________________________________________
№ пика Rf Высота Площадь Площадь % ^=^ Rs
1 0.02 220 5148.34 4.68 1 - 2 2.062235
2 0.09 26 217.00 0.20 2 - 3 1.707776
3 0.14 19 260.67 0.24 3 - 4 0.9803655
4 0.17 18 159.87 0.15 4 - 5 1.694752
5 0.21 11 318.49 0.29 5 - 6 1.490798
6 0.34 513 55557.98 50.45 6 - 7 3.017087
7 0.66 160 1787.49 1.62 7 - 8 1.104843
8 0.71 191 5056.70 4.59 8 - 9 1.708387
9 0.76 222 4880.45 4.43 9 - 10 0.90043
10 0.81 375 36736.75 33.36
Общая 1755 110123.74 100
Рис. 2. Электрофореграмма (А), денситограмма (Б) ядерных белков эритроцитов ставриды (Trachurus mediterraneus ponticus Aleev); (В) — трек свидетелей для определения относительного молекулярного веса белков; (Г) – результаты обработки денситограммы программой «Электрофор — Менеджер»
Для удобства анализа денситограммы были условно разбиты на три зоны: первая – от 116 kDa до 45 kDa, вторая – от 45 kDa до 25 kDa, третья – от 25 kDa до 4 kDa. В первой зоне у морского кота и ставриды идентифицировано 5 и 6 фракций соответственно. Во второй зоне — 4 фракции у морского кота и 1 фракция – у ставриды, а в третьей зоне — по 4 фракции у каждого вида рыб. Как у морского кота, так и у ставриды в зоне I отмечен пик с относительной молекулярной массой в 116 kDa. Затем следуют «минорные» белки, положение которых у этих двух рыб практически совпадает. Во II зоне денситограмм у двух видов рыб наблюдается большой пик в области 35 kDa и несколько малых, которые более выражены у морского кота. В третьей зоне у обоих видов идет череда пиков «мажорных» белков начиная примерно с 18 kDa, которые имели лучшее разделение у ставриды. Электрофоретическая подвижность отдельных белков минорных фракций варьировала у исследованных видов рыб. Однако подвижность мажорных белков, как следует из рисунков 1 и 2, у ската и ставриды практически совпадала. Схожесть полипептидных профилей препаратов ядерных мембран исследованных рыб предопределила и отбор проб для проведения секвенирования разделенных белковых фракций и поиска гистонов ядерного хроматина эритроцитов рыб. Ввиду того что гистоны относятся к низкомолекулярным белкам, для секвенирования мы отбирали фракции с молекулярным весом менее 35 kDa. У морского кота были отобраны пробы фракции № 7, 10, 12, 13, 14, а у ставриды — № 6, 7, 8, 9, 10. Как видно из рисунков 1 и 2, совокупный процент площади пиков отобранных фракций у морского кота составлял 83,38%, а у ставриды площадь пиков несколько больше – 94,45%.
Результаты по секвенированию белковых фракций ядерного препарата эритроцитов морского кота и ставриды представлены в таблице.
Результаты выборочного секвенирования белковых фракций ядерных препаратов эритроцитов морского кота и ставриды.
|
Вид рыбы |
№ пробы фракции белка |
Название идентифицированного белка |
|
Морской кот |
7 |
Железосодержащий белок митохондриальный |
|
10 |
Гистон H3 (ракообразные) |
|
|
12 |
Гистон Н3 (морская звезда) |
|
|
13 |
Гистон Н2В (рыба) |
|
|
14 |
Хромосоморазделяющий белок Smc (бактерия) |
|
|
Ставрида |
6 |
Рибосомальный белок |
|
7 |
WD40 белок содержащий повторы |
|
|
8 |
Гистон H4 |
|
|
9 |
Гистон Н2B |
|
|
10 |
Гистон Н4 тип 8 |
Из 10 взятых на секвенирование белковых фракций у исследованных видов рыб 8 образцов показали принадлежность к ядерным белкам хроматинового аппарата эритроцитов (табл.). Совокупная площадь пиков гистонов и хромосоморазделяющего белка составила у ската 64,07% (гистоны — 40,27%), а у ставриды (гистоны + WD40 белок) – 44,0% (гистоны — 42,38%). Отличительной особенностью идентифицированных гистонов ската явилось наличие 10-й фракции с относительно высоким молекулярным весом, равным примерно 25 kDa. Остальные два гистона имели молекулярную массу, равную 10 и 8 kDa. У ставриды все идентифицированные гистоны имели молекулярную массу менее 8 kDa. Секвенирование показало наличие у хрящевого вида двух гистонов — Н3 и гистон Н2В, у костистого вида – два гистона Н4 и гистон Н2В.
Идентифицированные в ядерных препаратах гистоны эритроцитов рыб относятся к так называемым коровым гистонам (от англ. core – «сердцевина»). Эти гистоны формируют нуклеосому, представляющую собой октамерную белковую глобулу, вокруг которой происходит накручивание нити ДНК. Нам не удалось идентифицировать один коровый H2A и один линкерный Н5 гистон. Как и ожидалось, фракции гистонов были сконцентрированы в конце трека и расположены очень плотно (см. рис. 1, 2). Плотное расположение фракций обусловлено их низким молекулярным весом (11–15 kDa) и высоким положительным зарядом гистонов, богатых на лизиновые и аргининовые остатки [3]. Как уже упоминалось, четыре коровых гистона формируют сначала димерные – Н2А + Н2В, Н3 + Н4 структуры, которые сцеплены по два каждого вида, образуют октамерные белковые нуклеосомы. С внешней стороны нуклеосомы фиксируются внешними линкерными (англ. link – «связь») гистонами, формируя очень плотно упакованную структуру нити ДНК в хромосоме. В ядерных эритроцитах низших позвоночных рыб, амфибий, рептилий и птиц был обнаружен гистон Н5 с мол. массой в 23 kDa, который по своим свойствам оказался очень похожим на гистон Н1, найденный в тканях других организмов [8, 9].
Гистоны в отношении их межвидовых модификаций относятся к очень консервативным белкам. Наибольшее количество вариантов имеют гистон Н5 и его аналог — гистон Н1. В процессе эволюции структура коровых гистонов оказалась значительно консервативнее и стабильнее. Причем структура гистонов Н3 и Н4 оказалась более консервативной, чем структура гистонов Н2А и Н2В [10, 11]. Наши исследования показали также наличие консервативных гистонов. У ската было обнаружено 2 гистона Н3, а у ставриды отмечено наличие 2 гистонов Н4. Менее консервативные гистоны Н2В также были найдены у исследованных видов рыб.
При идентификации гистонов в различных тканях рыб важным является физиологическое состояние животного. Как показали исследования Пэниима и соавторов [11], в зависимости от состояния здоровья буффало рыб (Letiobus bubalus) сильно изменялся состав гистонов, выделенных из различных тканей. Так, пептидные профили электрофореграмм гистонов, выделенных из ядер эритроцитов здоровых рыб, сильно отличались от профилей гистонов, выделенных из эритроцитов больных рыб. Одни фракции деградировали и исчезали, при этом одновременно идентифицировались новые фракции. Степень наблюдаемых отличий зависела от ткани, из которой выделялись белки. Так, менее всего изменений на стрессовое состояние рыб отмечено в профилях гистонов печени. Гистоны ядерных эритроцитов занимали промежуточное положение, а гистоны почек и селезенки острее всего реагировали на состояние рыбы.
Как видно из таблицы, ядерные препараты содержали примеси митохондриальных белков (скат), а также белки рибосомального аппарата и WD 40 белок (ставрида). Митохондриальные и рибосомальные белки являются частью энергетического и биосинтетического аппарата ядерных эритроцитов рыб. WD 40 белок является повторяющимся белком (repeat protein), аналогичным ядерному белку человека WDR5 [12]. Этот белок может связываться с гистоном Н3, метилированным по лизину 4, и поэтому способен принимать участие в механизмах генной экспрессии.
Таким образом, проведенные исследования показали, что гистоны, идентифицированные в ядрах эритроцитов хрящевых и костистых рыб, имеют аналогичные характеристики в сравнении с гистонами других тканей. Обладая малым молекулярным весом, эти белки быстрее других движутся в электрическом поле, создавая очень похожие пептидные профили в гелевых треках у всех представителей царства эукариот. Необходимые для структурной организации хроматина гистоны относятся к одним из консервативных в отношении изменений в эволюции белков. Эта консервативность обусловлена единым принципом «упаковки» молекул ДНК, сформированным на ранних стадиях эволюции и универсальным для всех содержащих ядро клеток.



