Проблема послеоперационных осложнений является одной из центральных и наиболее сложных в абдоминальной хирургии [1, 12]. Возросло число больных с осложненным течением острого аппендицита, патологией панкреато-гепато-билиарной зоны, перфоративной язвы желудка и 12-перстной кишки, кишечной непроходимости [3]. Анализ структуры летальных осложнений у больных с гнойными хирургическими заболеваниями после выполнения неотложных оперативных вмешательств указывает на то, что основной причиной смерти у этих больных был и остается перитонит [1, 3].
По современным представлениям распространенный гнойный перитонит характеризуется как системная воспалительная реакция организма (SIRS) в ответ на развитие гнойно-некротического процесса в органах брюшной полости, клинически проявляющийся эндотоксикозом и полиорганной недостаточностью (ПОН) [3, 12].
Кроме воспалённой брюшины, важную роль в развитии интоксикации при перитоните играет дисфункция кишечника. Доказано, что дисфункция кишечника играет значительную роль и в патогенезе, и в прогнозе эволюции как самого перитонита, так и его интраабдоминальных и дистантных (внебрюшинных) осложнений [12].
Стертость клинических данных, атипичность течения послеоперационного периода, несоответствие лабораторных показателей тяжести патологического процесса, замедленная реакция общих и местных проявлений послеоперационного перитонита приводят к несвоевременной диагностике и запоздалой релапаротомии [1]. При этом отсутствие ярких маркеров доклинической фазы перитонита, надежных лабораторных методов ранней и своевременной диагностики осложненного течения острого аппендицита, его перехода из катаральной формы во флегмонозно-гангренозную затрудняют выбор врачебной тактики [5].
По данным многих авторов лейкоцитоз, СОЭ, данные УЗИ не являются надежными тестами для оценки прогрессирования воспалительного процесса в брюшине [3, 12]. В этой связи в хирургической практике интенсивно исследуется диагностическая роль белков острой фазы (БОФ), играющих важную и разностороннюю роль в патогенетических механизмах системной воспалительной реакции [4, 5, 6, 12].
В последнее время у абдоминальных хирургов появился интерес к тканевому белку ферритину, который некоторые авторы [6, 10] причисляют к БОФ. В клинической практике сывороточный ферритин (СФ) применяется для оценки запасов железа в организме, дифференциальной диагностики железодефицитной анемии, а также как неспецифический онкомаркер для мониторинга лечении опухолевых заболеваний [5, 6, 10]. Повышение уровня СФ в крови наблюдается при целом ряде заболеваний, сопровождающих воспалительно-деструктивными, некротическими процессами и малигнизацией, а понижение − при анемиях различного генеза [6, 10]. Показана роль этого белка в функционировании антиоксидантной системы организма [6]. Доказана связь СФ с процессами тканевой деструкции, сопутствующим распространенным формам перитонита [5, 6, 8].
Интерес у абдоминальных хирургов к изучению при перитонитах другого острофазового белка альбумина («негативного» БОФ) объясняется главной функцией этого белка – способностью связывать и транспортировать различные низкомолекулярные вещества, в том числе экзо- и эндотоксины различной природы [5, 6, 8]. Благодаря этой способности тест на альбумин вызывает интерес в качестве интегрального индикатора эндогенной интоксикации [4, 8, 11].
Для крупных клиник разработан флюоресцентный метод оценки связывающей способности альбумина [4]. Связывающая способность альбумина (ССА) определяется как отношение эффективной концентрации альбумина (ЭКА) к его общей концентрации (ОКА), что соответствует отношению свободных связей пула молекул альбумина к общему количеству его связей [4].
Существует другой, более доступный способ оценки степени выраженности эндогенной интоксикации [8] путем определения доли термостабильной фракции альбумина (ТФА) в его общей концентрации (ОКА).
Цель исследования: определить диагностическую значимость тестов на ТФА и СФ у больных с аппендикулярным перитонитом в динамике лечения.
Материалы и методы исследования
Исследования проведены в хирургических и реанимационных отделениях ГБУЗ АО «Областная детская клиническая больница имени Н.Н. Силищевой» и ГБУЗ АО «Городская клиническая больница № 3» г. Астрахани на 130 больных аппендикулярным перитонитом, в возрасте от 13 до 50 лет. С флегмонозным аппендицитом – 21 больной, гангренозным аппендицитом – 64, гангренозно-перфоративным аппендицитом – 45. Причиной перитонита у всех больных явились деструктивные формы острого аппендицита. Летальных исходов за время исследования не было. Диагноз подтвержден данными клинического осмотра, рентгенографического, ультразвукового исследования, лапароскопического вмешательства, результатами, полученными во время операции, данными лабораторных исследований.
Все 130 пациентов аппендикулярным перитонитом ретроспективно были разделены на 3 группы по степени распространенности воспалительного процесса в брюшной полости в соответствии с классификацией Гостищева В.К. [3]. Согласно этой классификации у 88 больных диагностирован местный перитонит, из которых 27 (20,8 %) больных вошли в первую группу с отграниченной формой перитонита и 61 пациент (46,9 %) составили вторую группу с неотграниченным аппендикулярным перитонитом. Третья группа состояла из 42 (32,3 %) пациентов, имевших распространенный перитонит. Распределение пациентов по возрасту и полу представлено в таблице 1.
Забор крови проводили до операции и на 1, 2, 3–4, 7–12 сутки после операции у больных аппендикулярным перитонитом. В качестве контроля использовалась сыворотка крови и общий анализ крови 30 доноров. Всего было проанализировано 587 образцов крови.
Общий анализ крови выполнен на гематологическом анализаторе «ADVIA 60» (Bayer, Германия) в объеме 18 параметров. В сыворотке крови определяли концентрацию общего белка и альбумина на биохимическом анализаторе «Ilab 300 plus» («Laboratories Instrumentation», США) с использованием реактивов этой же фирмы, а концентрацию СФ − иммуноферментным анализом с помощью наборов «ИФА-ферритин» («Алкор Био», СПб.).
Таблица 1
Распределение больных аппендикулярным перитонитом в зависимости от возраста и пола
|
Форма перитонита |
Возраст (лет) |
Пол |
||||
|
13-18 |
18-30 |
31-40 |
41-50 |
М |
Ж |
|
|
Отграниченный (n = 27) |
10 |
8 |
4 |
5 |
13 |
14 |
|
Неотграниченный (n = 61) |
21 |
15 |
12 |
13 |
33 |
28 |
|
Распространенный (n = 42) |
15 |
8 |
7 |
12 |
20 |
22 |
|
Всего: n = 130 |
46 |
31 |
23 |
30 |
66 |
64 |
Для оценки степени эндотоксикоза у пациентов с аппендикулярным перитонитом использовали три показателя: лейкоцитарный индекс интоксикации (ЛИИ), уровень молекул средней молекулярной массы (МСМ) и снижение связывающей способности альбумина.
ЛИИ по формуле Кальф – Калифа [7] требует окрашенного мазка и ручного подсчета под микроскопом субпопуляций лейкоцитов (миелоциты, плазматические клетки Тюрка), поэтому в данном исследовании использовали вариант формулы ЛИИ [9], адаптированный для автоматической обработки показаний гематологического анализатора:
![]()
Накопление токсичных лигандов оценивали по содержанию в сыворотке крови МСМ по Габриелян на спектрофотометре СФ-46 при длине волны 254 нм [2], а степень связывания эндотоксинов альбумином с помощью иммунохимического теста на альбумин человека, измеряя отношение концентрации термостабильной фракции сывороточного альбумина (ТФА) в % к общей концентрации альбумина (ОКА) [8].
Результаты обработаны при помощи пакета программ Statistica 6.0 Microsoft и Office Excell 2003. Статистическую обработку данных проводили методом вариационной статистики с применением t-критерия Стъюдента. Для признаков, имеющих нормальное распределение, вычисляли среднее арифметическое: М ± одно среднее стандартное отклонение (σ). Различия между выборками считались статистически достоверными при значении р < 0,05.
Результаты исследований
У 27 больных отграниченным перитонитом перед операцией выявлены клинические признаки эндогенной интоксикации I степени тяжести, подтвержденные данными измерения МСМ и вычисления ЛИИ. У 61 пациента с неотграниченным перитонитом клинические признаки, а также МСМ и ЛИИ указывали на эндотоксикоз II степени тяжести, и у 42 больных распространенным перитонитом имелись клинические и лабораторные признаки эндотоксикоза III степени.
В 1 сутки после операции у больных с местными формами аппендикулярного перитонита показатели ЛИИ выросли, МСМ снизились и соответствовали эндогенной интоксикации II степени, а у пациентов с распространенной формой перитонита они сохранялись на уровне эндотоксикоза III степени (таблица 2). При благоприятном течении заболевания на вторые сутки болезни значения МСМ и ЛИИ продолжали снижаться, указывая у больных отграниченным перитонитом на сохраняющийся эндотоксикоз I степени; и на снижение интоксикации у больных неотграниченным и распространенным перитонитом до II степени (таблица 2).
Таблица 2
Взаимосвязь формы перитонита со степенью интоксикации по признакам системной воспалительной реакции (SIRS), лейкоцитарному индексу (ЛИИ) и уровню молекул средней массы (МСМ)
|
До операции |
1-е сутки после операции |
2-е сутки |
|||||
|
Форма перитонита |
Степень интоксикации по |
Степень интоксикации по |
|||||
|
SIRS |
ЛИИ |
МСМ254 |
SIRS |
ЛИИ |
МСМ254 |
SIRS |
|
|
Отграниченный |
ЭИ I ст |
2,3±0,33* |
0,38±0,09 |
ЭИ II ст |
3,9±0,56* |
0,50±0,07* |
ЭИ I ст |
|
Неотграниченный |
ЭИ II ст |
4,1±0,28* |
0,45±0,05* |
ЭИ II ст |
4,7±0,33* |
0,53±0,09* |
ЭИ II ст |
|
Распространенный |
ЭИ III ст |
6,6±0,48* |
0,90±0,10* |
ЭИ III ст |
6,9±0,75* |
0,79±0,12* |
ЭИ II ст |
|
Контроль (доноры) |
отсутствие |
1,0±0,17 |
0,23±0,04 |
||||
Примечание:
* – достоверные значения по сравнению с контролем (p<0,01).
Анализ нового иммунохимического показателя ТФА выявил, что он перед операцией был достоверно (р<0,01) выше контрольных значений при неотграниченной и распространенной форме перитонита. В первые сутки после операции в отличие от ЛИИ ТФА (г/л) и ТФА (%) у всех исследуемых больных имел тенденцию к незначительному снижению, однако был достоверно (р<0,05) выше соответствующих значений ТФА в контрольной группе. Начиная со вторых суток уровень ТФА начинает постепенно снижаться, оставаясь достоверно (р<0,05) выше контрольных величин у всех больных. Уровень ТФА при распространенном перитоните также снизилcя, но его значения продолжали указывать на наличие у этих больных эндотоксикоза II степени (таблица 3). Сопоставляя значения ТФА с другими индикаторами эндотоксикоза, мы определили референтные интервалы ТФА для каждой степени эндогенной интоксикации.
Уровень СФ у больных с местными формами перитонита до операции достоверно не отличался от контрольных значений и был достоверно выше у больных с распространенной формой перитонита (р<0,05). Хирургический разрез сопровождается травмой тканей и сосудов с выбросом в кровь сывороточного ферритина (СФ). Уровень СФ после операции достоверно (р<0,05) выше его значений перед операцией во всех изучаемых группах. Максимальные уровни СФ в крови наблюдаются через 24–48 часов после операции. При гладком течении послеоперационного периода, начиная с третьих суток, концентрация СФ в крови неуклонно снижается. Динамика изменения уровней СФ при различных формах перитонита однотипная, с пиком на 2-й день после операции (рисунок) и отличается от динамики остальных изученных маркеров эндотоксикоза.
Таблица 3
Содержание ферритина, альбумина, его термостабильной фракции и маркеров эндотоксикоза в крови у больных распространенным аппендикулярным перитонитом при благоприятном течении заболевания
|
Показатели |
Контрольная группа (n=30) |
Дооперац. период (n=42) |
Послеоперационный период (n=42) |
|||
|
1 сутки |
2 сутки |
3-4 сутки |
7- 12 сутки |
|||
|
Альбумин (ОКА), г/л |
38,0±1,48 |
30,1±0,84* |
27,4±1,94* |
32,7±1,08* |
33,6±0,94* |
34,0±1,61 |
|
Термост. фр-я альбумина (ТФА), г/л |
2,0±0,24 |
3,7±0,42* |
3,0±0,33* |
3,2±0,28* |
3,1±0,35* |
2,7±0,29 |
|
Отношение ТФА/ОКА (%) |
5,2±0,62 |
12,5±2,59* |
11,1±2,13* |
9,9±1,63* |
9,2±0,91* |
8,0±1,08* |
|
Сывороточный ферритин (СФ), нг/мл |
115±20,5 |
247±51,3* |
318±58,8* |
363±78,5* |
286±60,0* |
179±43,6 |
|
ЛИИ, (Ед) |
1,0±0,17 |
6,6±0,48* |
6,9±0,75* |
4,1±0,83* |
3,1±0,61* |
2,4±0,34* |
|
МСМ254, опт/ед |
0,23±0,04 |
0,90±0,10* |
0,79±0,12* |
0,43±0,09* |
0,37±0,05* |
0,39±0,08 |
Примечание:
* – достоверные значения по сравнению с контролем (p<0,05).
При подтвержденном клинически парезе кишечника у больных аппендикулярным перитонитом обнаружены серьезные расстройства белкового баланса крови, выразившиеся в диспротеинемии, гиперферритинемии, гипоальбуминемии с увеличением термостабильной фракции альбумина (прежде всего ТФА %). Эти нарушения нарастали, в зависимости от стадии пареза кишечника, и при третьей степени пареза кишечника ТФА достоверно (р<0,05) превышала аналогичный показатель в контрольной группе в 2,31±0,4 раза. Уровень сывороточного ферритина (СФ) был также значительно повышен.
Показатель ТФА % крови во время образования оментита повысился до 2,2 раза. Концентрация СФ крови в этот момент превышала показатели СФ крови в контрольной группе в 2,5–3 раза. У 5 пациентов при образовании инфильтрата брюшной полости уровень ТФА крови перед операцией достигал 4,66±0,1 %. Концентрация СФ крови в этот момент у больных повысилась по сравнению с контрольной группой в 4,5 раза. Данный показатель ТФА у больных с инфильтратом брюшной полости соответствовал эндотоксикозу средней степени.
Таким образом, проведя анализ зависимости показателей ТФА (г/л) и ТФА (%) от наличия и степени интоксикации, мы выяснили, что эти маркеры интоксикации достаточно точно диагностируют наличие у больного эндотоксикоза.
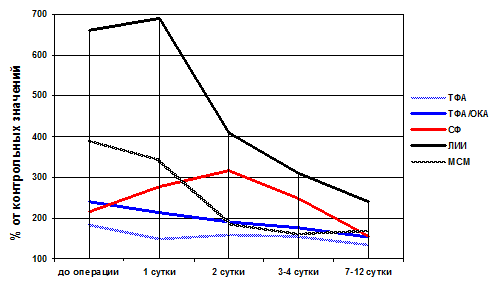
Динамика изменения уровней маркеров эндотоксикоза в крови у пациентов с благоприятным течением разлитого аппендикулярного перитонита
Заключение
Исследован уровень сывороточного ферритина (СФ) и термостабильной фракции альбумина (ТФА) в сыворотке крови у 130 больных аппендикулярным перитонитом в динамике лечения. В первые дни после оперативного лечения сывороточные уровни этих белков отражают степень эндотоксикоза так же достоверно, как стандартные показатели эндотоксикоза (ЛИИ и МСМ).
Концентрация ТФА в сыворотке крови начинает снижаться в ближайшие часы после санации брюшной полости при перитоните. Наоборот, максимальный пик выброса в кровь СФ (в 2,7 раза и более) наблюдается на 2-й день после операции. Мониторинговое изучение концентрации ТФА и СФ в послеоперационном периоде является информативным методом исследования, повышающим качество диагностики эндотоксикоза в экстренной абдоминальной хирургии.
Определены референтные интервалы ТФА для каждой степени эндогенной интоксикации, что позволяет проводить исследование ТФА для диагностики степени эндотоксикоза у пациентов с острой абдоминальной патологией.
Показатель ТФА/ОКА, в отличие от других маркеров эндотоксикоза, имеет преимущество, так как не зависит от степени кровопотери, гипоальбуминемии или характера инфузионной терапии и сопутствующей ей гемодилюции, существенно различавшейся у хирургических больных с абдоминальной патологией.



