Проблема бесплодного брака приобретает все большую социальную и медицинскую значимость. Нарушение оплодотворяющей способности мужчин оказывается причиной бесплодного брака в 40–50 % наблюдений, и нередко причиной являются иммунологически обусловленные механизмы бесплодия. Ряд новых проблем потребовал решения в рамках совершенствования процедуры экстракорпорального оплодотворения (ЭКО), которая стала эффективным, а зачастую единственным методом медицинской помощи при бесплодии.
В последние годы наметился ощутимый прогресс в идентификации и характеристике распознающих молекул на прозрачной оболочке яйцеклетки и плазматической мембране сперматозоида, которые ответственны за взаимодействие гамет при оплодотворении – многоэтапном процессе, в котором каждый этап зависит от предыдущего и управляется дискретным и определенным набором взаимодействий лиганда и рецептора. Внеклеточная среда играет ключевую роль в регулирование функциональных изменений сперматозоида. Перестройка цитоплазматической мембраны сперматозоида должна происходить в пределах женского репродуктивного тракта для того, чтобы сперматозоид обрел способность к акросомальному экзоцитозу и последующему оплодотворению. Не менее важен процесс эякуляции – именно в семенной плазме сперматозоид связывается с факторами, препятствующими преждевременному обретению сперматозоидом фертильной способности и оптимизирующими сроки капацитации в женских половых путях. Нативные сперматозоиды, полученные непосредственно из придатка семенника, не способны оплодотворить ооциты без интрацитоплазматической инъекции сперматозоида в цитоплазму ооцита (технология ICSI).
Ранее показано, что ряд компонентов семенной плазмы, в том числе компоненты каскада комплемента и связанные с ними белки играют существенную роль в оплодотворении. Эта гипотеза была выдвинута на основе данных, согласно которым CReg расположены на внутренней акросомальной мембране и поэтому скрыты в головке сперматозоида. Роль этих регуляторов неясна, поскольку их местоположение не является соответствующим для защиты плазматической мембраны от атаки компонентов комплемента и они экспрессируются только при встрече сперматозоида с яйцеклеткой и во время акросомальной реакции. Так, С3 компонент комплемента непосредственно вовлечен во взаимодействие мужской и женской гамет: сперматозоиды после акросомальной реакции экспрессируют С3-связанный мембранный кофакторный белок (МСР, CD46), поврежденные или мертвые сперматозоиды активируют альтернативный путь комплемента и связывают продукты расщепления С3, при этом CD46 является частью «моста» между рецепторами сперматозоида и ооцита, связывая С3b на поверхности мужской и женской гамет [1,2].
Цитокины также участвуют в многочисленных физиологических и патологических процессах, ведущих к мужскому бесплодию, особенно в инициировании воспалительных реакций. При этом уровень отдельных цитокинов в семенной жидкости значительно превышает аналогичные сывороточные концентрации, что подтверждает важную роль цитокинов в регуляции мужской фертильности [6,7]. Помимо участия в местных защитных реакциях, они могут играть существенную роль в модуляции действия половых гормонов и быть вовлечены в паракринное регулирование сперматогенеза [3,10]. Также цитокины могут отрицательно воздействовать на свойства мембраны сперматозоида. Зависимость качества спермы от концентрации цитокинов по данным литературы спорно. В ряде исследований было показано, что высокие концентрации некоторых цитокинов и фактор некроза опухоли оказывают значительное влияние на подвижность сперматозоидов. Так, например, IL-6 обеспечивает быстрое увеличение числа сперматогониев и дифференцировку зародышевых клеток и клеток Сертоли [5].
Однако полученные экспериментально-клинические данные в целом носят разрозненный характер и пока не способны предложить решение вопросов, актуальных для клинической практики. В связи с этим целью работы была оценка влияния иммунохимических показателей семенной плазмы на качество оплодотворения ооцитов в программе ЭКО и переноса эмбрионов.
Материалы и методы исследования
В качестве материала использовался эякулят мужчин, проходивших лечение во поводу бесплодия. В исследование вошли мужчины с диагнозом нормоспермия (концентрация сперматозоидов более 1,5*107 в 1 мл, процент сперматозоидов с поступательным движением более 32 %, процент морфологически нормальных форм сперматозоидов – более 4 % согласно рекомендациям ВОЗ от 2010 г. Эякулят собирали в стерильные пластиковые контейнеры. Всеми пациентами соблюдалась следующая подготовка, включавшая 3 дня полового воздержания, исключение за 10 дней до исследования алкоголя, курения и тепловых воздействий (баня, горячие ванны), а также в исследование не включались пациенты, имевшие эпизоды повышения температуры тела выше 37,3 °С в течение 30 дней перед исследованием.
Часть эякулята центрифугировали в течение 20 мин при 200g для отделения сперматозоидов от семенной плазмы. Полученный надосадок замораживали в стерильных криовиалах (Nunc, США) в жидком азоте до тестирования на уровни цитокинов. Осадок сперматозоидов разбавляли в 2 раза средой IVF Medium (MediCult, США) и центрифугировали в течение 20 мин при 200g. Надосадочную жидкость удаляли, осадок пипетировали, на него наслаивали 1 мл той же среды, и образцы помещали в CO2-инкубатор на 1 ч для флотации при 37оС во влажной атмосфере с 5 % СО2. После этого надосадочную жидкость снимали и центрифугировали при тех же условиях. Полученный осадок разводили 50 мкл среды IVF Medium, и материал использовали для оплодотворения ооцитов в программе ЭКО. Через 24 ч оценивали процент оплодотворенных ооцитов.
Все пациенты были разделены на две группы по результатам ЭКО (процент оплодотворенных ооцитов): Группа 1: Пациенты с нормальным и высоким процентом оплодотворения (более 50%), всего 77 пациентов; Группа 2: Пациенты с низким процентом или отсутствием оплодотворения (менее 50%), всего 57 пациентов.
Уровни IL-6, IL-1β, C3, IL-8 и антимюллеровского гормона (АМГ) в семенной плазме определяли методом иммуноферментного анализа с использованием наборов OOO “Цитокин” (Санкт-Петербург). Полученные результаты обрабатывали при помощи непараметрического критерия W Уайта и с использованием корреляционного анализа. Достоверными считали различия при p<0,05.
Результаты исследования и их обсуждение
По результатам ИФА было установлено, что уровень IL-8 в группе 1 варьировал в пределах от 156 до 1170 пг/мл (рисунок). При этом среднее значение концентрации IL-8 по группе составило 361 пг/мл. Параллельно в группе 2 этот показатель варьировал в пределах от 0 до 480 пг/мл при среднем значении 427 пг/мл. Уровень С3 в семенной плазме пациентов из группы 1 варьировал в пределах от 20 до 7756 нг/мл. При этом среднее значение концентрации С3 по группе составило 3750 нг/мл. Одновременно с этим в группе 2 показатель варьировал в пределах от 0 до 2168 нг/мл при среднем значении 782 нг/мл. Уровень IL-6 в группе 1 варьировал в пределах от 50 до 684 пг/мл. При этом среднее значение концентрации IL-6 по группе составило 271 пг/мл. В группе 2 этот показатель варьировал в пределах от 0 до 400 пг/мл при среднем значении 185 пг/мл. Наконец, уровень IL-1β в группе 1 варьировал в пределах от 50 до 286 пг/мл. При этом среднее значение концентрации IL – 1β по группе составило 169 пг/мл, а в группе 2 этот показатель варьировал в пределах от 0 до 356 пг/мл при среднем значении 171 пг/мл. Уровень АМГ в семенной плазме варьировал в группе 1 в пределах от 87 до 15934 пг/мл. При этом среднее значение концентрации АМГ по группе составило 712 пг/мл. Одновременно в группе 2 этот показатель варьировал в пределах от 0 до 5954 пг/мл при среднем значении 902 пг/мл (рисунок).
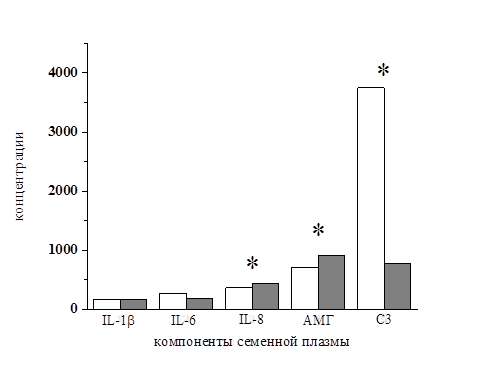
Концентрации ряда компонентов семенной плазмы у пациентов исследуемых групп по результатам иммуноферментного анализа
По оси абсцисс: компоненты семенной плазмы; по оси ординат: концентрации, для всех – пг/мл, для С3 – нг/мл. Белые столбики – группа 1, серые столбики – группа 2. * – различия между группами достоверны по критерию W Уайта.
Обработка полученных результатов с использованием критерия W Уайта показала, что между группами пациентов с высоким и низким процентом оплодотворения существуют достоверные различия по концентрациям АМГ, IL-8 и С3 компонента комплемента в семенной плазме и не существует различий по распределению концентраций IL-1b и IL-6, поэтому последние два цитокина были исключены из дальнейшего анализа. Однако приведенные результаты не указывают на значимость того или иного показателя для эффективности оплодотворения. Для оценки зависимости качества оплодотворения от уровней факторов, по которым установлены достоверные различия между группами, был проведен корреляционный анализ, в ходе которого анализировали соотношения между уровнем оплодотворения у конкретного пациента и концентрациями диагностически значимых цитокинов (АМГ, IL-8 и С3). Согласно критерию W Уайта, в группе 1 не наблюдалось достоверной зависимости качества оплодотворения от концентраций АМГ, IL-8 и С3. Напротив, в группе 2 была выявлена достоверная обратная корреляционная зависимость процента оплодотворения от концентрации С3 в семенной плазме (таблица).
Значения коэффициентов корреляции r между индивидуальными уровнями факторов семенной плазмы и способностью сперматозоидов к оплодотворению
|
Группы |
Значения r |
АМГ |
IL-8 |
C3 |
|
Группа 1 |
r |
– 0,33±0,24 |
0,163±0,247 |
– 0,15±0,25 |
|
p |
>0,05 |
>0,05 |
>0,05 |
|
|
Группа 2 |
r |
– 0,44±0,40 |
– 0,32±0,42 |
– 0,70±0,36 |
|
p |
>0,05 |
>0,05 |
<0,05 |
Полученные результаты дают важные сведения о роли иммуноцитокинов, АМГ и С3 компонента комплемента в патогенезе мужского бесплодия. Поскольку к исследованию привлекались пациенты с верифицированным отсутствием острого или хронического воспаления (в том числе в органах мужской половой системы), получает свое объяснение факт отсутствия достоверных различий по концентрации IL-1b и IL-6 в семенной плазме между пациентами группы 1 с нормальным способностью сперматозоидов к оплодотворению и группы 2 с пониженной способностью сперматозоидов к оплодотворению. Приведенные на рисунке результаты свидетельствуют о достоверно более низких концентрациях IL-8 и АМГ и достоверно более высокой концентрации С3 в семенной плазме пациентов группы 1, характеризующейся нормальной или высокой способностью половых клеток к оплодотворению. Характер влияния АМГ на сперматозоиды до настоящего времени остается не вполне понятным. В условиях in vitro он повышает выживаемость сперматозоидов при криоконсервации и после неё [9]. Тем не менее при обследовании пациентов найдена обратная корреляция между уровнем АМГ, с одной стороны, и подвижностью и способностью сперматозоидов к оплодотворению, с другой, что позволило авторам сделать вывод о ингибирующей функции АМГ в отношении миграционной функции сперматозоидов [4]. Это полностью подтверждается результатами, приведенными на рисунке и в таблице. При этом полученные в данной работе концентрации АМГ хорошо совпали с полученными ранее показателями для аналогичных групп пациентов [4].
IL-8 является главным хемокином нейтрофилов. Влияние IL-8 на процент прогрессивно подвижных форм и на наличие классической олигозооспермии спорно. Достаточно давно снижение качества спермы и ее фертильной способности связывают с инфекционными и воспалительными процессами, имеются данные об увеличении концентрации IL-8 в семенной плазме пациентов, страдающих воспалительными процессами половых желез [8]. Однако помимо существенной роли в воспалении инфекционного генеза, повышение уровня данного цитокина может быть связано с необходимостью привлечения нейтрофилов для элиминации погибших или аномальных сперматозоидов. Поэтому приведенные на рисунке данные о более низком уровне IL-8 у пациентов группы 1 получают логическое объяснение, а определение концентрации IL-8 в семенной плазме может предоставить дополнительную информацию о причинах воспаления и качественного ухудшения показателей спермограммы у пациентов с идиопатической формой бесплодия.
Что касается С3 компонента комплемента, то он непосредственно вовлечен во взаимодействие мужской и женской гамет: сперматозоиды после акросомальной реакции экспрессируют С3-связанный мембранный кофакторный белок (МСР, CD46), поврежденные или мертвые сперматозоиды активируют альтернативный путь активации комплемента и связывают С3 катаболиты, при этом CD46 является частью «моста» между рецепторами сперматозоида и ооцита, связывая С3b на поверхности мужской и женской гамет [1,2]. По результатам данного исследования роль С3 как участника процесса взаимодействия мембран мужской и женской гамет также хорошо просматривается у пациентов группы 1, что может рассматриваться как свидетельство его участия в процессе оплодотворения. Тем не менее корреляционный анализ не выявил достоверных связей между концентрациями АМГ, IL-8 и С3 и процентом оплодотворения у пациентов группы 1, отличавшейся нормальным уровнем оплодотворения (свыше 50 %). Другой возможной функцией С3 компонента комплемента в семенной плазме может быть его участие в опсонизации мертвых (апоптотических) клеток. В этом случае высокая концентрация С3 может рассматриваться как фактор элиминации нежизнеспособных сперматозоидов, что при одинаковой общей концентрации сперматозоидов между группами 1 и 2 приводит к увеличению полноценных клеток именно в материале пациентов группы 1 и лежит в основе более высокого процента оплодотворения. Косвенно это подтверждается и достоверной обратной корреляцией между уровнем С3 в семенной плазме и способностью к оплодотворению у пациентов группы 2, у которых недостаточность С3 компонента в семенной плазме приводит к накоплению в материале сперматозоидов с признаками апоптоза.
Таким образом, из результатов проведенного исследования следует, что определение АМГ, IL-8, С3 компонента комплемента целесообразно именно в комплексе, так как любой из этих факторов поодиночке не дает полного представления о характере происходящих процессов. При низком проценте оплодотворения (менее 50 %) весьма целесообразным представляется определение уровня С3 компонента в семенной плазме. Самостоятельной задачей может стать оценка уровня клеток на разных стадиях апоптоза у пациентов с мужским бесплодием.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (проект № 1326), гранта РФФИ №15-04-05093 и гранта ДВФУ №14-08-06-25_и.



