Проблема невынашивания беременности является актуальной и социально значимой. Причины невынашивания беременности многочисленны. Они могут быть вызваны генетическими (генные, геномные и хромосомные мутации, иммунологическая несовместимость) и негенетическими (заболевания матери, химические и физические воздействия) факторами [5]. Известно, что 10–15 % клинически диагностированных беременностей останавливаются в развитии на ранних этапах эмбриогенеза. Около 50 % случаев ранней остановки развития и внутриутробной гибели эмбриона обусловлено хромосомными аномалиями, такими как аутосомные трисомии, полиплоидия, моносомия Х хромосомы и несбалансированные структурные перестройки [5,9]. Большинство из этих отклонений являются спорадическими и возникают de novo. Генетический анализ тканей плода имеет большое значение для установления основной причины невынашивания беременности, выбора дальнейшей тактики обследования женщины, планирования и наблюдения последующих беременностей [4,8].
В настоящей работе для определения хромосомного статуса эмбриона при репродуктивных потерях использован метод метафазной сравнительной геномной гибридизации (comparative genomic hybridization – CGH), который также называют «молекулярным кариотипированием». Этот метод позволяет провести анализ всего генома в рамках одного исследования.
CGH-анализ основан на одновременной гибридизации опытной и контрольной (полученной от нормального индивидуума) ДНК, меченных двумя разными флюорохромами, на хромосомный препарат из культуры лимфоцитов здорового донора. Путем сравнения относительной интенсивности флюоресценции двух флюорохромов по всей длине каждой хромосомы выявляется геномный дисбаланс в виде дупликации или делеции [1,2]. Ограничением применения CGH для анализа тканей плода при репродуктивных потерях является неинформативность этого метода при кратном увеличении генома (триплоидия, тетроплодия). Чтобы преодолеть это ограничение и повысить эффективность анализа, в дополнение к CGH мы использовали интерфазную флуоресцентную in situ гибридизацию (FISH) с ДНК-зондами на центромерные районы хромосом 18, Х и Y в интерфазных ядрах для определения плоидности [3,9].Такой подход позволяет выявить практически все числовые и несбалансированные структурные хромосомные перестройки размером более 4 м.п.н., в том числе ассоциированные с репродуктивными потерями, а также избежать трудности, связанных с получением хромосомных препаратов для цитогенетического анализа.
Цель исследования
Оценка эффективности выявления и определение спектра ХА методами молекулярного кариотипирования.
Материалы и методы
Исследовано 146 образцов ткани хориона (плаценты), полученных после прерывания беременности. Показаниями для прерывания являлись: неразвивающаяся беременность (n=131), анэмбриония (n=8) и врожденные пороки у плода, ВПР (n=7) в сроке от 4 до 20 недель беременности. Средний возраст женщин составил 32,3±4.6 года.
Во всех случаях хорион был визуально оценен, тщательно отобран от материнских тканей и отмыт от примесей крови.
От каждого образца 5–10 мг ворсин хориона использовали для получения отпечатков ткани с последующей обработкой [6]. Из остального материала выделяли ДНК методом экстракции фенол-хлороформом для проведения сравнительной геномной гибридизации.
ДНК плода (опытная) и референсная ДНК (контрольная) мечены в реакции ник-трансляции SpectrumGreen dUTP и SpectrumRed dUTP (AbbottMolecular, США) по стандартному протоколу [2]. Платформой для совместной гибридизации опытной и референсной ДНК служили хромосомные препараты из культуры лимфоцитов периферической крови доноров – мужчин с нормальным кариотипом. Реакцию сравнительной геномной гибридизации и постгибридизационную отмывку проводили по протоколу фирмы производителя (AbbottMolecular, США). Для контрокрашивания хромосом использовали DAPI I (AbbottMolecular, США) в растворе Vectashield (VectorLabs, США) в соотношении 1:20.
Анализ изображений метафазных хромосом проводили на эпифлуоресцентном микроскопе «Eclipse90i» (Nikon, Япония), оборудованном CCD камерой «ProgResMF» (JENOPTIK) и программой обработки изображения «LuciaCGH» (Чехия). Для каждого образца анализировали 10–15 метафазных пластинок.
FISH анализ интерфазных ядер с ДНК зондами: SE2 (D2Z2), SE4 (D4Z1), SE10 (D10Z1), SE 15 (D15Z4), SE 16 (D16Z2), SE18 (D18Z1), SE 20 (D20Z1), SE (XY18), SE (X,Y), PN13 (13q14), PN 21 (21q22), Sub-Telomere5qter (D5S2006), Sub-Telomere 6qter (D6S2523), Sub-Telomere9pter (D9S917), Sub-Telomere9qter (D9S1838), Sub-Telomere11qter (D11S4437), Sub-Telomere20pter (D20S1156), Sub-Telomere 20qter (RH44234), Sub-Telomere22qter (D22S1056) (Kreatech, Нидерланды) проводили по протоколам фирмы – производителя. Анализ осуществляли на эпифлуоресцентном микроскопе «AxioImagerM.1» (CarlZeiss, Германия) c соответствующим набором светофильтров и с использованием компьютерной программы обработки цифровых изображений «Isis» (MetaSystems, Германия).
Результаты и обсуждение
Из всех образцов хориона получено достаточное для анализа количество ДНК, и проведена сравнительная геномная гибридизация.
При отсутствии хромосомного дисбаланса плоидность определяли при проведении FISH с ДНК зондами на центромерные районы хромосом 18, Х и Y. Все случаи обнаружения дисбаланса при CGH подтверждались с помощью интерфазной FISH с соответствующими локус-специфичными или центромерными зондами.
Из 146 наблюдений, хромосомный и геномный дисбаланс не обнаружен в 71 случае, что составило 48,6 %. Различные ХА выявлены в 75 случаях. Таким образом, частота ХА при невынашивании беременности составила 51,4 %. Спектр выявленной хромосомной патологии включал практически все типы ХА, приводящие к антенатальной гибели плода, кроме моносомии по аутосомам и тетраплоидии (табл. 1).
Среди 75 случаев хромосомной патологии в 58,7 % (44 образца) выявлена трисомия по аутосомам. Триплоидия определена в 22,7 % случаев (n=17), из них: в 9 случаях дигенического (ХХХ), а в 8 – диандрического (ХХY) происхождения. Моносомия Х диагностирована в 7 наблюдениях (9,3 % от всех ХА). Сочетанная хромосомная патология выявлена в 3 наблюдениях (4 % от всех ХА) и представлена двойной трисомией по хромосомам 9 и 16, моносомией Х в сочетании с трисомией по 22 хромосоме и моносомией Х с частичной трисомией 6q.
Геномный дисбаланс в виде делеции и/или дупликации терминальных районов хромосом диагностированы в 4 наблюдениях (5,3 %) при наличии ВПР у плода. В 2 случаях, при частичной трисомии по длинному плечу хромосомы 20 у плода и частичной трисомии по длинному плечу хромосомы 22/частичной моносомии по длинному плечу хромосомы 11 установлено, что причиной аномального фенотипа у плода являлся геномный дисбаланс вследствие патологической мейотической сегрегации хромосом при аутосомной реципрокной транслокации у родителя-носителя – 46,XY,t(16;20)(p13.3;q13.13) и 46,XX,t(11;22)(q23.3;q12.2), соответственно. Важно отметить, что в случае t(16;20)(p13.3;q13.13) при CGH не выявлена делеция района 16q13.3-qter из-за ограничения разрешающей способности метода, поскольку размер транслоцированного сегмента не превышает 4 млн.п.н. Тем не менее информация, полученная при исследовании абортного материала методом CGH, позволила установить сбалансированную транслокацию у отца, когда дериватная хромосома 16 обнаружена при таргетной FISH с ДНК-зондом на субтеломерный район длинного плеча хромосомы 20. В остальных двух случаях установить происхождение хромосомной аномалии у плода оказалось невозможным.
Таблица 1
Результаты использования методов метафазной CGH и FISH анализа для исследования материала неразвивающихся беременностей (n = 146)
|
Выявленная патология |
CGH |
FISH |
Кол-во случаев(%) |
|
Триплоидия |
ishcgh(1-22)×2 |
nucish(D18Z1×3) |
17 (22,7) |
|
Моносомия Х |
ishcgh(1-22)×2,(X)×1 |
nucish(DXZ1×1,DYZ3×0) |
7 (9,3) |
|
Трисомии аутосом: |
44 (58,7) |
||
|
+ 16 |
ishcghenh(16) |
nucish(D16Z2)×3 |
15 |
|
+22 |
ishcghenh(22) |
nucish(D22S1056)×3 |
8 |
|
+15 |
ishcghenh(15) |
nucish(D15Z4)×3 |
6 |
|
+21 |
ishcghenh(21) |
nucish(21q22)×3 |
4 |
|
+13 |
ishcghenh(13) |
nucish(13q14)×3 |
4 |
|
+4 |
ishcghenh(4) |
nucish(D4Z1)×3 |
2 |
|
+5 |
ishcghenh(5) |
nucish(D5S2006)×3 |
2 |
|
+2 |
ishcghenh(2) |
nucish(D2Z2)×3 |
1 |
|
+10 |
ishcghenh(10) |
nucish(D10Z1)×3 |
1 |
|
+18 |
ishcghenh(18) |
nucish(D18Z1)×3 |
1 |
|
Сочетанные хромосомные аномалии: |
3 (4) |
||
|
Двойная трисомия по хромосомам 9 и 16 |
ishcghenh(9), enh(16),(X)×2 |
nucish(D16Z2×3) nucish(D9S917×3) |
1 |
|
Моносомия Х и трисомия по хромосоме 22 |
ishcghenh(22),(X)×1 |
nucish(D22S1056×3), (DXZ1×1,DYZ3×0) |
1 |
|
Моносомия Х и частичная трисомия по хромосоме 6 |
ishcghenh(6)(q21qter),(X)×1 |
nucish(D6S2523х3), (DXZ1×1,DYZ3×0) |
1 |
|
Структурные перестройки хромосом: |
4 (5,3) |
||
|
Частичная трисомия по хромосоме 20 |
ishcghenh(20) (q13.13qter),(XY)×1 |
nucish (D20S1156×2,RH44234×3) |
2 |
|
Частичная трисомия по хромосоме 9 |
ishcghenh(9)(p11.2p24.3), (XY)×1 |
nucish (D9S917×3, D9S1838) |
1 |
|
Частичная трисомия по хромосоме 22, частичная моносомия по хромосоме 11 |
ishcghenh(22) (q13.1qter), dim(11) (q23.3qter),(XY×1) |
nucish (D11S4437x1, D22S1056×3) |
1 |
Трисомия по различным аутосомам являлась наиболее частой хромосомной патологией. Частота встречаемости различных трисомий колебалась в широких пределах (Рисунок 1).
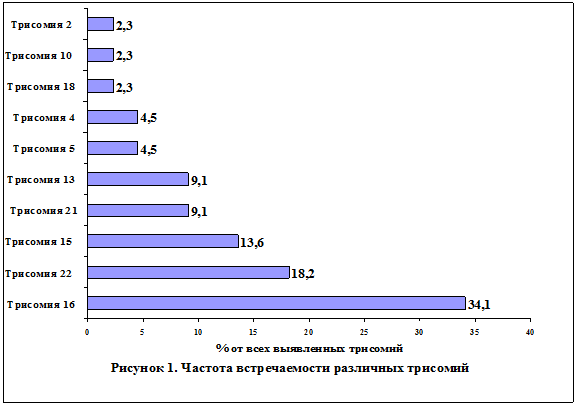
Среди 44 выявленных случаев трисомии наиболее часто встречались трисомия по хромосомам 16 (15 случаев – 34,1 %) и 22 (8 случаев – 18,2 %). Частота трисомии по хромосоме 15 составила 13,6 % (6 случаев). Трисомия по хромосомам 13 и 21 выявлена в 4 случаях (9,1 %) каждая. Кроме того, диагностированы по 2 случая трисомии хромосом 4 и 5 (4,5 % каждая), а также единичные случаи трисомии по хромосомам 2, 10 и 18.
Долгое время стандартное цитогенетическое кариотипирование являлось традиционным методом установления хромосомного статуса плода при репродуктивных потерях. Однако данный метод имеет ряд ограничений, обусловленных особенностями ткани, используемой для анализа. Так, вследствие сниженной пролиферативной и митотической активности клеток хориона при неразвивающейся беременности, не всегда возможно получить хромосомные препараты. По данным ряда авторов, до 20 % образцов ткани хориона оказываются недоступны для цитогенетического анализа [1,8,5,10]. Часто трудно добиться хорошей морфологии хромосом, для точной идентификации хромосомной патологии. Кроме того, возможно получение ложного результата из-за контаминации образца материнскими клетками [1,8,9]. Методы молекулярной цитогенетики дают возможность исследовать хромосомный набор клеток с исключением этапа их культивирования [1].
По данным многочисленных наблюдений, примерно 50 % репродуктивных потерь обусловлено аномалиями хромосомного набора эмбриона [1,5,8]. Использование метода метафазной CGH с последующим FISH анализом показало аналогичную частоту хромосомных нарушений в исследуемой выборке. При этом анализ проведен в 100 % случаев.
Показано, что трисомии по аутосомам составляют 59–68 % от всей выявляемой патологии хромосом у плода, полиплоидия – 15–19 %, моносомия Х – 8–14 %. Несбалансированные структурные перестройки хромосом выявлены в 4–8 % случаев ХА. Прочая хромосомная патология (двойные и тройные трисомии, мозаицизм, монсомии по аутосомам) составляет от 2 до 12 % от всех случаев ХА [5,9]. Полученные нами данные по спектру хромосомной патологии при невынашивании беременности совпадают с результатами других авторов и доказывают высокую эффективность комбинированного использования двух молекулярно-цитогенетических методов (CGH и FISH) для анализа причин невынашивания беременности.
Выявление при CGH геномного дисбаланса в виде делеции и/или дупликации отдельных районов хромосом свидетельствует о наличии структурной хромосомной аномалии у плода и является показанием для исследования кариотипов родителей с целью установления ее происхождения, что, в свою очередь, позволяет повысить эффективность медико-генетического консультирования семьи и определить тактику планирования, ведения последующих беременностей и меры профилактики хромосомной патологии.
Заключение
Метод сравнительной геномной гибридизации (CGH) в сочетании с FISH-анализом показал высокую эффективность для установления хромосомного статуса эмбриона, плода при репродуктивных потерях и может служить альтернативой цитогенетическому анализу для установления причин невынашивания беременности.



