- Нормальная микрофлора ротовой полости человека
Тело человека, включая кожные покровы, ротовую полость и желудочно-кишечный тракт, заселено огромным количеством микроорганизмов. Согласно современным данным, количество микроорганизмов, населяющих тело человека, в 10 раз превышает количество клеток организма человека, а суммарный микробиом содержит более 5 миллионов генов, что в десятки раз превышает геном человека [31; 43].
Установление и поддержание нормального гомеостаза между хозяином и его микрофлорой является важнейшим условием здоровья человека. Современные исследования указывают ключевую роль микробиоты человека в становлении его гомеостаза, отмечают влияние микробиоты на иммунную систему человека, его развитие и физиологию, включая органо- и морфогенез, а также метаболизм [37].
Нарушения состава и функционирования микрофлоры приводит к возникновению и развитию различных заболеваний. Установлено, что микроорганизмы, населяющие ротовую полость человека, могут вызывать различные инфекционные заболевания, включая кариес, периодонтиты, тонзиллиты и другие [8]. Современные данные также свидетельствуют, что микрофлора ротовой полости может являться причиной соматических заболеваний [36], таких как инфекционный эндокардит [4], заболевания сердечно-сосудистой системы [15], инсульт [16], диабет [12], пневмония [35].
Полость рта человека представлена множеством поверхностей. Суммарная площадь всех поверхностей ротовой полости составляет около 225 см2. Зубы, кератинизированные и некератинизированные мягкие ткани составляют 20, 30 и 50% этой площади соответственно [29]. Каждая из анатомических поверхностей ротовой полости покрыта конгломератом микроорганизмов - бактериальной биопленкой [2].
Микроорганизмы, населяющие ротовую полость человека, или микробиом ротовой полости, представляет собой уникальную обширную экосистему [42]. По данным культуральных и молекулярно-биологических методов исследования, в состав микробиома ротовой полости входят представители свыше 700 видов бактерий [2; 8; 33]. По результатам исследований других авторов, микробное сообщество ротовой полости представлено более чем 1000 видами (рисунок) [41; 42].
Для систематизации бактерий ротовой полости человека была создана Human Oral Microbiome Database (HOMD), которая включает как представителей нормальной микрофлоры, так и возбудителей заболеваний ротовой полости человека. В настоящий момент HOMD включает свыше 700 видов микроорганизмов, принадлежащих к 16 типам: Actinobacteria, Bacteroidetes, Chlamydiae, Chlorobi, Chloroflexi, Euryarchaeota, Firmicutes, Fusobacteria, Gracilibacteria, Proteobacteria, Spirochaetes, SR1, Synergistetes, Tenericutes, TM7 и WPS-2 [7]. Приблизительно 54% описаны и имеют видовое имя, 14% культивируются, но не описаны, 32% не культивируются [44].
Большинство из представленных видов бактерий являются транзиторной микрофлорой, так как они не способны к длительному выживанию в особых условиях среды ротовой полости.
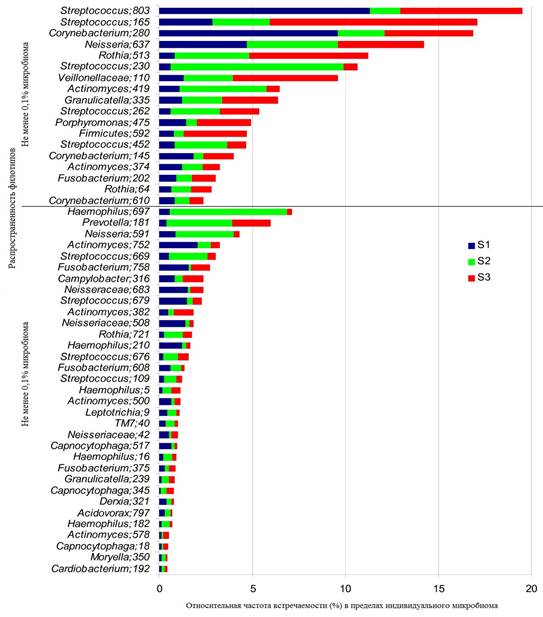
Частота встречаемости микробных филотипов в ротовой полости человека [42]
Несмотря на огромное внутри индивидуальное разнообразие в составе микрофлоры среди людей, выделяют 50-200 видов микроорганизмов, относящихся к 15 родам, которые встречаются практически у каждого человека. Cреди них выделяют микробы, колонизирующие поверхность зубов (над уровнем десны), включающие Actinomyces, Campylobacter, Capnocytophaga, Corynebacterium, Fusobacterium, Granulicatella, Neisseria, Prevotella, Streptococcus и Veillonella, а также анаэробные протелитические бактерии, обитающие ниже уровня десны, такие как Filifactor, Fusobacterium, Parvimonas , Porphyromonas, Prevotella, Tannerella, и Treponema. Облигатно анаэробные стрептококки, включающие S. mutans, S. mitis, S. sanguis и пептострептококки, составляют около половины резидентной микрофлоры ротовой полости человека [14].
Установлено, что бактерии демонстрируют специфический тропизм в отношении различных анатомических поверхностей ротовой полости [29]. Различные ткани и органы полости рта человека, такие как, например, зубы, десны, десневые борозды, слизистая языка, щек, твердого и мягкого неба, имеют выраженные отличия в составе микробных сообществ, их населяющих [8]. В своей работе Магер с коллегами на примере 40 бактериальных видов показали, что различные виды бактерий, населяющие многочисленные поверхности ротовой полости, используют различные рецепторы и молекулы адгезии, определяющие образование биопленки на этих поверхностях [29].
- Слюна как источник питательных веществ для микроорганизмов
Слюна человека - это сложная биологическая жидкость, вырабатываемая тремя парами крупных слюнных желёз и множеством мелких слюнных желёз. В среднем слюна на 99% состоит из воды, с растворенными в ней органическими и неорганическими ионами, а также содержит пептиды, протеины и гликопротеины [3; 14]. Главными катионами в составе слюны являются калий и натрий, тогда как ионы кальция, магния и аммония присутствуют в более низких концентрациях. Среди анионов, присутствующих в слюне, фосфаты и хлориды достаточно распространены, в то время как сульфаты, нитраты и нитриты представлены в довольно низких концентрациях. Органические анионы, обнаруживающиеся в смешанной слюне, такие как, например, лактат, ацетат, формиат и пропионат, чаще всего являются конечными продуктами метаболизма бактерий, населяющих ротовую полость человека [6].
Смешанная слюна также содержит в своем составе такие дополнительные компоненты, как слущенные эпителиальные клетки, жидкость десневой борозды и микроорганизмы, населяющие ротовую полость.
Состав слюны, и следовательно наличие питательных веществ для бактерий ротовой полости, имеет большие межиндивидуальные различия и временную вариабельность [14].
- Метаболизм бактерий ротовой полости
Слюна, содержащая гликопротеины, такие как муцин, пептиды и аминокислоты, является основным источником питательных веществ для бактерий, обитающих в наддесневых бляшках. Гликозидазы организма человека, а также бактериальных клеток отщепляют углеводные части от молекул гликопротеинов, а протеазы участвуют в расщеплении протеинов на протеиды и аминокислоты. В результате метаболизма сахаролитических бактерий, относящихся к Streptococcus, Actinomyces и Lactobacillus, обитающих в наддесневых зубных бляшках, происходит образование кислот из сахаров, а также расщепление аминокислот с образованием кислот и аммония. Таким образом, продукция кислых и основных молекул в сочетании с непрерывным током слюны, позволяет поддерживать практически нейтральную pH среды в наддесневом пространстве ротовой полости. При поступлении углеводов с пищей стрептококки, актиномицеты и лактобациллы производят избыточное количество кислот, которые являются причиной деминерализации зубной эмали, что в свою очередь может привести к возникновению и развитию кариеса [38].
Жидкость десневой борозды, содержащая в своем составе гликопротеины, протеины, пептиды и аминокислоты, а также десквамированный эпителий, является основным источником питательных веществ для бактерий, обитающих в поддесневых зубных бляшках. Протеолитические бактерии, обитающие ниже уровня десны (Fusobacterium, Prevotella и Porphyromonas), расщепляют азотсодержащие соединения на короткоцепочечные жирные кислоты, аммоний, серосодержащие компоненты, индол или скатол. Продукция кислот и оснований в сочетании с непрерывным током десневой жидкости обеспечивает поддержание практически нейтральной/слабощелочной среды. Короткоцепочечные жирные кислоты, аммоний и серосодержащие соединения обладают цитотоксическим эффектом и могут вызывать воспаление тканей, приводя тем самым к развитию пародонтозов [38].
3.1. Метаболизм углеводов
Гидролиз полисахаридов, олигосахаридов, дисахаридов и моносахаридов может осуществляться с помощью гликозидаз организма человека, а также бактериальных клеток. Так, например, гидролитический фермент человека a-амилаза разлагает крахмал до карбогидратов, которые затем участвуют в метаболизме бактерий ротовой полости.
Бактерии ротовой полости используют два типа транспортных систем: фосфоенолпируват-зависимую систему фосфотрансфераз сахаров (PEP-PTS) и протеин-зависимую транспортную систему (BPTS). Сахара, транспортируемые PEP-PTS, фосфорилируются при участии метаболита, образующегося в ходе гликолиза - фосфоенолпирувата. Сахара, транспорт которых осуществляется протеин-зависимой транспортной системой, подвергаются фосфорилированию внутриклеточными киназами [39].
Бактерии ротовой полости способны ферментировать большинство углеводов, поступающих с пищей, а также альдиты. В результате первых этапов гликолиза образуется пируват и молекулы АТФ, формируются анаэробные условия. Пируват может быть преобразован в лактат, ацетат, этанол и формиат в цепи разветвленных химических реакций. Данный тип метаболизма используют большинство сахаролитических бактерий ротовой полости, например Streptococcus, Lactobacillus и Actinomyces [38].
На метаболизм углеводов большое влияние оказывают такие факторы внешней среды, как доступность углеводов и кислорода.
При достаточном поступлении углеводов в клетках бактерий, относящихся к роду Streptococcus, повышается внутриклеточный уровень фруктозо-1,6-бифосфата, в результате чего происходит активация лактатдегидрогеназы, отвечающей за синтез лактата. Повышение уровня других промежуточных метаболитов, таких как глицеральдегид-3-фосфата и дигидроксиацетонфосфата (ДГАФ), подавляет активность формиат С-ацетилтрансферазы, ответственной за продукцию формиата, ацетата и этанола в анаэробных условиях. В условиях ограниченного поступления углеводов с пищей происходит снижение внутриклеточных уровней фруктозо-1,6-бифосфата, глицеральдегид-3-фосфата и дигидроксиацетонфосфата (ДГАФ). Результатом снижения уровня данных метаболитов являются два противонаправленных процесса: инактивация лактатдегидрогеназы и активация формиат С-ацетилтрансферазы, что в свою очередь влечет за собой продукцию смешанных кислот. Этот тип метаболизма характерен для бактерий, обитающих в поддесневых зубных бляшках.
В аэробных условиях кислород необратимо деактивирует формиат С-ацетилтрансферазу, в результате чего происходит превращение пирувата в ацетат при участии пируватдегидрогеназы (S. mutans, Actinomyces) и пируватоксидазы (S. sanguinis, Lactobacillus) [38].
3.2. Метаболизм протеинов, пептидов и аминокислот
Протеазы и пептидазы бактерий и человека принимают участие в расщеплении протеинов до пептидов и аминокислот. В то время как большинство бактерий используют аминокислоты для реакций биосинтеза, некоторые протеолитические бактерии, ассоциированные с заболеваниями пародонта, ферментируют аминокислоты как источник для получения энергии. На заключительных этапах ферментации аминокислоты дезаминируются с образованием короткоцепочечных жирных кислот и ATФ [38].
Глутамат является одной из самых распространенных аминокислот, которую включают в свой метаболизм многие бактерии. Так, например, в клетке P. gingivalis глутамат подвергается процессам дезаминирования и карбоксилирования с образованием сукцинил-КоА и последующим его превращением в бутират, пропионат и ацетил-КоА. Ацетил-КоА в свою очередь может метаболизироваться в ацетил с образованием молекул АТФ.
В клетках P. gingivalis и Prevotella intermedia аспартат подвергается процессам дезаминирования, восстановления и декарбоксилирования с образованием пирувата с последующим его превращением в ацетат и выделением энергии. P. gingivalis преобразует фумарат в ацетил-КоА с последующим его превращением в бутират и пропионат. Prevotella intermedia также способна к образованию формиата из пирувата.
Валин и лейцин в цепи последовательных реакций дезаминирования и декарбоксилирования превращаются в изобутират и изовалериат соответственно. Этот тип метаболизма также характерен для P. gingivalis и Prevotella intermedia [38; 39].
Peptostreptococcus micros в своем метаболизме использует серин, источником которого служат олигопептиды, для синтеза ацетата и формиата.
Бактерии, принадлежащие к роду Eubacterium, обладают способностью преобразовывать лизин и аргинин в бутират, хотя метаболический путь этого процесса остается не изученным.
Для таких бактерий, как Fusobacterium, Prevotella, Porphyromonas и Treponema, характерно превращение цистеина в пируват, который может быть включен в дальнейшие метаболические процессы с образованием ацетата и АТФ.
Streptococcus, Veillonella и Actinomyces метаболизируют цистеин с образованием серной кислоты [38].
- Биопленки
Выделяют две основные формы существования микроорганизмов - планктонную, которая подразумевает свободное движение микроорганизмов в среде в виде свободно плавающих (планктонных) клеток, а также существование в виде устойчивых микробных сообществ - биопленок. Как правило, планктонный фенотип бактерий встречается лишь транзиторно, в то время как большинство микроорганизмов, населяющих полость рта человека, существуют в виде смешанных биопленок, в состав которых входят не только бактерии, но и вирусы, грибы, простейшие и археи [9].
Биопленки - это полимикробные сообщества, формирующиеся на поверхности раздела твердой и жидкой фаз, заключенные в матрикс экстацеллюлярных полимерных веществ. В большинстве биопленок только 10% приходится на микроорганизмы, в то время как матрикс может составлять до 90% общей массы. Внеклеточные полимерные субстанции матрикса, преимущественно полисахариды, протеины, нуклеиновые кислоты и липиды, формируют сложную трехмерную архитектуру биопленки и отвечают за адгезию микроорганизмов к различным поверхностям, а также за коадгезию внутри самой биопленки [9].
Полимикробные, или смешанные, биопленки, состоящие из нескольких сотен видов бактерий, образуют стабильные микроконсорциумы с интенсивной межклеточной коммуникацией и высоким уровнем горизонтальной передачи генов [9].
Существование микроорганизмов в составе биопленок кардинально отличается от планктонной формы жизни, так как микробы биопленки вступают в тесные физические, молекулярные и метаболические взаимодействия, что в свою очередь оказывает влияние на их рост, патогенность и резистентность к антибиотикам [1].
4.1. Жизненный цикл биопленки. Первичные колонизаторы
На примере Vibrio cholerae было продемонстрировано, что процесс образования биопленки начинается уже после первого деления клетки бактерии [5].
Модель образования биопленки ротовой полости человека описывает процесс узнавания рецепторов зубного пелликула (тонкой пленки, состоящей из различных химических соединений, возникающей на поверхности зубов уже в первые минуты после чистки) бактериями - первичными колонизаторами; и последующую коадгезию между первичными колонизаторами, фузобактериями и вторичными колонизаторами на эмали зубной поверхности. Рецепторы первичного зубного пелликула включают муцин, агглютинин, протеины с высоким содержанием пролина, протеины с высоким содержанием фосфата и ферменты, например альфа-амилазу. Каждый тип рецептора является специфичным для определенных видов бактерий ротовой полости [18; 19; 32].
Стрептококки составляют 60-90% от всех видов бактерий, колонизирующих зубную поверхность в течение первых 4 часов после профессиональной чистки [24]. Другие ранние колонизаторы включают Actinomyces spp., Capnocytophaga spp., Eikenella spp., Haemophilus spp., Prevotella spp., Propionibacterium spp. и Veillonella spp [20].
Зеленящие стрептококки, и особенно S. gordonii, являются идеальными микробными моделями для изучения процесса ранней колонизации благодаря их высокой способности к связыванию рецепторов организма-хозяина [20]. Кроме того, стрептококки являются единственным видом бактерий ротовой полости, демонстрирующим высокую как внутриродовую, так и межродовую коагрегацию [21]. Перечисленные качества дают стрептококкам возможность активно участвовать в процессе построения первичной зубной бляшки путем адгезии на клетках хозяина и связывания других бактерий - первичных колонизаторов [20].
4.2. Fusobacterium nucleatum и вторичные колонизаторы
Fusobacterium nucleatum представляет собой промежуточное звено между первичными и вторичными колонизаторами. F. nucleatum является самой многочисленной грамотрицательной бактерией ротовой полости в здоровом состоянии, ее количество также значительно возрастает при заболеваниях периодонта.
Бактерии, относящиеся к категории первичных колонизаторов, способны к коадгезии только с определенными видами других ранних колонизаторов и практически лишены способности к присоединению бактерий - вторичных колонизаторов. Fusobacterium nucleatum выступает в роли своеобразного связующего звена в процессе образования биопленки, так как эта бактерия способна к коагрегации как с первичными, так и со вторичными колонизаторами [22].
Нарастание массы биопленки, увеличение разнообразия компонентов матрикса происходит в период «созревания» биопленки. Также в этот период происходит присоединение вторичных колонизаторов, которые пользуются образовавшейся биопленкой, как микросредой [20-22].
4.3. Механизмы коммуникации микроорганизмов в биопленках. Кворум сенсинг
Кворум сенсинг (чувство кворума) представляет собой особый межклеточный сигнальный механизм. Бактерии обладают способностью к синтезу гормоноподобных сигнальных молекул, называемых аутоиндукторами. Когда концентрация аутоиндуктора достигает критического порога, бактерии обнаруживают и реагируют на этот сигнал, изменяя экспрессию генов [30].
Кворум сенсинг впервые был описан в регуляции биолюминесценции у Vibrio fischeri и Vibrio harveyi (Нельсон, 1970; Нельсон и Гастингс, 1979), после чего стал объектом многочисленных исследований [34].
Механизм, позволяющий микроорганизмам общаться друг с другом, значительно повышает выживаемость микробов в неблагоприятных условиях. Бактерии используют чувство кворума для регулирования разнообразных спектров своей физиологической активности, таких как симбиоз, вирулентность, конъюгация, синтез антибиотиков, подвижность, образование спор и формирование биопленки [30].
В настоящее время известно несколько систем кворум сенсинга. Cистемы LuxR/I-типа используются в первую очередь грамотрицательными бактериями, в которых сигнальные молекулы представляют собой ацилированные гомосериндегидрогеназы (Acyl Homoserine Lactones, AHLs), состоящие из гомосерин-лактонного кольца и ацил-цепи. Пептидная сигнальная система LuxS / АИ-2 используется главным образом грамположительными бактериями. Аутоиндуктор-2 (Autoinducer-2, AI-2) - диэфир фуранозил-бората, синтезируется LuxS-AI синтетазами и служит в качестве «универсального сигнала» для межвидовой коммуникации. И система АИ-3 / эпинефрин / норадралин. Аутоиндуктор-3 (Autoinducer-3, AI-3) способен активировать транскрипцию генов вирулентности энтерогеморрагической E. coli. АИ-3 обнаружен у комменсальной кишечной флоры (E. coli, Klebsiella spp., Enterobacter spp.), а также у патогенных Shigella spp. и Salmonella spp. [34].
Недавние исследования показывают, что аутоиндукторы обеспечивают связь не только между клетками одного вида бактерий, но между разными видами бактерий. Кроме того, получены данные, доказывающие, что бактериальные аутоиндукторы способны вызывать ответную реакцию организмов-хозяев. Хотя природа химических сигналов, механизмы их передачи и гены-мишени, контролируемые системами чувства кворума бактерий, различаются, возможность взаимодействия друг с другом позволяет бактериям координировать экспрессию генов и, как результат, поведение всего микробного сообщества [30].
- Микробная эндокринология
Микробная эндокринология - относительно новое междисциплинарное направление науки, возникшее на пересечении интересов микробиологии и нейрофизиологии [23].
Тот факт, что микроорганизмы не только имеют рецепторы к широкому спектру нейрогормонов, но и обладают способностью к их активному производству, известен уже несколько десятилетий. Обширное разнообразие нейроактивных гормонов, вырабатываемых микробиотой человека, варьируется от соматостатина до ацетилхолина и прогестерона [24].
Взаимодействие нейроэндокринной системы и микробиоты служит тем механизмом, с помощью которого осуществляется двунаправленная взаимосвязь организма хозяина и его микробного сообщества и, следовательно, микробиота обнаруживает любое значительное изменение нейрофизиологии организма-хозяина и отвечает на него соответствующим образом [24; 25].
Основное внимание современных исследований направлено на изучение влияния на микрофлору человека стресс-ассоциированных биологически активных веществ, таких как катехоламиновые гормоны, участвующие в реакции «бей или беги» - адреналина, норадреналина и допамина. Это связано с повышением риска возникновения инфекционного процесса в организме человека, вследствие угнетения иммунной системы под влиянием стресса [10; 23; 26].
Согласно последним исследованиям, основные механизмы стимуляции инфекционного процесса с участием гормонов стресса включают влияние на рост и вирулентность микроорганизмов, а также на экспрессию их генов [27].
Взаимосвязь между железом и ростом бактерий известна уже достаточно давно - ограниченное количество свободного железа в организме-хозяине является серьезным препятствием для роста большинства патогенных микроорганизмов. Катехоламины могут действовать как своего рода сидерофоры - низкомолекулярные вещества, обладающие способностью эффективно связывать железо, обеспечивая тем самым доступ бактериям к недоступному в обычных условиях элементу [11].
В настоящее время получены убедительные доказательства, что в дополнение к усилению бактериального роста катехоламины также способны оказывать прямое влияние на фенотип микроорганизмов, в частности путем модуляции экспрессии генов, ответственных за вирулентность. Так, например, было показано влияние норадреналина на повышение продукции токсина Шига штаммом E. coli O157:H7, вызывающего острые почечные и неврологические осложнения [28].
Несколько in vitro исследований свидетельствуют о том, что гормоны стресса значительно усиливают бактериальную адгезию к тканям организма-хозяина [13, с. 340].
Хотя большинство исследований влияния катехоламинов на рост и вирулентность были проведены в отношении кишечных бактерий, катехоламиновые гормоны повсеместно распространены в организме млекопитающих, и поэтому становится все более очевидным, что различные виды бактерий, населяющих другие анатомические ниши, также могут реагировать на изменения уровней гормонов стресса [10]. В организме человека стресс является фактором риска развития болезней десен и пародонта, а такие стресс-ассоциированные гормоны, как кортизол, норадреналин и адреналин, определяются в значимых концентрациях в слюне [17].
Заключение
На сегодняшний день накоплено значительное количество данных о взаимодействии микробиоты и ее хозяина в естественных условиях. Огромное количество работ посвящено роли микробных ассоциаций в патогенезе инфекционных заболеваний ротовой полости человека, таких как кариес и периодонтит, в то время как влияние микроорганизмов на развитие других заболеваний остается практически не изученным. Микробиота ротовой полости является наиболее доступной для изучения. Слюна может быть использована в качестве неинвазивного, чувствительного, легко воспроизводимого и мало затратного метода для диагностики и мониторинга физиологического гомеостаза организма и его дестабилизации. Таким образом, изучение микробиоты ротовой полости, описание ее видового состава имеет не только теоретическое, но и большое практическое значение. Оценка состава и свойств микробных ассоциаций слюны человека позволит понять механизмы влияния микроорганизмов, а также их метаболитов на формирование патологических состояний и организм человека в целом.



