Остеомиелит - гнойно-некротический процесс, развивающийся в кости и костном мозге, а также в окружающих их мягких тканях. Для лечения этого заболевания широко применяются антибиотики [5; 6; 10]. Однако помимо того, что они часто оказывают побочные действия, сама реакция микроорганизмов к антибиотикам подвержена существенным изменениям, характеризующимся увеличением их устойчивости к применяемым препаратам. Все это стимулирует научные исследования, направленные на поиск новых средств лечения остеомиелита. В частности, была выявлена активность бетулоновой кислоты и её амида, в том числе против Staphylococcus aureus [2], который является наиболее распространенным этиологическим фактором остеомиелита [3; 7; 8].
Целью настоящего исследования являлось изучение эффективности применения β-аланиламида бетулоновой кислоты (N-[3-оксо-20(29)лупен-28-оил]-3-аминопропионовая кислота; предполагаемое коммерческое название - «бетамид») для лечения остеомиелита стафилококковой этиологии у экспериментальных животных.
Материал и методы исследования
Эксперимент проведен на 48 половозрелых крысах-самцах Wistar с исходной массой 180–220 г, по 6 особей в группах у которых с помощью инокуляции суточной культуры Staphylococcus aureus (штамм 209) был воспроизведен остеомиелит [1]. Животных выводили из эксперимента через 1, 2 и 3 месяца. В ходе эксперимента были сформированы группы с воспалением: «В 1 мес.»; «В 2 мес.»; «В 3 мес.». В качестве контроля использовали 6 интактных животных (группа «Инт»). Группе животных «ВО 2 мес.» вводили водно-масляную эмульсию в течение 10 дней до истечения 2-месячного срока с момента инокуляции Staphylococcus aureus, а в группе животных «ВО 3 мес.» введение водно-масляной эмульсии продолжали до окончания 3 месяцев. В группе животных «ВОБ 2 мес.» вводили бетамид в дозе 50 мг/кг в виде водно-масляной эмульсии в течение 10 дней до окончания 2 месяцев с момента инокуляции Staphylococcus aureus. В группе животных «ВОБ 3 мес.» введение водно-масляной эмульсии с бетамидом продолжали до окончания 3-месячного срока с момента инфицирования.
Большеберцовую кость фиксировали в 12%-ном формалине с последующей декальцинацией в растворе «Biodecк R» (Bio-Optica Milano SPA, Италия). Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Морфологию большеберцовой кости оценивали при обзорной микроскопии после окраски срезов гематоксилином Эрлиха и эозином. Коллагеновые волокна выявляли пикрофуксином по Ван Гизону, сульфатированные гликозаминогликаны – альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера. Для иммуногистохимического анализа использовали стандартный метод фиксации тканей в нейтральном формалине с последующей дегидратацией и заливкой в парафин. Иммуногистохимическое исследование по оценке уровня экспрессии маркера клеток макрофагального ряда (Anti-Mononuclear Phagocyte-Biotin (Clone: 1C7, Isotype: Mouse IgG1; BD Biosciences) проводили с помощью непрямого стрептавидин-биотинового пероксидазного метода. В работе использовали систему визуализации Peroxidase Detection System (Novocastra). После процедуры демаскировки иммуногистохимическую окраску препаратов проводили в соответствии с общепринятыми стандартами указанной методики [4; 9] и в соответствии с рекомендациями фирм-производителей.
Анализ интенсивности окрашивания коллагеновых волокон проводили с помощью светооптического микроскопа и морфометрического комплекса на базе микроскопа Micros MC 300A, цифровой камеры CX 13c (Baumer Electric GmbH, Германия) и программного обеспечения ImageJ 1.42g (Национальный институт здоровья, США). Для каждой группы оценивалось 48 изображений.
Статистическую обработку результатов исследования проводили с использованием программного пакета для статистической обработки SPSS v 13.0 for Windows. Для сравнения независимых групп использовали критерий Краскела–Уоллиса с последующим межгрупповым сравнением с помощью критерия Манна-Уитни. Различия между значениями сравниваемых параметров расценивали как статистически значимые при р < 0,05. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
Результаты исследования и обсуждение
При морфологическом исследовании большеберцовой кости через 1 месяц после трепанации и введения нити с культурой Staphylococcus aureus наблюдались признаки остеомиелита. Так, в месте костного дефекта выявлялись обширные зоны некроза и инфильтрации грануло-, лимфо- и гистиоцитарными элементами, располагающимися в непосредственной близости к введенным в трепанационное отверстие нитям с золотистым стафилококком. При этом отмечалось достаточно четкое зонирование клеточных элементов. Как правило, в фокусе таких инфильтратов находились скопления нейтрофилов, которые были окружены лимфоцитарно-макрофагальным валом. Обращало на себя внимание отсутствие на данном сроке признаков ангиогенеза, присущих неинфицированному перелому, и может расцениваться как недостаточность репаративных процессов при остеомиелите. Со стороны сохраненных балок наблюдалась остеокластическая резорбция костной ткани, а также продуктивно-воспалительная реакция эндоста и периоста.
Через 2 месяца после инокуляции Staphylococcus aureus сохранялись зоны некроза костного мозга в непосредственной близости от введенных хлопчатобумажных нитей, ограниченные валом лимфоцитарных и макрофагальных элементов, переходящим в макрофагально-фибробластический барьер (рис. 1). Наблюдалась остеокластическая резорбция и фрагментация балок губчатой костной ткани. Достаточно часто в зоне некроза встречались костные осколки с остеоцитами, подвергшимися деструкции, что может служить неблагоприятным фактором, приводящим к хронизации процесса.
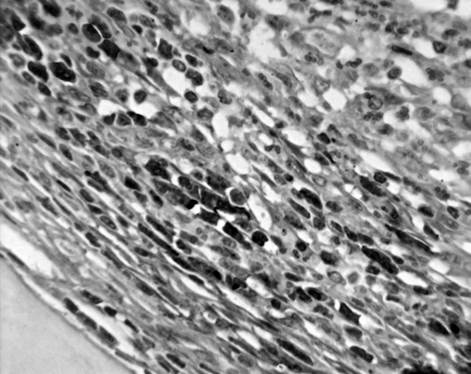
Рис. 1. Участок большеберцовой кости крысы через 2 мес. после инокуляции Золотистого стафилококка. Формирование макрофагально-фибробластического барьера, ограничивающего зону некроза. Иммуногистохимическая реакция на ED1-подобный антиген с последующей докраской ядер гематоксилином. Ув. 600
При морфологическом изучении большеберцовой кости через 3 месяца после инокуляции Staphylococcus aureus отмечалось сохранение зон некроза костного мозга, ограниченных макрофагально-фибробластическим барьером. В зонах расположения введенных хлопчатобумажных нитей наблюдалось большое количество макрофагов и гигантских многоядерных клеток Пирогова-Лангханса, содержащих многочисленные ядра по периферии цитоплазмы в виде кольца. Костные балки были фрагментированы, содержали немногочисленные, неравномерно расположенные остеоциты, участки с очаговым просветлением. Отмечалось заполнение пространств между костными балками фиброзной тканью с большим содержанием коллагеновых волокон. Так же как и в предыдущей группе, достаточно часто в зоне некроза встречались костные осколки с остеоцитами, подвергшимися деструкции (рис. 2), что определяло хроническое течение остеомиелита.
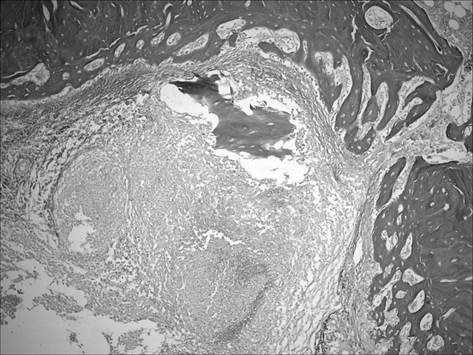
Рис. 2. Участок большеберцовой кости крысы через 3 мес. после инокуляции Золотистого стафилококка. Наличие костных осколков с погибшими остеоцитами в зоне некроза. Окраска пикрофуксином по Ван Гизону. Ув. 100
Динамика и характер морфологических изменений большеберцовой кости в группах «ВО 2 мес.» и «ВО 3 мес.» не отличались от группы «В 2 мес.» и «В 3 мес.», что может служить подтверждением того, что используемая среда для приготовления водно-масляной эмульсии не оказывает влияния на течение воспалительного процесса.
Морфометрический анализ интенсивности окрашивания коллагеновых волокон, отражающей плотность их распределения в костных балках, оценивали у животных групп «В 2 мес.» и «ВО 2 мес.», а также «В 3 мес.» и «ВО 3 мес.». Было установлено, что на аналогичных сроках эксперимента в данных группах статистически значимых различий не наблюдалось (табл. 1).
Таблица 1
Интенсивность окрашивания коллагеновых волокон костной ткани в у.е. Me (Q1; Q3)
|
Показатель |
«В 2 мес.» |
«В 3 мес.» |
«ВО 2 мес.» |
«ВО 3 мес.» |
|
Интенсивность окрашивания костной ткани |
84,6 (65,7; 89,5) |
70,0 (62,8; 79,2) |
80,5 (72,8; 86,2) |
73,3 (62,5; 80,3) |
Примечание: группа «В 2 мес.» – через 2 месяца после инокуляции Золотистого стафилококка; группа «В 3 мес.» – через 3 месяца после инокуляции Золотистого стафилококка; группа «ВО 2 мес.» - через 2 месяца после инокуляции Золотистого стафилококка и введения per os масляной эмульсии; группа «ВО 3 мес.» - через 3 месяца после инокуляции Золотистого стафилококка и введения per os масляной эмульсии;
* - различия аналогичных сроков при р<0,05.
При морфологическом исследовании группы «ВОБ 2 мес.» было обращено внимание на отсутствие зон некроза и существенное снижение зон инфильтрации. Причем, в отличие от группы «В 2 мес.», было отмечено, что изменился сам характер воспалительных инфильтратов, которые были представлены лимфоцитарно-макрофагальными элементами с существенным преобладанием последних, а также практически полное отсутствие гранулоцитов. Вместе с тем отмечалось выраженное формирование рыхлой волокнистой соединительной и грубоволокнистой костной тканей. Необходимо отметить, что содержание сульфатированных гликозаминогликанов в рыхлой волокнистой соединительной ткани было выше, чем в группе «В 2 мес.».
Со стороны костных балок отмечалась остеогенная резорбция кости, которая сочеталась с выраженным репаративным эндохондральным остеогистогенезом. Причем достаточно часто новообразованная костная ткань включала в себя фрагменты введенной в трепанационное отверстие хлопчатобумажной нити.
При морфологическом исследовании группы «ВОБ 3 мес.» отмечалось отсутствие зон некроза и инфильтрации, не выявлялась воспалительная реакция со стороны эндоста и периоста. Вместе с тем отмечалось выраженное формирование рыхлой волокнистой соединительной и грубоволокнистой костной тканей (рис. 3).
Морфометрический анализ интенсивности окрашивания коллагеновых волокон (табл. 2), отражающей плотность их распределения в костных балках у животных групп «В 2 мес.» и «ВОБ 2 мес.», показал, что она статистически значимо не различалась (что свидетельствовало об одинаковом уровне выраженности коллагенообразования в костных балках), но отличалась от группы интактных животных. Интенсивность окрашивания коллагеновых волокон в группах «В 3 мес.» и «ВОБ 3 мес.» статистически значимо различалась. При этом интенсивность окрашивания коллагеновых волокон в группе «ВОБ 3 мес.» и в группе интактных животных достоверно не отличалась, что свидетельствовало о практическом завершении эндохондрального остеогистогенеза.
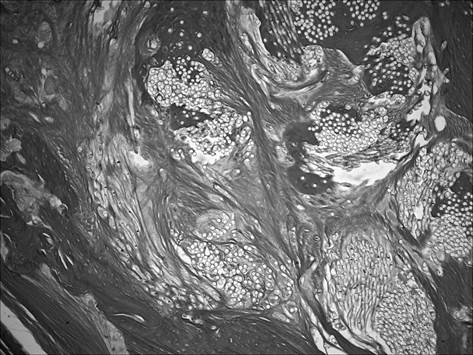
Рис. 3. Участок большеберцовой кости крысы через 3 мес. после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Формирование рыхлой волокнистой соединительной и грубоволокнистой костной тканей вокруг введенных в трепанационное отверстие нитей с культурой микроорганизмов. Окраска пикрофуксином по Ван Гизону. Ув. 100
Таблица 2
Интенсивность окрашивания коллагеновых волокон костной ткани в у.е. Me (Q1; Q3)
|
Показатель |
«В 2 мес.» |
«В 3 мес.» |
«ВОБ 2 мес.» |
«ВОБ 3 мес.» |
Инт. |
|
Интенсивность окрашивания костной ткани |
84,6 (65,7; 89,5)# |
70,0 (62,8; 79,2)# |
77,0 (69,8; 91,4)# |
61,7 (49,2; 69,9)* |
54,7 (48,0; 62,7) |
Примечание: «В 2 мес.» – через 2 месяца после инокуляции Золотистого стафилококка; «В 3 мес.» – через 3 месяца после инокуляции Золотистого стафилококка; «ВОБ 2 мес.» - через 2 месяца после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида; «ВОБ 3 мес.» - через 3 месяца после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида; Инт. – интактные животные;
# - различия с интактными животными при р<0,001; * - различия интенсивности окрашивания коллагеновых волокон на аналогичных сроках при р<0,001.
Заключение
Результаты проведенного исследования показали, что β-аланиламид бетулоновой кислоты (бетамид) в дозе 50 мг/кг
- предотвращает генерализацию воспалительного процесса, формирование обширных зон некроза и инфильтрации, остеокластическую резорбцию кости и формирование секвестров, что предотвращает хронизацию воспалительного процесса и способствует его разрешению;
- способствует более раннему и более выраженному образованию рыхлой волокнистой соединительной и грубоволокнистой костной тканей, что свидетельствует о позитивном влиянии препарата на репаративные процессы;
- вызывает ускоренное наступление фазы функциональной адаптации, способствуя более быстрому завершению репаративного эндохондрального остеогистогенеза с образованием зрелой костной ткани.



