Хлорид триметилолова (TMT) является нейротоксикантом, применяющимся в производстве и сельском хозяйстве [7]. Экспериментальные исследования на животных, предпринятые с целью выяснения механизмов действия ТМТ, показали, что вещество вызывает ряд патологических явлений в центральной нервной системе: расширение боковых желудочков, отек мозга, нейродегенерацию [3, 4]. Способность ТМТ вызывать нейрональную гибель в отдельных областях мозга дает возможность использовать этот нейротоксикант в качестве экспериментальной модели, позволяющей изучать клеточно-молекулярные механизмы нейродегенерации, намечать подходы для создания новых нейропротективных средств [2]. Использование TMT в качестве инструмента нейродегенерации дает несколько преимуществ: 1) известны повреждаемые области мозга, клеточные мишени и динамика нейродегенерации; 2) гематоэнцефалический барьер не претерпевает существенных изменений, что ограничивает вклад периферических факторов в механизмы нейротоксичности; 3) известные белковые и мРНК-маркеры могут быть использованы в качестве положительного контроля при изучении экспрессии генов, связанной с действием TMT. Первичной мишенью действия ТМТ на нейроны являются, по-видимому, митохондрии, в частности, локализованный на внешней мембране высоко консервативный мембранно-связанный белок станнин (stannin). Как при действии и других нейротоксинов, наблюдается активация циклооксигеназ, провоспалительных цитокинов, индукторов апоптоза, нарушение кальциевого обмена, что свидетельствует о развитии окислительного стресса, эксайтотоксичности, нейровоспаления [2, 4].
Важная особенность действия ТМТ заключается в спонтанном восстановлении и нормализации некоторых функций мозга, например, показано, что возникающая судорожная активность у крыс исчезает через 2–3 недели после инъекции нейротоксиканта [4]. Рассматривая характер поведенческих нарушений, вызванных ТМТ у крыс, можно отметить их существенное многообразие – от изменения двигательных реакций до специфических когнитивных дисфункций. Особенности дефектов обучения и памяти, которые выявлены в различных поведенческих тестах, определяются своеобразием нарушений, вызванных ТМТ в структурах мозга животных. У мышей и крыс TMT вызывает гиперактивность в открытом поле, повышение двигательной активности и нарушение обучения в тестах пассивного и активного избегания, поведения в Т-образном лабиринте и водном лабиринте Морриса [3, 4]. Гиппокампальные нарушения поведения у животных были показаны и через длительные промежутки времени: даже через 16 недель после введения ТМТ было выявлено ухудшение обучения крыс в лабиринте Морриса [8]. Эффекты, вызываемые ТМТ, как и любого фармакологического агента, зависят от дозы, способа введения вещества, а также от типа поведенческого теста и промежутка времени между инъекцией и тестированием. В экспериментальных работах, посвященных изучению когнитивных функций, основное внимание уделяется реакциям, зависящим от гиппокампальной системы, однако, полученные результаты могут интерпретироваться по-разному. В настоящей работе изучали влияние однократной инъекции ТМТ на обучение крыс в лабиринте. Для того чтобы исключить влияние судорожной активности на развитие нейродегенеративных процессов и для облегчения проведения поведенческих экспериментов, после инъекции ТМТ животным вводили противоэпилептический препарат (пентобарбитал).
Материалы и методы исследования
Эксперименты проведены на крысах-самцах линии Вистар (n=28) весом 210-220 г. Животных содержали и использовали в соответствии с правилами Совета Европейского сообщества (директива от 1986 г.).
Введение ТМТ. После предварительного привыкания к рукам крысам делали однократную инъекцию ТМТ (Sigma) в дозе 7,5 мг/кг, подкожно. Вещество растворяли в изотоническом растворе NaCl и вводили в объеме 0,5 мл. Контрольным животным делали инъекции изотонического раствора NaCl в том же объеме. После этого животных отсаживали в клетки и ежедневно взвешивали; воду и корм этим животным давали без ограничений. Другой группе животных вводили ТМТ (7,5 мг/кг) и через одну неделю начинали обучение в лабиринте с пищевым подкреплением.
Поведенческие эксперименты. Обучение крыс навыку чередования с пищевым подкреплением в лабиринте с четырьмя целевыми полками (Рис. 1) начинали через 7 дней после инъекции ТМТ. Предварительное привыкание к экспериментальной обстановке в течение двух дней заключалось в помещении каждого животного на 10–15 минут в лабиринт, в котором были разложены смоченные шарики хлеба. Выработку навыка проводили в течение шести дней до достижения животными критерия: среднее время побежки за дневную серию должно составлять менее 10 секунд. В день животные совершали по 10 побежек. В этот период обучения крысы получали подкрепление на полках № 1 и № 2. После обучения в течение 6 дней изменяли экспериментальные условия: пищевое подкрепление осуществляли на полках № 1 и № 4. При этом регистрировали время побежек и число ошибочных реакций к неподкрепляемой полке № 2.
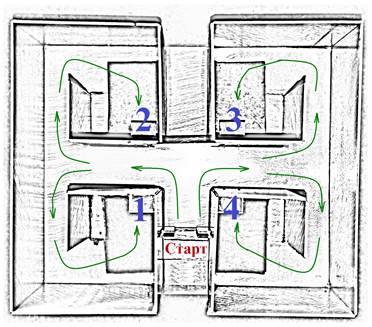
Рис. 1. Схема лабиринта. Цифрами указаны номера полок для пищевого подкрепления
Результаты и обсуждение
Одно из заметных проявлений токсического действия ТМТ на крыс заключается в нарушении пищевого поведения и, как следствие, потере массы тела. Действительно, в течение первых двух дней после инъекции ТМТ вес животных снизился и оставался примерно постоянным в течение одной недели. Затем вес животных стал увеличиваться, и через три недели после инъекции крысы контрольной и опытной групп по этому показателю достоверно не различались (Рис. 2).
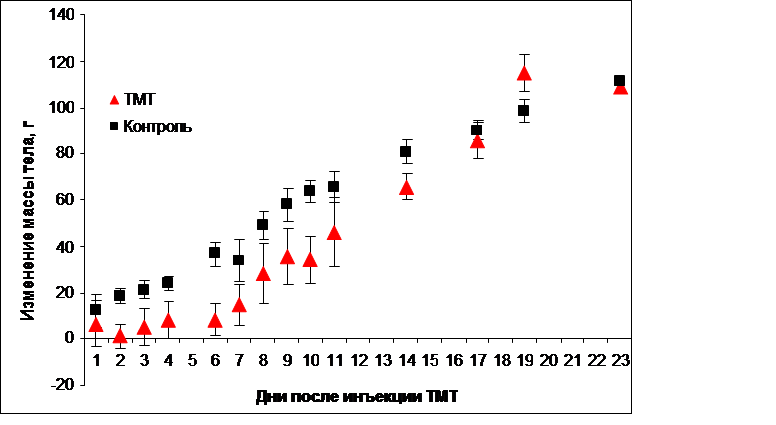
Рис.2. Среднее значение привеса животных. Изменение массы тела крыс после инъекции хлорида триметилолова в дозе 7,5 мг/кг в контрольной (n=6) и опытной (n=6) группах
Выработку навыка чередования в лабиринте у животных опытной и контрольной групп начинали, когда пищевая мотивация, нарушенная ТМТ, нормализовалась – через одну неделю после инъекции нейротоксиканта и изотонического раствора NaCl. Стабильное воспроизведение навыка наблюдалось через 4–5 дней обучения. Результаты показали, что динамика обучения животных контрольной и опытной групп была сходной, и время побежек достоверно не различалось между группами (Рис. 3).
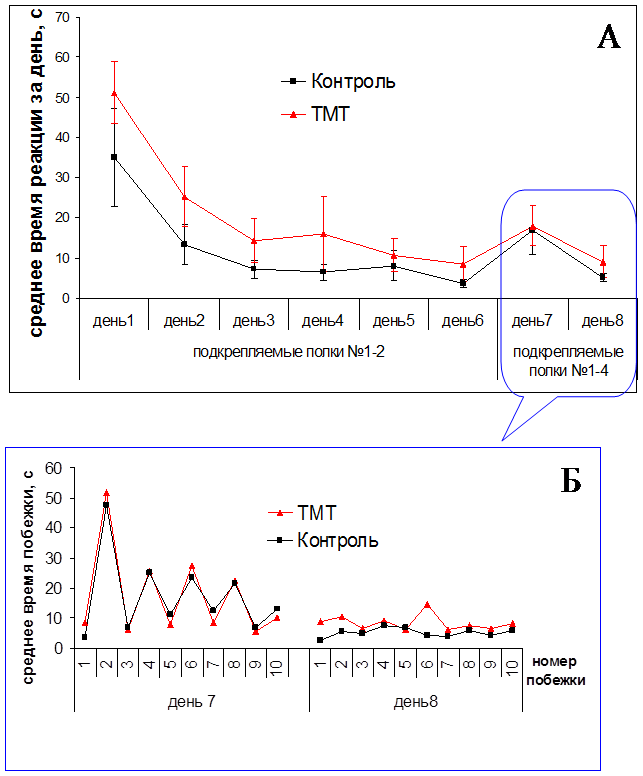
Рис. 3. Динамика выработки реакции чередования с пищевым подкреплением в лабиринте у крыс (n=16). A – усредненное значение времени побежек за день. Динамика обучения через одну неделю после однократной инъекции хлорида триметилолова в дозе 7,5 мг/кг. Б – среднее время побежек после изменения подкрепляемых полок (№1-2 на №1-4)
В наших экспериментах применение ТМТ не оказало существенного влияния, как на двигательную активность животных, так и на способность к выработке реакции чередования. Однако изменение подкрепления выявило дефекты в поведении опытных крыс: у них существенно ухудшилась способность адекватно реагировать на изменившуюся экспериментальную ситуацию. Целевая полка № 2 на этой стадии эксперимента уже не подкреплялась, однако крысы продолжали совершать к ней побежки; причем число таких реакций, которые рассматривались как ошибочные, было больше у животных опытной группы, чем контрольной (Рис. 4). Настойчивое повторение заученной реакции, потерявшей биологическое значение, характерно для животных с поврежденным гиппокампом, например, в ситуации экспериментального угашения навыка (вызванное отсутствием подкрепления) [1].
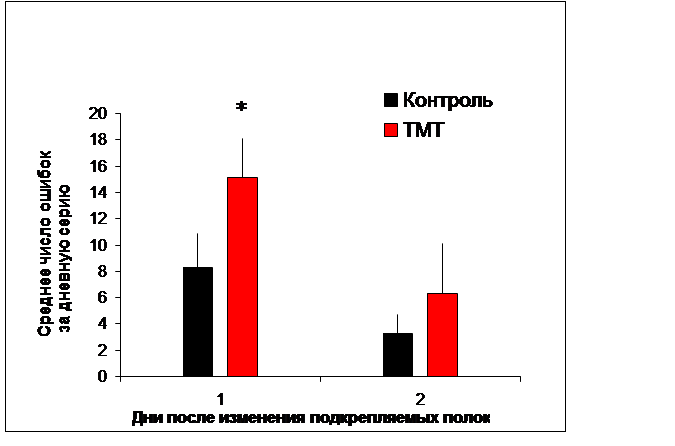
Рис. 4. Среднее число ошибочных побежек к неподкрепляемой полке № 2, совершаемых крысами через 2 недели после инъекции хлорида триметилолова и контрольными животным. Указано значение М±s; * - P<0,02, по критерию Манна – Уитни
Гиппокамп чувствителен ко многим повреждающим воздействиям, и его дефекты проявляются при проведении различных поведенческих тестов. Результаты исследований последних лет показывают, что нейроны гиппокампа способны кодировать не только пространственные, но и временные параметры, принимая участие в когнитивных функциях, связанных с регистрацией и воспроизведением информации [6]. Особое значение для обучения имеет участие гиппокампа в механизмах ориентировочно-исследовательского поведения, так как формирование осознаваемой (декларативной, эпизодической) формы памяти невозможно без проявления ориентировочной реакции. Животные с поврежденным гиппокампом показывают повышенную реактивность к новым раздражителям и сниженную продолжительность сна. Однако некоторые формы поведения не меняются, например, такие как груминг, потребление пищи и воды. Животные с дефектным гиппокампом менее любопытны, у них нет необходимости в увеличении притока информации, поэтому нарушены свойства ориентировочного рефлекса: его избирательность, возможность переключения с одного стимула на другой; тормозящее влияние на другие виды деятельности [9]. Триметилолово в дозе, используемой в настоящей работе, вызвал ограниченное повреждение гиппокампа, которое проявилось через четыре недели после инъекции как снижение способности к переучиванию, не повлияв на общую двигательную активность и выработку реакции чередования в лабиринте. Гибель нейронов, как это следует из литературных и наших предварительных данных, ограничивается полями СА3-СА4 и зубчатой фасцией. Кроме того, следует принять во внимание фармакологическое подавление судорожной активности, предпринятое нами в этой работе, что также ограничивает повреждающее влияние ТМТ на гиппокамп. Специфический характер нейротоксического повреждения, когда гибель нейронов ограничена отдельными полями, позволяет оценить их возможную роль в когнитивных функциях. Действительно, хорошо известно, что эффекты повреждения гиппокампа зависят не только от того, каков объем повреждений, но и от субрегионального распределения гибели нейронов. Общепринятым можно считать сам факт особого вклада в механизмы когнитивных функций субрегионов гиппокампа, но мнения относительно того, какие именно функции они выполняют, противоречивы, на что указывают, например, авторы обзора [5]. После рассмотрения большого массива экспериментальных результатов в обзоре делается вывод, что поле СА1 специфически вовлекается, когда требуется процессинг событий во времени. Это проявляется двумя путями: во-первых, при образовании ассоциативных связей во времени (например, когда применяется отсрочка между стимулами); во-вторых, при запоминании порядка стимулов во времени. Поле СА3 требуется как для постепенного, так и для быстрого формирования ассоциативных связей между событием и пространственной информацией (контекстом). Разрушение дорсального поля СА3 не нарушает постепенное приобретение пространственной информации, однако поле СА3, по-видимому, необходимо для быстрого кодирования новой пространственной информации. О функциональных особенностях зубчатой фасции известно меньше – отмечается, что в этом субрегионе гиппокампа происходит предварительная обработка информации, которая передается в СА3, где она связывается с другими стимулами [5]. Такое заключение согласуется с представлением о компараторной роли поля СА3, которое было обосновано О.С. Виноградовой [9].
Заключение
Экспериментальная модель нейрональной гибели, вызванной ТМТ, представляет большой интерес при исследовании механизмов нейродегенерации, прежде всего, в гиппокампе. Нейродегенеративные процессы, происходящие как в нормальных условиях при развитии и старении, так и при многих заболеваниях (эпилепсия, болезни Паркинсона и Альцгеймера и др.), сопровождаются нарушением когнитивных функций. Специфичность таких нарушений может указывать на возникновение и развитие нейродегенеративного процесса. Морфо-функциональные нарушения гиппокампа, вызванные ТМТ, со временем частично компенсируются. Очевидно, что нарушение клеточного состава в полях СА3-СА4 гиппокампа необратимо, вследствие чего такие компенсаторные процессы должны происходить благодаря модификации нейрональных сетей, с участием экстрагиппокампальных структур. Таким образом, благодаря особенностям действия ТМТ на мозг, эту экспериментальную модель можно рассматривать как вполне адекватную для разработки новых средств терапии нейродегенеративных заболеваний.
Работа поддержана РФФИ-мол_а № 16-34-01167.



