Исследования взаимодействия высокоинтенсивного лазерного излучения с мозговыми тканями проводятся с 1965 года [4]. Результаты многочисленных экспериментов с нервной тканью различных животных (крысы, кролики, собаки и кошки), проводимых в последующие годы с использованием излучения всех основных типов лазеров (лазер на рубине, аргоновый, на углекислом газе, неодимовый, гетеролазер), неоднократно обобщались и систематизировались, что позволило выявить основные закономерности взаимодействия лазерного излучения с тканями мозга. Эффект зависел от параметров лазерного излучения (интенсивность, длина волны), времени воздействия, теплофизических и оптических характеристик ткани. Общий характер, независимо от длины волны воздействующего лазерного излучения, носило образование на поверхности мозга углубления в виде кратера с размером, слегка превышающим диаметр луча, и центральной зоной вапоризации, где температура повышалась до 100оС. По краю кратера возникала зона коагуляционного некроза, за которой располагался слой отека мозговой ткани с ишемическими нарушениями, деструкцией нейронов и макрофагальной реакцией. Такое типичное повреждение быстро отторгалось с минимальной реакцией глиоза по периферии дефекта [2, 6-9].
Эксперименты на мозге крыс и кроликов, проводимые с регистрацией температуры облучаемых участков поверхности коры, выявили существенные различия в изменениях мозговой ткани, обусловленных воздействием излучения СО2- и ИАГ-лазеров [7, 8, 10]. В частности, гистологические исследования показали, что при схожих поверхностных температурах глубина некроза подлежащей мозговой ткани, вызванного воздействием излучения неодимового лазера с длиной волны 1,06 мкм, больше, чем от излучения СО2-лазера (длина волны 10,6 мкм) и лазера на неодиме с длиной волны 1,32 мкм [3, 6]. Мозговые и опухолевые ткани (как и большинство тканей организма) для электромагнитного излучения оптического диапазона являются мутными средами с большим удельным поглощением, вследствие этого лазерный луч, распространяясь вглубь тканей, вызывает их нагрев за счет поглощения, а рассеяние, обусловленное мутностью, делает такой нагрев объемным. Во всех случаях, благодаря теплопроводности, прогрев ткани мозга происходил в объеме, превышающем зону непосредственного воздействия лазерного луча [5]. Такое распространение тепла за пределы облучаемой зоны может привести к нежелательному термическому воздействию на здоровые участки тканей мозга. Поэтому для отработки хирургических методик удаления опухолей мозга с помощью лазера важно знать распределение температуры на различной глубине в тканях мозга и менингиомы, как в зоне воздействия лазерного излучения, так и в прилегающих участках. Отметим, что в ранее проведенных экспериментальных исследованиях [7, 8, 10] регистрация температуры осуществлялась лишь на поверхности мозга.
Целью нашего исследования явилось изучение особенностей термического воздействия высокоэнергетического лазерного излучения с длиной волны 1,06 мкм на нормальную мозговую ткань подопытных животных и поиск возможности безопасного применения лазерного света при удалении церебральных менингиом.
Материалы и методы. Многочисленными экспериментами in vitro и in vivo доказано, что, чем выше кровенаполнение ткани, т.е., чем больше хроматофоров, в частности, гемоглобина в ней присутствует, тем выше удельное поглощение световой энергии, тем, в свою очередь, на меньшую глубину проникает луч лазера и тем меньше нагрев облучаемой ткани с ростом глубины. Об этом свидетельствуют коэффициенты поглощения излучения ИАГ-лазера кровью и тканями мозга: они соотносятся как 100:1. И хотя плотность и кровенаполнение опухолей менингососудистого ряда различаются в достаточно широких пределах, а для головного мозга эти различия гораздо меньше, в целом уровень поглощения лазерного света тканями менингиом значительно выше, чем у тканей мозга.
В выполненных ранее исследованиях [1] было доказано, что оптические параметры (поглощающая, отражающая и рассеивающая способности) тканей головного мозга человека для лазерного излучения, в том числе инфракрасной области спектра, практически не отличаются от таковых у головного мозга кролика. По этой причине в наших исследованиях особенностей взаимодействия лазерного излучения с мозговым веществом в качестве подопытных животных использовались кролики.
Эксперименты проводились с соблюдением этических норм, регламентированных приказом МЗ РФ № 266 от 19.03.2003 г. Для исследований было отобрано 34 кролика породы шиншилла с массой тела от 2,0 до 3,4 кг. Все животные были здоровы и содержались в стандартных условиях вивария Новосибирского НИИТО, как правило, больше недели. Источником излучения служил хирургический лазер на иттрий-алюминиевом гранате, активированном неодимом (длина волны излучения 1,06 мкм), работающий в частотном режиме (частота следования импульсов 100 Гц), с регулируемой средней мощностью.
В соответствии с поставленными задачами все животные были разделены на 3 группы (таблица).
Распределение экспериментальных животных по группам
|
№ группы |
Количество животных |
Характеристика режима воздействия |
|
1 |
22 |
Средняя мощность излучения 30 и 45 Вт, режим коагуляции, диаметр пятна 3 мм |
|
2 |
10 |
Средняя мощность излучения 30 Вт, режим вапоризации, диаметр пятна 2 мм |
|
3 |
2 |
Монополярная коагуляция |
Эксперимент начинался с общего обезболивания животного: использовалось введение Sol. Promedoli, Sol. Relanii, Sol. Ketamini. В положении животного на животе производился линейный разрез кожи в теменной области с двух сторон. Из фрезевого отверстия выполнялась максимально широкая резекционная трепанация, затем вскрывалась твердая мозговая оболочка двумя лоскутными разрезами основанием к сагиттальному синусу. Это позволяло широко обнажать головной мозг и проводить на одном животном несколько измерений, меняя зоны облучения и глубину погружения миниатюрного игольчатого датчика температуры, разработанного и изготовленного в лаборатории лазерных медицинских технологий Института лазерной физики СО РАН. Глубина погружения термодатчика задавалась ограничителем, который мог перемещаться по игле с последующей фиксацией. Замеры температуры выполнялись с интервалами времени от 2 секунд до 1 минуты на глубинах 0,5, 1,0, 1,5 и 2,0 см в направлении нормали к поверхности облучаемого участка. Контроль размера облучаемой зоны в опытах с животными первой группы осуществлялся по лучу прицельного гелий-неонового лазера. После прекращения облучения дополнительно регистрировалось время остывания ткани, происходящего либо естественным путем – за счет конвекции и кровотока, либо принудительно – путем орошении раны физиологическим раствором комнатной температуры (18 oС). Для повышения точности все замеры температуры выполнялись четырехкратно.
Термическая устойчивость биотканей живых организмов различается незначительно, у человека денатурация белков и необратимые изменения в тканях начинают проявляться при температуре 42,5 оС. Исходя из этого значения температуры, мы приняли в своих экспериментах два температурных критерия: 1) значение максимальной безопасной температуры нагрева зон мозга человека, прилегающих к обрабатываемому участку, не приводящее к денатурации белков, мы положили равным 41 оС; 2) приращение температуры нормальной мозговой ткани кролика на 4,5 оС (для мозга человека – разность между максимальной безопасной и нормальной температурой 36,6 оС) мы назвали критическим. Мы также полагали, что режим работы ИАГ-лазера, не вызывающий повышения температуры до критических значений на определенной глубине облучаемой нормальной мозговой ткани, будет гарантированно безопасным для глубже лежащего мозга при замене слоя мозгового вещества равным по толщине слоем тканей менингиомы, вследствие значительной разницы в поглощении излучения опухолевыми и нормальными тканями головного мозга.
При обработке экспериментальных данных мы в основном оперировали значениями температурных приращений, так как в силу индивидуальных физиологических особенностей животных и разной продолжительности наркозного сна начальные значения температуры мозга у разных особей перед экспериментом, в общем случае, не совпадали (разброс лежал в промежутке от 37,3 до 41,2 оС).
Животным первой и второй групп предварительно выполнялась дегидратация тканей подлежащего облучению участка мозга расфокусированным лучом лазера. Визуально должный уровень дегидратации определялся по появлению побледнения облученной ткани, стягиванию ее поверхности и запустеванию всех сосудов. После установления температурного равновесия (в среднем через 4,0–4,5 мин) приступали к основному этапу эксперимента.
У части животных первой группы замеры температуры при облучении расфокусированным лучом были выполнены при мощности излучения 30 Вт, у остальных – при 45 Вт.
У всех животных второй группы температурные измерения проводились при облучении в режиме вапоризации (сфокусированный луч, мощность излучения 30 Вт).
В третьей группе замеры температуры выполнялись на тех же глубинах, что и у животных предыдущих групп, через 15, 30, 45 и 60 секунд от момента начала воздействия монополярной коагуляцией.
Результаты и их обсуждение. Изучение зависимости температуры ткани головного мозга и средних значений температурных приращений на различной глубине от времени облучения расфокусированным лучом ИАГ-лазера в первой группе животных показало, что в поверхностных слоях исследуемого объема ткани в пределах глубины проникновения лазерного луча (0,5 см), вне зависимости от мощности излучения, имеет место почти мгновенное (за 4–5 сек) возрастание температуры до 80–85 оС. Дальнейшее воздействие максимальной мощностью (45 Вт) в течение 1 минуты приводило к повышению температуры мозга на этой же глубине до 107 оС. При этом максимальные средние показатели приращения температуры достигали 67 оС.
На глубине 1,0 см от поверхности мозга кролика после облучения лазерным светом мощностью 45 Вт в течение 1 минуты исследуемые ткани также подвергались значительному нагреву: средняя температура достигала 88 ºС при среднем приращении 48,4 ºС. Напротив, облучение мощностью 30 Вт приводило на этой же глубине лишь к небольшому приращению температуры, достигавшему после минуты воздействия 4,3ºС – ниже критического уровня.
В более глубоких слоях мозга конечная температура лишь ненамного отличалась от исходных показателей. Так, например, при воздействии мощностью 30 Вт температура мозга на глубинах 1,5-2,0 см не достигала критического уровня. Однако увеличение мощности облучения до 45 Вт приводило, спустя 60 секунд, к превышению критического значения температуры ткани мозга на этих же глубинах, хотя и незначительному: приращения составляли 6,2 ºС и 4,7 ºС соответственно.
Таким образом, нагрев мозговой ткани в зоне облучения и скорость подъема температуры уменьшаются с глубиной.
В серии экспериментов с животными первой группы дополнительно проверялась возможность сократить время остывания прогретого фрагмента мозговой ткани. После облучения в течение 1 минуты применялось искусственное охлаждение, в качестве хладагента использовался физиологический раствор температурой 18 оС.
На рис. 1 и 2 показаны графики зависимости приращения температуры исследуемых участков мозговой ткани от времени.
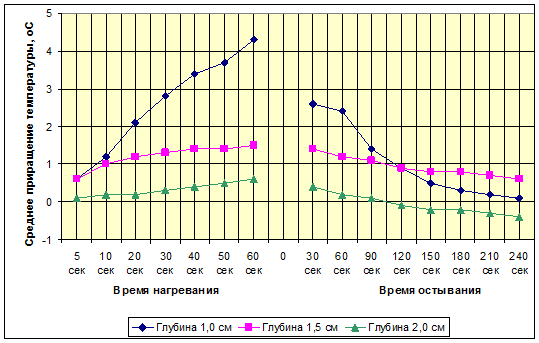
Рис. 1. Приращения температуры участка головного мозга на разной глубине при облучении ИАГ-лазером мощностью излучения 30 Вт и последующем охлаждении физиологическим раствором
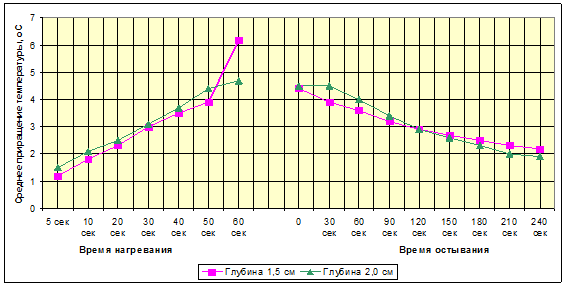
Рис. 2. Приращения температуры участка головного мозга на разной глубине при облучении ИАГ-лазером мощностью излучения 45 Вт и последующем охлаждении физиологическим раствором
Орошение разогретой поверхности мозговой ткани физиологическим раствором комнатной температуры, проводимое после облучения мощностью 30 Вт и 45 Вт, способствует быстрому снижению температуры в глубинных слоях мозга (1,5-2,0 см) до нормы уже через 30 и 90 секунд соответственно. В приповерхностных слоях мозга (0,5-1,0 см) вне зависимости от мощности лазерного луча температура нормализуется в течение 1,5–2 минут.
Таким образом, из представленных данных следует, что охлаждение мозга с помощью орошения облученной зоны физиологическим раствором комнатной температуры идет быстрее естественного приблизительно в два раза, достигая нормальной температуры в среднем через 1,5–2,0 минуты, в зависимости от полученной при облучении дозы.
Анализируя динамику нагрева тканей на глубине 2 см от поверхности облучаемого участка, можно сделать вывод, что при мощности излучения 45 Вт и диаметре пятна 3 мм продолжительность однократной обработки во избежание перегрева глубинных слоев не должна превышать 45 секунд. В случае необходимости использования больших световых мощностей следует либо увеличить расфокусировку, уменьшив тем самым плотность мощности излучения на поверхности ткани, либо сократить время однократной обработки. Так, при мощности луча 45 Вт следует увеличить диаметр пятна на облучаемой поверхности до 4 мм или ограничиться при однократном воздействии временным промежутком в 25–30 секунд.
Более приемлемой является мощность излучения 30 Вт: в этом случае при облучении в течение 1 минуты приращение температуры ткани на расстояниях 1,0–1,5 см от границ обрабатываемого участка не достигает критического значения. Вторым непременным условием безопасного воздействия высокоэнергетического излучения ИАГ- лазера при удалении опухолей является периодическое охлаждение раны путем орошения ее физиологическим раствором с последующим удалением перегретой коагулированной части опухоли с помощью ультразвукового аспиратора (УЗА).
Во второй серии экспериментов изучались особенности нагрева ткани головного мозга при воздействии сфокусированным лучом – в режиме вапоризации. После трепанации, вскрытия твердой мозговой оболочки и установки датчика температуры поверхность головного мозга кролика предварительно обрабатывалась расфокусированным лучом мощностью 30 Вт. Среднее время обработки составляло 5 сек. Облученная поверхность бледнела, а спустя 1–2 минуты естественного остывания высыхала.
Вслед за этим проводили основное облучение в режиме вапоризации сфокусированным лучом лазера мощностью 30 Вт. При воздействии излучения на периферии пятна облучения диаметром 2 мм возникала зона коагуляции, которая быстро карбонизировалась (радиальная ширина кромки карбонизации составляла 1,5–2,0 мм). Далее происходил непосредственный процесс выпаривания, а скорее, выгорания облучаемой зоны. Обрабатываемая поверхность ярко светилась, дымила, в зоне воздействия образовывался кратер в виде расширяющегося вверх конуса с карбонизированными стенками. При увеличении времени облучения было отмечено, что процесс выпаривания заметно замедляется и почти прекращается при образовании выраженного слоя карбонизации. После удаления сгоревших тканей и продолжения облучения размеры кратера вновь нарастали.
Одновременно, как и в первой серии опытов, регистрировалось время остывания облученных тканей при их орошении физиологическим раствором. Полученные данные приведены на рис. 3.
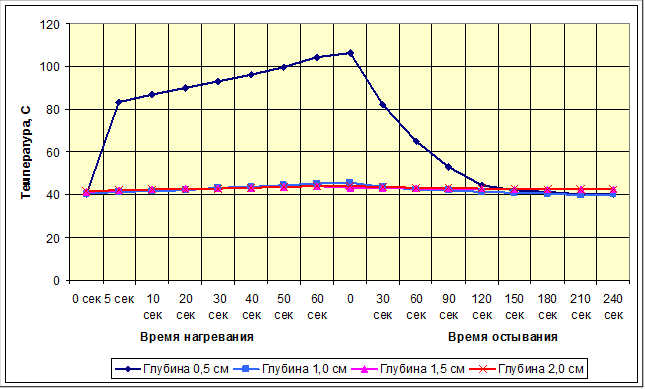
Рис. 3. Зависимость температуры ткани головного мозга на различных глубинах от времени облучения сфокусированным лучом ИАГ-лазера мощностью 30 Вт и последующего охлаждения физиологическим раствором
После воздействия сфокусированным лучом лазера мощностью 30 Вт в поверхностном слое толщиной до 0,5 см облучаемого участка ткани мозга наблюдалось резкое – в течение 5 секунд – повышение температуры до 83,3 оС. Дальнейшее облучение в течение минуты приводило к повышению температуры мозга на этой же глубине до 104,5 ºС. По истечении минуты приращение температуры достигало 64,2 ºС. На глубине 1,0 см после воздействия сфокусированным лазерным лучом той же мощности в течение 1 минуты температура ткани повышалась до 45 ºС, а среднее приращение температуры (4.3 ºС) не превышало критических показателей. В более глубоких слоях мозга (1,5 и 2,0 см) значения температуры незначительно отклонялись от исходных значений. Приращения температуры на этих глубинах не достигали критических уровней. Так, на глубине 1,5 и 2.0 см при максимальном времени облучения оно составляло 2,7 и 2,1 ºС соответственно. Для снижения температуры тканей в поверхностных слоях (0,5–1,0 см) до исходной требовалось орошение поверхности нагретого участка мозга физиологическим раствором в течение 240 секунд. В глубинных слоях мозга (1,5–2,0 см) температура из-за отсутствия нагрева ткани практически не повышалась.
Из представленных данных видно, что процессы нагрева подлежащих тканей при облучении поверхности мозга сфокусированным и расфокусированным пучком протекают схожим образом. Вместе с тем обращает на себя внимание тот факт, что при одинаковых мощности и продолжительности облучения глубинные слои мозга в первом случае подвергаются меньшему нагреву. Причиной такого различия является меньший прогреваемый объем вещества мозга при фокусировании луча и потеря части этого объема в процессе облучения за счет испарения.
Скорость охлаждения во второй серии опытов была ниже, для полного остывания требовалось 4–4,5 мин, т.е. несколько больше, чем в предыдущих экспериментах, – вероятно, за счет образования зоны карбонизации с низкой теплопроводностью. Из анализа результатов проведенных экспериментов просматривается возможность исключить термические повреждения глубжележащих структур мозга при лазерной вапоризации, увеличив продолжительность принудительного охлаждения. С учетом этого, при проведении такого рода операций у человека будет целесообразным во время операции защищать жизненно важные структуры мозга в ране от термического поражения ватными полосками, пропитанными кровью пациента, используя высокую поглощательную способность гемоглобина.
Отличие воздействия лазерного излучения инфракрасного спектра и монополярной коагуляции проверялось в экспериментах с третьей группой животных. Монополярная коагуляция в обычном для ткани мозга режиме в течение минуты изменяла температуру вокруг электрода незначительно: на глубине до 0,5 см – на 15–18 оС, а на глубине до 1,0 см максимально на 1,5–2,0 оС. В полутора сантиметрах от электрода изменений температуры не отмечено. Увеличение мощности или времени воздействия приводило к быстрой карбонизации и пригоранию ткани к пинцету. После образования корки обугливания повышение температуры практически прекращалось. Дополнительным свидетельством несущественного повышения температуры за пределами зоны манипуляции служило возобновление кровотечения из раны при удалении нагара.
Карбонизация требует большего времени и протекает медленнее при воздействии на более плотную, чем мозг, ткань опухоли, что приводит к дополнительному расширению зон нагрева и коагуляции. Но и в этом случае невозможно обеспечить достаточно глубокую коагуляцию ткани для последующей бескровной работы с помощью УЗА, так как, по данным G.Mtiller [11], фототромбоз и сварка тканей происходят при температуре 45–60 ºС, а эффективная фотокоагуляция при 60–100 ºС. Эти данные и объясняют низкие возможности монополярной коагуляции при сохраненном кровотоке по сосуду. При наличии достаточно крупного сосуда внутри опухоли эффективная коагуляция его этим способом будет значительно затруднена. Наряду с этим использование монополярной коагуляции продуктивно лишь в сухой ране.
Если монополярная коагуляция позволяет осуществить гемостаз только на поверхности кровоточащей ткани и не обеспечивает объемного коагулирующего эффекта, что затрудняет работу при удалении больших кровоточивых новообразований, то применение излучения ИАГ-лазера изменяет ситуацию кардинальным образом. Облучение ткани происходит без введения в рану какого-либо инструмента, а, следовательно, исключает дополнительную тракцию мозга. Облучение и коагуляция венозных сосудов диаметром до 5 мм и артериальных до 1 мм, по данным [12], могут быть обеспечены при сохраненном кровотоке в сосуде. Коагуляция ткани происходит даже в условиях умеренного продолжающегося кровотечения. При этом глубина прогревания ткани мозга, достаточная для коагуляции сосудов с помощью инфракрасного лазерного излучения, составляет около 5 мм, что позволяет в дальнейшем удалять поверхностный слой с помощью УЗА, не опасаясь интенсивного кровотечения при кусковании опухоли. Кроме того, использование лазера в режиме вапоризации позволит значительно облегчить удаление плотной ткани менингиомы, неподдающейся разрушению ультразвуковым аспиратором.
Заключение. Обобщая результаты экспериментальных исследований динамики нагрева ткани головного мозга при облучении ИАГ-лазером, можно констатировать, что наиболее приемлемой для практики является мощность излучения 30 Вт. Использование расфокусированного лазерного луча данной мощности позволяет проводить с равной эффективностью, как коагуляцию, так и вапоризацию новообразования без риска критического повышения температуры в прилегающих участках ткани головного мозга (на расстоянии 1,0 см от места воздействия луча). Учитывая значительные различия в поглощательной способности здоровых тканей мозга и опухолевых тканей, в том числе и менингиом, избирательную поглощаемость лазерного света с длиной волны 1,06 мкм гемоглобином и выраженное рассеяние излучения в тканях, можно с уверенностью говорить о возможности безопасного использования лазерного света при удалении церебральных менингиом.
С целью сокращения времени проведения операции и безопасной работы с ИАГ-лазером в высокоэнергетических режимах необходимо обязательное охлаждение раны путем орошения ее физиологическим раствором с последующим удалением коагулированного фрагмента опухоли с помощью УЗА. Дополнительной мерой повышения безопасности применения лазерного излучения при резекции интракраниальных менингиом является защита прилегающих участков ткани мозга ватниками, смоченными кровью больного.



