Распространенность хронического лимфолейкоза (ХЛЛ) увеличивается с каждым годом. Ежегодная заболеваемость ХЛЛ составляет 3 – 3,5 на 100 тыс. населения, а среди лиц старше 65 лет – до 20 на 100 тыс. населения. Около 70 % пациентов заболевают между 50 и 70 годами. Средний возраст к началу заболевания составляет 55 лет. Только менее 10 % заболевают в возрасте моложе 40 лет [2].
В патогенезе ХЛЛ большую роль играет стромальное микроокружение, одним из наиболее важных компонентов которого являются волокна соединительной ткани, гиперпродукция которых может обусловливать развитие миелофиброза (МФ). Частота встречаемости МФ при ХЛЛ считается небольшой: от 10 до 20 %. При этом МФ у пациентов с ХЛЛ ассоциирован с более тяжелым течением заболевания и меньшей выживаемостью. Выраженный МФ чаще, чем начальный, сочетается с анемией и тромбоцитопенией [9].
Патогенез и клиническая значимость МФ при ХЛЛ изучены недостаточно. Известно, что взаимоотношения «строма – паренхима» в системе гемолимфопоэза являются базисными для нормального развития и созревания миелоидных и лимфоидных клеток. Стромальные дефекты могут играть ключевую роль в развитии гемобластозов [6]. Поэтому необходимо дальнейшее более углубленное изучение патогенетических взаимосвязей опухолевой прогрессии и изменений, происходящих в костномозговом микроокружении, определение патогенетической и клинико-лабораторной значимости этих изменений.
Цель исследования – определение взаимосвязей между выраженностью МФ и клинико-лабораторными характеристиками ХЛЛ.
Материал и методы исследования
Обследовано 80 пациентов с ХЛЛ в дебюте заболевания (55 мужчин, 25 женщин, от 42 до 79 лет, средний возраст – 59,2±1,2 лет), находившихся на лечении в ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» с 2006 по 2013 год. Верификацию диагноза ХЛЛ и определение стадии заболевания осуществляли согласно стандартным критериям [7]. Диагноз опухоли устанавливали на основании результатов исследования биопсийного или операционного материала. Клинико-морфологические исследования выполнены с информированного согласия испытуемых и в соответствии с этическими нормами Хельсинской Декларации (2000 г.).
Проведены цитологические, гистологические и иммуногистохимические исследования костного мозга. Больным с установленным морфологическим диагнозом проводили клиническое, лабораторное, инструментальное обследование, в том числе компьютерную томографию, ультразвуковое исследование. Стадия А наблюдалась у 7 пациентов с ХЛЛ, стадия В – у 54 пациентов, стадия С – у 19 больных.
Наличие анемии у пациентов регистрировали при уровне гемоглобина в периферической крови менее 120 г/л. Для определения степени тяжести анемии использовали классификацию ВОЗ: легкая анемия – Hb ≥ 95 г/л, умеренная – 80–94 г/л, выраженная – 65–79 г/л и тяжелая – менее 65 г/л.
Для исследования показателей центрального и периферического звеньев эритрона использовали мазки периферической крови и аспираты костного мозга, окрашенные по Романовскому – Гимзе. Подсчет показателей гемоглобина и эритроцитов осуществляли на гематологическом анализаторе «Sysmex XT - 2000i».
Подсчет миелокариоцитов костного мозга осуществляли в камере Горяева. Подсчет эритрокариоцитов проводили на 400 ядросодержащих клеток костного мозга.
Степень МФ устанавливали согласно шкале Европейского консенсуса [10]. Автоматизированное морфометрическое исследование МФ проводили согласно разработанному нами способу [1] с использованием компьютерной программы анализа изображений AxioVision 4.6, цифровой камеры AxioCam, микроскопа Axio Imager A2 (Carl Zeiss).
На парафиновых срезах трепанобиоптатов подвздошной кости, толщиной 4 мкм, импрегнированных серебром по методу Гомори и окрашенных по методу ван Гизона, при увеличении в 200 раз измеряли абсолютную площадь фиброзной ткани. Абсолютную площадь гемопоэтической ткани измеряли на срезах, окрашенных гематоксилином и эозином. Изучали все костномозговые полости одного среза, что соответствовало 5–7 полям зрения микроскопа и 20–30 полям зрения камеры (в зависимости от размера среза). Площадь одного поля зрения камеры составляла 364 000 мкм2 (0,7 мм2). После сложения площадей фиброзной ткани во всех полях зрения камеры получали суммарную абсолютную площадь фиброзной ткани в пределах одного среза. Аналогичным образом определяли суммарную абсолютную площадь гемопоэтической ткани. Затем вычисляли относительную площадь фиброзной ткани: Sотн.фибр.тк. = Sфибр.тк./.Sгемопоэт.тк. х 100 %, где Sфибр.тк. – суммарная абсолютная площадь фиброзной ткани, Sгемопоэт.тк. – суммарная абсолютная площадь гемопоэтической ткани. Относительная площадь фиброзной ткани характеризовала распространенность МФ.
Миелофиброз 1-й степени расценивали как начальный фиброз, МФ 2-й и 3-й степеней – как выраженный [9].
Статистическую обработку данных проводили с помощью программы SPSS (версия 17.0). Результаты представлены в виде M±σ, где М – среднее арифметическое значение, σ – стандартное отклонение. Проверку соответствия выборок анализируемых данных по нормальному закону распределения проводили по критерию Шапиро – Уилка. Сравнения средних значений различных выборок производили с помощью U-теста по методу Манна и Уитни (непараметрического теста), который применяется там, где выборки из переменных не подчиняются нормальному распределению. Связь между двумя переменными определяли с помощью коэффициентов корреляции Пирсона и Спирмана. Для однофакторного и многофакторного анализа использовали модель логистической регрессии. Критериями достоверности считали значения вероятности ошибки р<0,05 и отношения шансов (OR)>1,0.
Результаты исследования и их обсуждение
Все пациенты в дебюте ХЛЛ были разделены на 2 группы: 1-я группа – без МФ (77,5 % (62 человека)), вторая группа – с МФ (22,5 %, 18 человек). Чаще встречалось сочетание начального и выраженного МФ – 44,4 % (8 человек). Начальный МФ наблюдался в 33,3 % случаев (6 человек), выраженный МФ – в 22,3 % (4 человека).
Гепатомегалия, спленомегалия и генерализованная лимфаденопатия при ХЛЛ наиболее часто встречались у пациентов с МФ по сравнению с пациентами без МФ (рисунок). Выраженный МФ во всех случаях был ассоциирован с гепатомегалией и спленомегалией (р=0,012, OR 79,15, 95% CI 5,06 – 348,12). Наибольшая площадь селезенки отмечена при выраженном МФ, наименьшая – при отсутствии МФ (табл. 1).
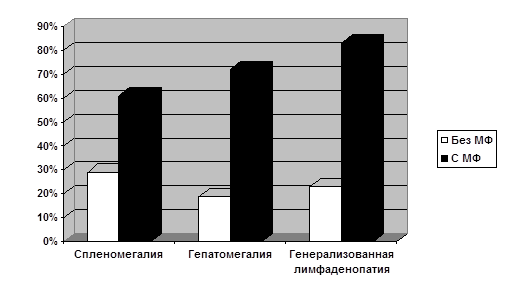
Частота встречаемости гепатомегалии, спленомегалии и генерализованной лимфаденопатии при хроническом лимфолейкозе в зависимости от наличия миелофиброза
Таблица 1
Площадь селезенки при миелофиброзе (МФ) различной выраженности (по данным ультразвукового исследования) (M±m)
|
Выраженность миелофиброза |
Площадь селезенки, см2 |
|
1. МФ-0, n=62 |
44,8±10,9 |
|
2. Начальный МФ, n=10 |
53,1±11,4 |
|
3. Выраженный МФ, n=8 |
64,5±12,7 |
|
4. Контрольная группа, 10 |
32,1±10,2 |
|
р1,2=0,038 р1,3=0,006 р2,3=0,004 р1,4=0,029 р2,4=0,006 р3,4=0,017 |
Наибольшие размеры печени по данным ультразвукового исследования обнаружены при выраженном МФ, наименьшие у пациентов с отсутствием МФ (табл. 2). Размеры печени у пациентов без МФ не отличались от аналогичных размеров контрольной группы.
Относительная площадь фиброзной ткани у пациентов с начальным МФ прямо коррелировала с площадью селезенки, а также с передне-задним размером правой доли печени и передне-задним размером левой доли печени (r=0,436, р=0,007, r=0,622, р=0,039 и r=0,504, р=0,015 соответственно). У пациентов с выраженным МФ также выявлена положительная корреляция этих параметров (r=0,518, р=0,002, r=0,705, р=0,002 и r=0,544, р=0,047).
Таблица 2
Размеры печени при миелофиброзе различной выраженности (по данным ультразвукового исследования) (M±m)
|
МФ |
Передне-задний размер правой доли, см |
Передне-задний размер левой доли, см |
|
1. МФ-0, n=62 |
11,2±3,0 |
5,9±1,1 |
|
2. Начальный МФ, n=10 |
13,5±3,7 |
7,9±1,4 |
|
3. Выраженный МФ, n=8 |
17,9±4,4 |
8,6±3,0 |
|
4. Контрольная группа, n=10 |
11,5±1,8 |
6,4±1,2 |
|
р1,2=0,024 р1,3=0,007 р2,3=0,001 р1,4=0,127 р2,4=0,045 р3,4=0,006 |
р1,2=0,006 р1,3=0,023 р2,3=0,007 р1,4=0,518 р2,4=0,035 р3,4=0,007 |
Относительная площадь фиброзной ткани как у пациентов с начальным, так и у пациентов с выраженным МФ оказалась наибольшей при стадии С (табл. 3). При этом S отн. фибр. тк. у пациентов с начальным МФ превысила S отн. фибр. тк. у пациентов с выраженным МФ.
Таблица 3
Относительная площадь фиброзной ткани у пациентов с начальным и выраженным миелофиброзом при различных стадиях хронического лимфолейкоза (M±σ)
|
Стадия ХЛЛ |
Относительная площадь фиброзной ткани, % |
|
|
при начальном МФ |
при выраженном МФ |
|
|
1.Стадия А, n=7 |
5,3±6,4 |
2,2±3,4* |
|
2. Стадия В, n=54 |
14,6±26,7 |
10,3±17,8* |
|
3. Стадия С, n=19 |
18,9±23,5 |
12,7±15,8* |
|
р1,2=0,041 р1,3=0,007 р2,3<0,001 |
р1,2=0,013 р1,3=0,007 р2,3=0,034 |
|
|
Примечание. * – p<0,05 по сравнению с показателем у пациентов с начальным МФ. |
||
В дебюте ХЛЛ Sотн. фибр. тк. у пациентов с начальным МФ прямо коррелирует с содержанием лимфоцитов в миелограмме (r=0,590, p=0,011), числом лимфоцитов в периферической крови (r=0,837, p=0,041), Sотн. фибр. тк. у пациентов с выраженным МФ прямо коррелирует с содержанием лимфоцитов в миелограмме (r=0,772, p=0,016), числом лимфоцитов в периферической крови (r=0,510, p=0,010).
Наименьшее общее число эритроидных клеток в костном мозге, по данным миелограммы, наименьший уровень эритроцитов в периферической крови и наименьший уровень гемоглобина обнаружены при выраженном МФ, наибольшие значения данных показателей обнаружены у пациентов без МФ (табл. 4). Все показатели эритрона в дебюте ХЛЛ оказались меньше, чем в группе контроля.
Обнаружена обратная корреляция между Sотн. фибр. тк. у пациентов с начальным МФ и уровнем гемоглобина (r=-0,562, p=0,043), между Sотн. фибр. тк. у пациентов с выраженным МФ и уровнем гемоглобина (r=-0,446, p=0,025).
Таблица 4
Показатели эритрона в дебюте хронического лимфолейкоза у пациентов с миелофиброзом (МФ) различной выраженности (M±m)
|
МФ |
Общее число эритроидных клеток в костном мозге в дебюте ХЛЛ по данным миелограммы, % |
Эритроциты в периферической крови в дебюте ХЛЛ, х 109/л |
Гемоглобин в дебюте ХЛЛ, г/л |
|
1. Отсутствие МФ, n=62 |
17,9±3,2 |
3,8±1,4 |
112,4±5,8 |
|
2. Начальный МФ, n=10 |
15,4,8±2,7 |
3,1±0,2 |
106,3±4,7 |
|
3.Выраженный МФ, n=8 |
12,1±2,5 |
2,6±0,8 |
85,2±6,7 |
|
4. Контрольная группа, n=10 |
20,6±2,2 |
5,4±1,1 |
134,5±5,3 |
|
р |
p1,2=0,012 p2,3=0,035 p1,3=0,028 р1,4=0,019 р2,4=0,008 р3,4=0,005 |
p1,2=0,004 p2,3=0,006 p1,3=0,007 р1,4=0,011 р2,4=0,006 р3,4=0,001 |
p1,2=0,035 p2,3=0,008 p1,3=0,017 р1,4=0,024 р2,4=0,049 р3,4=0,003 |
В дебюте ХЛЛ у пациентов как с начальным МФ, так и с выраженным МФ Sотн. фибр. тк. была наибольшей при тяжелой анемии (табл. 5). Относительная площадь фиброзной ткани у пациентов с начальным МФ больше, чем у пациентов с выраженным МФ при выраженной и тяжелой анемии.
Таблица 5
Относительная площадь фиброзной ткани у пациентов с начальным и выраженным миелофиброзом в дебюте хронического лимфолейкоза при анемии различной степени выраженности (M±σ)
|
Анемия |
Относительная площадь фиброзной ткани, % |
р´ |
|
|
при начальном МФ |
при выраженном МФ |
||
|
1.Нет, n=19 |
7,9±20,1 |
6,9±19,3 |
р´=0,128 |
|
2.Легкая, n=28 |
10,6±19,5 |
9,4±15,1 |
р´=0,084 |
|
3.Умеренная, n=16 |
14,7±21,4 |
10,1±13,3 |
р´=0,251 |
|
4.Выраженная, n=10 |
29,4±18,7 |
12,5±12,4 |
р´=0,005 |
|
5.Тяжелая, n=8 |
42,5±34,6 |
23,1±20,9 |
р´=0,007 |
|
р |
р1,2=0,094 р1,3=0,637 р1,4=0,082 р1,5=0,048 р2,3=0,086 р2,4=0,704 р2,5=0,002 р3,4=0,543 р3,5=0,033 р4,5=0,027 |
р1,2=0,572 р1,3=0,439 р1,4=0,079 р1,5=0,018 р2,3=0,086 р2,4=0,128 р2,5=0,032 р3,4=0,218 р3,5=0,040 р4,5=0,008 |
|
Таким образом, показана взаимосвязь МФ и клинико-лабораторных проявлений ХЛЛ. Обнаружено, что гепатомегалия, спленомегалия, генерализованная лимфаденопатия и анемия при ХЛЛ наиболее часто встречаются у пациентов с МФ по сравнению с пациентами без МФ. Выраженный МФ всегда ассоциирован с гепатомегалией и спленомегалией.
Распространенность МФ коррелирует с размерами печени и селезенки. Стадия С ХЛЛ характеризуется наибольшей распространенностью как начального, так и выраженного МФ.
Выявленные ассоциации и корреляции свидетельствуют о тесной взаимосвязи гиперпластического синдрома, обусловленного ростом опухоли, и миелофиброза. Аналогичные взаимосвязи были выявлены некоторыми авторами при хроническом миелолейкозе, множественной миеломе [1], идиопатическом МФ [5].
Что касается ХЛЛ, то также имеются данные о взаимосвязях клинико-лабораторных показателей и МФ. Обнаружено, что более выраженный МФ ассоциирован с большим уровнем сывороточного β2-микроглобулина. Выявлена ассоциация развернутой стадии ХЛЛ и выраженного ретикулинового фиброза. Выраженный МФ чаще встречается у пациентов с тромбоцитопенией. У пациентов с МФ 2–3-й степени средний уровень гемоглобина (117 г/л) достоверно ниже среднего уровня гемоглобина (127 г/л), характерного для МФ 0-1 [9].
Полученные нами результаты объясняются тем, что естественное течение ХЛЛ сопровождается увеличением содержания соединительнотканных волокон в костном мозге. Степень МФ отражает один из этапов развития, на котором было выявлено заболевание [9]. Одно из объяснений угнетения эритрона на фоне МФ заключается в вытеснении соединительнотканными волокнами и опухолевой тканью гемопоэтических клеток. По аналогии с другими лейкозами при опухолевом поражении костного мозга развивается «синдром занятого места» [3, 4] с проявлениями в виде гипоплазии нормальных ростков кроветворения.
Нами также установлено, что у пациентов в дебюте ХЛЛ наибольшее угнетение как центрального, так и периферического звеньев эритрона наблюдается при выраженном МФ, характеризующимся меньшей распространенностью, чем начальный. Угнетение эритропоэза не во всех случаях объясняется исключительно механическим «вытеснением» нормального кроветворения. Среди механизмов, негативно влияющих на костномозговое звено эритрона, ведущую роль играют провоспалительные цитокины, такие как сосудисто-эндотелиальный фактор роста и ИЛ-6 [8], индуцирующие неэффективный эритропоэз. По мере прогрессирования заболевания увеличивается концентрация провоспалительных цитокинов, что и объясняет более сильное угнетение эритрона у пациентов с выраженным МФ по сравнению с начальным МФ.
Таким образом, обнаружено, что гепатомегалия, спленомегалия, генерализованная лимфаденопатия и анемия наиболее часто встречаются у пациентов с МФ по сравнению с пациентами без МФ. Распространенность МФ прямо коррелирует с размерами печени и селезенки. Стадия С хронического лимфолейкоза характеризуется наибольшей распространенностью как начального, так и выраженного МФ. Степень угнетения центрального и периферического звеньев эритрона наряду с другими факторами зависит от распространенности и выраженности МФ.



