До настоящего времени послеоперационный адгезиогенез является актуальным и нерешенным вопросом хирургии [2,3]. Послеоперационный спаечный процесс, являясь по сути физиологическим явлением, в ряде случаев приобретает патологические проявления, выражающиеся в развитии различных форм спаечной болезни.
Особенно остро проблема образования перитонеальных сращений стоит в хирургической гинекологии, так как именно гинекологические операции сопровождаются наибольшим риском спайкообразования, зачастую выходящего за пределы малого таза. Так, после перенесенной аппендэктомии брюшные спайки развиваются в 28,68 – 90 % случаях [6], в то время как частота образования послеоперационных спаек после гинекологических операций составляет 95–100 %.
Цель исследования
В эксперименте получить новые данные по особенностям послеоперационного внутрибрюшинного спайкообразования в условиях эстрогенной недостаточности для обоснования метода профилактики спаек.
Материал и методы исследования
Эксперимент выполнялся на базе кафедры оперативной хирургии и топографической анатомии Волгоградского государственного медицинского университета.
На экспериментальном этапе нами были использованы 90 половозрелых самок крыс линии Вистар. Животные были разделены соответственно объему операционной травмы на 3 равные по количеству группы (по 30 животных в каждой).
1 группа: животным экспериментально воспроизводилась стандартная операционная травма, включающая десерозирование участка париетальной брюшины в области правого отдела передней боковой брюшной стенки и висцеральной брюшины купола слепой кишки, дистальной части подвздошной кишки (до появления «кровавой росы») размером 0,5 × 0,5 (Рис.1).
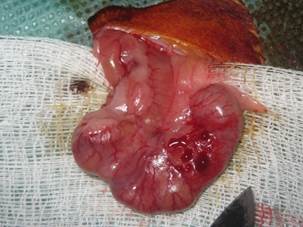
Рис.1.Травма участка висцеральной брюшины слепой кишки
Во 2 группе животным выполнялся расширенный объем операционной травмы, достигаемый стандартной операционной травмой и ампутацией матки без придатков.
После выполнения лапаротомии идентифицируется тело матки с расположенными на ее боковых поверхностях правой и левой маточными артериями. Капроновая лигатура накладывается на тело матки выше ее шейки и затягивается тремя узловыми швами (Рис. 2).
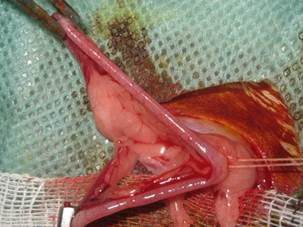
Рис. 2. Идентификация тела матки с правой и левой маточными артериями, наложение лигатуры на тело матки выше шейки
Аналогичные швы накладываются на правую и левую маточные трубы ниже яичника, не захватывая в лигатуру яичниковую артерию (Рис. 3).
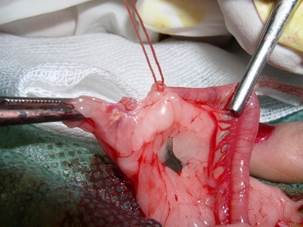
Рис. 3. Наложение швов на маточные трубы ниже яичника без захвата яичниковой артерии
Следующим этапом выполняется пересечение маточных труб и тела матки между наложенными лигатурами и кровоостанавливающими зажимами «Маскит». Пересечением широкой связки матки завершается ее ампутация с оставлением яичников.
3 группу составили животные с экспериментальной моделью, сочетающей расширенный объем операционной травмы с недостаточностью половых гормонов, что достигается путем ампутации матки с яичниками. Модель отличается от предыдущей следующим: лигатуры накладываются на правую и левую связки яичника, содержащие яичниковые артерии (Рис. 4).
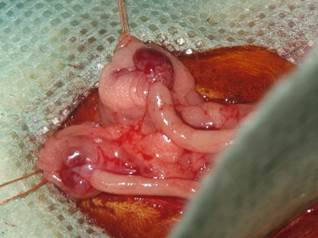
Рис. 4. Наложение швов на маточные трубы выше яичника вместе с яичниковой артерией
После чего выполняется пересечение яичниковых связок и тела матки между наложенными лигатурами и кровоостанавливающими зажимами «Маскит». Пересечение широкой связки матки завершает ее ампутацию с яичниками.
В качестве методики исследования нами былприменен метод экспериментального моделирования спайкообразования при недостаточности половых гормонов, разработанная на базе Волгоградского Научного Медицинского центра в 2009 году [5]. Методика реализована путем сравнения результатов в параллельно выполняемых 3 экспериментальных группах, учитывающих разный объем операционной травмы.
У животных всех экспериментальных групп на 10, 20 сутки (изучение процесса адгезиогенеза в динамике операционной травмы) и на 30 сутки (время окончательного формирования перитонеальных сращений) производилась ревизия брюшной полости, определялся морфологический тип каждой обнаруженной спайки, рассчитывался уровень спаечного процесса.
Для подтверждения достоверности полученных результатов проводили пилотное исследование. На 3 крысах изучали уровень спаечного процесса до 45 суток. Получили данные об одинаковом уровне спаечного процесса на 45 и 30 сутки, что подтверждает время окончательного формирования спаек на 30 сутки и соответствует литературным данным.
Все обнаруженные сращения морфотипировались согласно классификации внутрибрюшной адгезии, предложенной А. А. Воробьевым, А. Г. Бебуришвили [4]. Для оценки общего объема спаек, все найденные сращения разделялись на следующие группы: тяжевые, нитевидные, паутинные, пленчатые, плоскостные. Для каждой группы определялась усредненная постоянная величина: для тяжевых, нитевидных и паутинных – это средняя площадь сечения каждого вида спаек, для пленчатых и плоскостных – средняя толщина спаек. При этом для определения общего объема спаек достаточно измерение длины для тяжевых, нитевидных, паутинных спаек и площади для пленчатых и плоскостных.
Для количественной оценки спаечного процесса применена ранее разработанная математическая формула [1]:
Vспаек = Slтяж. p (dтяж / 2) 2 + Slнитч. p (dнитч. / 2) 2 + Slпаут. p (dпаут. / 2) 2 +
+ SSпленч. hпленч.+ SSплоск. hплоск.
где, V – объем, l – длинна спайки, d – диаметр поперечного сечения спайки,
S – площадь спайки, h – толщина спайки, p = 3,14.
Полученные результаты обрабатывали статистически с вычислением средней арифметической.
Результаты исследования
При оценке спаечного процесса у животных 3-х экспериментальных групп было выявлено, что послеоперационные спайки присутствовали у большинства животных (89 % в 1 группе, 91 % во 2 группе и 94 % в 3 группе соответственно). Большинство обнаруженных сращений у животных первой опытной группы были плоскостные и пленчатые. Во 2 и 3 группах идентифицировались плоскостные, пленчатые и нитевидные сращения.
Во всех группах максимальные спаечные изменения наблюдались в зоне операции и мест нанесения операционной травмы, в 3 группе спаечные изменения наблюдались во всей брюшной полости и полости малого таза, особенно в проекции удаленных яичников, около культи матки, часто встречались спаечные конгломераты в области малого таза и в брюшной полости (Рис. 5).
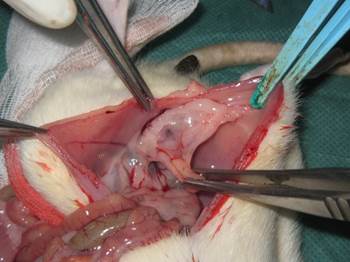
Рис. 5. Спаечный конгломерат в области малого таза
Наиболее частыми спайками во всех экспериментальных группах были сращения большого сальника с лапаротомным рубцом (более 75 % случаев во всех группах). Спайки между большим сальником и мочевым пузырем чаще обнаруживали во 2 и 3 группах. Во 2 группе были верифицированы спайки, которых в 1 группе обнаружено не было: между культей матки и мочевым пузырем, между яичником и большим сальником, между яичником и подвздошной кишкой. В 3 группе также обнаруживались сращения между культей матки и кишкой, не найденные в 1 и 2 группах.
При расчете уровня спаечного процесса в 3-х экспериментальных группах на 10-е, 20-е и 30-е сутки и сравнении его значений в исследуемые промежутки времени, в 3 экспериментальной группе данный показатель был наиболее высоким (таблица).
Уровень послеоперационного спаечного процесса в экспериментальных группах
|
Сутки после-операционного периода |
УСП в 1 группе \ см3 |
УСП во 2 группе \ см3 |
УСП в 3 группе \ см3 |
|
10-е |
0,31±0,01 |
0,48 ±0,013 |
0,58 ±0,012 |
|
20-е |
0,34 ±0,015 |
0,54 ±0,011 |
0,63±0,011 |
|
30-е |
0,36±0,012 |
0,56±0,012 |
0,65±0,013 |
При выполнении стандартной операционной травмы уровень спаечного процесса имел минимальные значения и стал выше при выполнении стандартной операционной травмы, дополненной удалением матки с сохранением яичников. В группе животных со стандартной операционной травмой, дополненной ампутацией матки с яичниками, уровень спаечного процесса был наиболее высоким, что связано с расширенным объемом операционной травмы и сопутствующей недостаточностью половых гормонов, и позволило нам предположить их возможное участие в процессе адгезиогенеза.
Выводы
Проведенные нами экспериментальные исследования показали, что существует прямая зависимость между уровнем послеоперационного спаечного процесса и интенсивностью операционной травмы, однако максимальный уровень послеоперационного спайкообразования был достигнут у животных с удалением яичников и недостаточностью половых гормонов, что позволяет предположить их возможное участие в процессе адгезиогенеза.



