Синдром энтеральной недостаточности (СЭН) является важным патогенетическим компонентом гнойного перитонита, во многом обуславливая развитие эндогенной интоксикации и полиорганной недостаточности, значительно снижающих эффективность лечения пациентов с неотложной абдоминальной патологией [1, 8]. Ведущую патогенетическую роль в развитии СЭН играет активация липопероксидации, возникающая при нарушении микроциркуляции и ишемии кишечной стенки [5, 9]. Повышение уровня активных форм кислорода при острых хирургических заболеваниях сопровождается угнетением антиоксидантной системы организма, что обосновывает целесообразность применения в лечении энтеральной недостаточности препаратов, обладающих антиоксидантными свойствами [3, 7].
Цель исследования – экспериментально-морфологическое изучение эффективности применения антиоксидантных препаратов при синдроме энтеральной недостаточности в условиях калового перитонита.
Материал и методы исследования. Экспериментальные исследования выполнены на 150 половозрелых морских свинках-самцах массой 550–700 гр. в 5 сериях опытов. Моделирование экспериментального калового перитонита осуществлялось по методике Т. С. Поповой [4]. Экспериментальные животные были разделены на пять групп по 30 особей. В первую группу вошли 30 морских свинок с синдромом энтеральной недостаточности (СЭН) на фоне экспериментального калового перитонита без какого-либо лечения. Во вторую группу вошли 30 животных с СЭН на фоне экспериментального калового перитонита, которым через два часа после завершения лапаротомии и далее ежедневно внутривенно вводили 0,9 %-ный раствор хлорида натрия в расчете 6 мл/кг. Третью группу составили 30 животных, которым внутривенно аналогичным способом вводили препарат Рексод®, содержащий рекомбинантную супероксиддисмутазу (РСОД), через 2 часа от начала эксперимента и затем ежедневно в разовой дозе 0,2 мг/кг. Четвертую группу составили 30 животных, которым по указанной схеме вводили раствор аскорбиновой кислоты в дозе 300 мг/кг. Пятая группа включала 30 животных, которым вводили оба препарата: аскорбиновую кислоту и РСОД по аналогичной методике. Контрольную группу составили пять здоровых морских свинок, чьи морфометрические и морфологические показатели оценивали как нормальные.
Для количественной оценки клинического состояния животных в ходе эксперимента была использована шкала, основанная на методике оценки общего состояния лабораторных животных в условиях хирургического опыта [6], сущность которой заключается в выражении наблюдаемых критериев (двигательная активность, реакция на звуковой раздражитель, реакция на болевой раздражитель, пищевое поведение) в баллах. Животных выводили из опыта по 10 особей из каждой группы через 24, 48 и 72 часа от начала эксперимента под глубоким ингаляционным эфирным наркозом.
Материал от экспериментальных животных (дистальный участок подвздошной кишки) подвергали однотипной гистологической обработке. Для светооптических и иммуноцитохимических исследований материал фиксировали в 10 %-ном водном растворе нейтрального формалина, спирт-формоле или жидкости Буэна. Обезвоживание и уплотнение материала производили в этаноле возрастающей крепости и заливали в смесь парафина с воском (1:1). Гистосрезы толщиной 5–6 мкм окрашивали гематоксилином Майера и эозином.
Для идентификации клеток с признаками апоптоза применяли следующие иммуноцитохимические реакции: на определение экспрессии проапоптотического белка р53 и на выявление интернуклеосомальной фрагментации ДНК. Материал фиксировали, обезвоживали и заливали в парафин. Исследование проводили на серийных парафиновых срезах толщиной 5–6 мкм. Срезы инкубировали с моноклональными антителами к р53 ( Daco, Дания) в рабочем разведении 1:50.
Для выявления иммунного окрашивания использовали стрептавидин-биотиновый пероксидазный метод (Daco LSAB- kit, Дания), затем осуществляли докрашивание ядер водным раствором гематоксилина. С целью определения внутриядерной фрагментации ДНК использовали набор реактивов « Apoptag Plusin Situ Apoptosis Detection Kit» ( Intergen, Канада), докрашивание ядер производили 0,5 %-ном раствором метиленового зелёного на 0,1М ацетатном буфере. При постановке Apoptag-теста ядерный хроматин клеток, вступивших в апоптоз, приобретал коричневое окрашивание.
С целью определения экспрессии протеина Ki-67 использовали набор иммуноцитохимических реактивов ( Intergen, Канада), докрашивание ядер производили 0,5 %-ным раствором метиленового зелёного на 0,1М ацетатном буфере. Подсчитывали процент окрашенных клеток на 1000 клеток в случайно выбранных полях зрения. Для оценки пролиферативной активности тканей изучали показатели митотической активности: производили подсчет клеток, находящихся на разных стадиях фаз митоза в нескольких полях зрения, с последующим расчетом доли клеток, претерпевающих митоз.
Статистическая обработка полученных результатов исследования проводилась с помощью программ Microsoft Excel и Statistica 6.0. Данные представлены в виде среднего значения исследуемых величин (М), средней ошибки ( m) для каждого показателя. Результаты исследования были подвергнуты статистической обработке с использованием t-критерия Стьюдента [2]. Для множественных сравнений с учетом поправки Бонферрони использовался критерий вероятности p<0,01 [2].
Результаты исследования и их обсуждение. В ходе проведенного исследования было установлено, что через 24 часа эксперимента тяжесть состояния морских свинок по группам практически не различалась. Начиная со вторых суток наблюдения ухудшение состояния животных, получавших РСОД, аскорбиновую кислоту и комбинацию данных препаратов, происходило в значительно меньшей степени, чем в I и II группах (табл. 1).
Таблица 1
Динамика тяжести клинического состояния экспериментальных животных, M± m, баллы
|
1 сутки |
2 сутки |
3 сутки |
|
|
I группа |
2,55±0,15 |
1,13±0,1 3 |
0,63±0,1 2 |
|
II группа |
2,63±0,06 |
1,44±0,06 |
0,75±0,25 |
|
III группа |
2,69±0,06 |
2,29±0,091,2 |
2,00±0,141,2 |
|
IV группа |
2,66±0,08 |
2,29±0,081,2 |
1,95±0,171,2 |
|
V группа |
2,61±0,08 |
2,22±0,071,2 |
2,06±0,211,2 |
1 – p<0,01 при сравнении с показателями I группы;
2 – p<0,01 при сравнении с показателями II группы.
Летальность среди животных была: в I группе через 1 сут 50 %, через 2 сут – 80 %, через 3 сут 80 % (табл. 2). В группе II соответственно срокам наблюдения погибли от 40 до 80 % животных. В III, IV и V группах летальность составила от 10–20 % (1-е сутки) до 50-60 % (3-и сутки). Таким образом, летальность животных в эксперименте постепенно нарастала с увеличением сроков наблюдения во всех сериях, но общая смертность за весь эксперимент в группах животных, получавших антиоксидантную терапию, была в два раза ниже аналогичных показателей групп сравнения.
Таблица 2
Летальность животных по группам за весь эксперимент
|
Наименование серии опытов |
Срок наблюдения |
||||||||
|
1 сутки |
2 сутки |
3 сутки |
|||||||
|
Кол-во животных |
Из них выжили |
Летальность, % |
Кол-во животных |
Из них выжили |
Летальность, % |
Кол-во животных |
Из них выжили |
Летальность, % |
|
|
I группа |
10 |
5 |
50 |
10 |
2 |
80 |
10 |
2 |
80 |
|
II группа |
10 |
6 |
40 |
10 |
4 |
60 |
10 |
2 |
80 |
|
III группа |
10 |
9 |
10 |
10 |
7 |
30 |
10 |
5 |
50 |
|
IV группа |
10 |
8 |
20 |
10 |
6 |
40 |
10 |
5 |
50 |
|
V группа |
10 |
9 |
10 |
10 |
8 |
20 |
10 |
4 |
60 |
При анализе гистологических препаратов у животных I и II групп через 48 и 72 часа отмечали выраженную гетероморфность структуры ворсинок тонкой кишки. Местами ворсинки были деформированы. Эпителий, покрывающий ворсинки, был уплощен, значительно инфильтрирован лимфоцитами, имел базофильную цитоплазму и высокое содержание рибонуклеопротеидов. Количество бокаловидных клеток увеличивалось, особенно на дне крипт. Большинство эпителиальных клеток имело признаки дистрофических изменений (кариопикноз, кариолизис, везикуляция цитоплазмы). Отек тканей сопровождался локальным слущиванием эпителиоцитов. В некоторых местах возникали некротические изменения тканевых структур слизистой оболочки кишки, иногда проникающие до подслизистой основы и серозной оболочки.
Собственная пластинка слизистой оболочки была резко отечна и также обильно инфильтрирована лимфоцитами и плазматическими клетками. Среди лимфоцитов встречались клетки с признаками бластной трансформации (клетки имели крупные ядра с деконденсированным хроматином, слабо развитыми мембранными ультраструктурами и большим содержанием свободных рибосом). Данные клетки давали позитивную реакцию с иммуноцитохимическим маркером Ki-67, что свидетельствовало об активации гена пролиферации.
В серозной оболочке тонкой кишки отмечалась гиперемия, набухание и отек мезотелия, частичная его десквамация, мелкие кровоизлияния в стромальных компонентах. В кровеносных сосудах микроциркуляции нарастали дистрофические и деструктивные изменения эндотелия, субэндотелиально наблюдалось скопление фибрина.
Кровеносные сосуды микроциркуляторного русла были резко расширены, полнокровны с признаками диапедеза форменных элементов крови, что расценивалось как проявления ангиита. Значительный отек стромальных элементов стенок сосудов сочетался со сладжированием клеточных элементов крови и стазом в гемокапиллярах, тромбозом мелких кровеносных сосудов (рис. 1). Полученные данные свидетельствовали о раннем нарушении микроциркуляции на фоне интенсификации воспаления в стенке тонкого отдела кишечника экспериментальных животных в моделируемых условиях при СЭН, что приводило к усугублению дистрофических и некробиотических поражений эпителиоцитов.
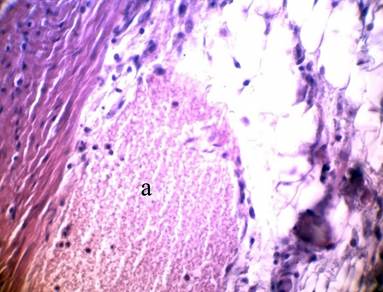
Рис.1. Расширенная затромбированная вена (а) в подслизистой основе тонкой кишки.
Стадия: 2 сут. I группа; Фиксация: 10% раствор нейтрального формалина;
Окраска: перйодат-Шифф-реакция; Увеличение: об. 40, ок. 10
При анализе гистологических препаратов экспериментальных животных контрольных групп отмечалось токсическое повреждение интрамуральных нервных ганглиев (подслизистой основы и Ауэрбаховского межмышечного сплетения). Это проявилось в некробиотических изменениях нейронов и деструкции нервных волокон. Тела отдельных нейронов деформировались, отмечались маргинации гетерохроматина и кариорексис (рис. 2).
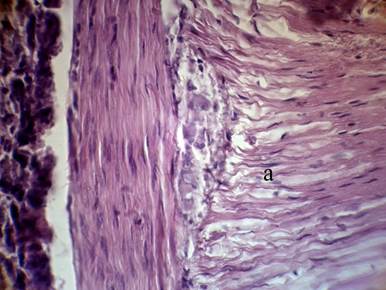
Рис.2. Межмышечное нервное сплетение Ауэрбаха в кишке.
Стадия: 2 сут. II группа; Фиксация: 10 % раствор нейтрального формалина;
Окраска: гематоксилин Майера – эозин, Увеличение: об. 40, ок. 10;
а – гладкие миоциты с признаками отека ипересокращения
Исследуя фрагменты тонкой кишки экспериментальных животных, у которых с целью лечебной коррекции применяли РСОД и высокие дозы аскорбиновой кислоты, отмечены существенные морфологические отличия в развитии репаративных гистогенезов по сравнению с контрольными сериями, они были наиболее выражены в V группе.
Было установлено, что введение экспериментальным животным РСОД или аскорбиновой кислоты существенно компенсировало нарушенный клеточный и тканевой гомеостаз тонкого отдела кишечника. Так, несмотря на сохраняющийся мозаичный характер деструктивных изменений энтероцитов и собственной пластинки слизистой оболочки, отмечалось уменьшение их выраженности (особенно через 72 часа от начала эксперимента). Уменьшалось образование и размеры субэпителиальных пространств Грюнхагена, которые формировались вследствие отслойки эпителиального пласта от базальной мембраны (рис. 3). Снижалось число ворсин с признаками десквамации энтероцитов. В соединительной ткани собственной пластинки слизистой оболочки и подслизистой основы уменьшалась степень дезинтегративных процессов (кровоизлияния, эрозии).
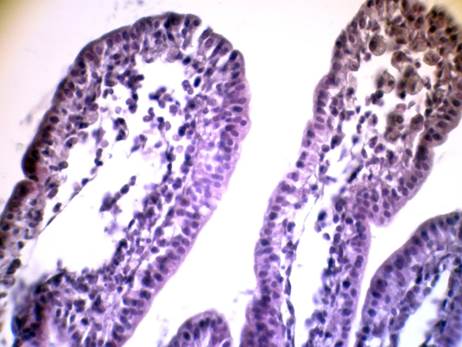
Рис. 3. Ворсинки тонкого отдела кишечника экспериментального животного.
Стадия: 3 сут. V группа; Фиксация: спирт-формол; Окраска: гематоксилин Майера – эозин
Увеличение: об. 40, ок. 10
В криптах появлялись митотически делящиеся клетки, которые перемещались по направлению к вершине ворсинок, заменяя десквамированные участки эпителия. Здесь же регистрировались эпителиоциты и соединительнотканные клетки, экспрессирующие синтез протеина Ki-67, как маркера активизации гена пролиферации (рис. 4).

Рис. 4. Ki-67 позитивные энтероциты (а) и фибробласты (б) в слизистой оболочке тонкой кишки. Стадия: 3 сут. III группа. Увеличение: об. 40, ок. 10
Через 72 часа эксперимента морфометрические показатели (субэпителиальные пространства на верхушках ворсин, десквамация эпителия, эрозии ворсин) состояния кишечной стенки свидетельствовали о постепенном возвращении к норме (табл. 3). Отмечалось уменьшение отека в мышечной оболочке и снижение явлений деструкции гладких мышечных клеток. Сосуды венулярного звена не имели признаков агрегации эритроцитов. Их размеры составляли соответственно 32,3±1,1, 32,8±0,9 и 31,2±1,4 мкм для III, IV и V групп. Следует заметить, что данные сосуды у экспериментальных животных, не получавших лечения, имели размеры 34,8±2,1 мкм, а получавших физиологический раствор хлорида натрия – 33,1±1,9 мкм. Также на восстановление проницаемости микроциркуляторного русла указывало значительное уменьшение межуточного отека и периваскулярной клеточной инфильтрации. При этом эпителиальный покров ворсинок был непрерывным.
Таблица 3
Морфометрические показатели структур тонкой кишки
экспериментальных животных
Сетка Г. Г. Авантадилова, микроскоп МБИ-15, аб. 20, ок. 10, M± m
|
Морфометрический показатель (%) |
Группа экспериментальных животных |
|||||||||
|
1 сутки |
3 сутки |
|||||||||
|
I |
II |
III |
IV |
V |
I |
II |
III |
IV |
V |
|
|
Субэпителиальные пространства на верхушке ворсин |
6,5 ±1,3 |
6,1 ±1,6 |
5,2 ±1,3 |
5,7 ±1,1 |
4,9 ±2,1 |
9,7 ± 1, 5 |
9,9 ±1,4 |
5,3 ±1,6 |
5,0 ±1,1 |
4,3 ±0,9 1,2 |
|
Десквамация эпителия |
20,9 ±3,6 |
21,6 ±4,1 |
20,9 ±3,3 |
20,4 ±2,2 |
19,3 ±2,5 |
33,2 ±2,6 |
29,6 ±3, 2 |
16,7 ±2,6 1,2 |
17,6 ±2,1 1,2 |
15,6 ±3,1 1,2 |
|
Эрозии ворсин |
32,1 ±2,4 |
30,7 ±3,6 |
28,1 ±4,1 |
29,2 ±3,1 |
28,7 ±1,9 |
41,7 ±3, 4 |
39,9 ±3,3 |
27,6 ±2, 31,2 |
26,1 ±2,7 1,2 |
22,7 ±3,7 1,2 |
1 – p<0,01 при сравнении с показателями I группы;
2 – p<0,01 при сравнении с показателями II группы.
Выводы
1. Клинические проявления синдрома энтеральной недостаточности при экспериментальном перитоните уже в ранние сроки сопровождаются нарушениями микроциркуляции в стенке тонкой кишки на фоне интенсификации воспаления, что приводит к усугублению дистрофических и некробиотических поражений эпителиоцитов.
2. Использование в лечении синдрома энтеральной недостаточности у экспериментальных животных рекомбинантной супероксиддисмутазы и высоких доз аскорбиновой кислоты способствует устранению глубоких нарушений микроциркуляции и дистрофически-дегенеративных изменений в стенках сосудов, что сопровождается уменьшением зон повреждения эпителия ворсинок и крипт на фоне восстановительных регенераторных процессов, а также уменьшением отека и деструкции мышечной оболочки, снижением токсического повреждения интрамуральных нервных ганглиев тонкого отдела кишечника.



