Костный мозг является центральным органом гемопоэза и иммунной системы позвоночных животных [4, 10]. Впервые костный мозг, выполняющий дополнительную функцию очага кроветворения, появляется у бесхвостых амфибий (Anura) [10]. Вместе с печенью и лимфоидными узлами костномозговая ткань у амфибий, имеющая в своем составе плазматические клетки, выполняет функцию поставщика стволовых кроветворных элементов для формирования Т- и В-клеточных популяций [2]. Основную часть костного мозга у амфибий составляют жировые клетки – адипоциты (60 %), пигментные клетки и морфологически распознаваемые клетки, начиная с бластных (миелобластов, эритробластов и др.) [4]. Сравнительное изучение клеточного состава костномозговой продукции позволяет оценить не только тканевые взаимоотношения в костном мозге позвоночных животных, но и оценить ответные индивидуальные и популяционные реакции на условия окружающей среды.
Цель работы – оценка клеточного состава миелоидного и эритроидного рядов костного мозга озерных (Pelophylax ridibundus) и травяных (Rana temporaria) лягушек, обитающих в водоемах урбанизированной территории Нижегородской области.
Материалы и методы
Объект исследования – выборки из популяций озерных (Pelophylax ridibundus) и травяных (Rana temporaria) лягушек территории г. Н. Новгорода и Нижегородской области, в разной степени подверженной действию урбанизации и загрязнения. Сбор материала осуществлялся в полевой сезон 2015 года.
1-ая точка сбора – оз. Свято (Нижегородская область, Арзамасский район). Водоем находится на территории Пустынского заказника, входит в систему Пустынских озер бассейна реки Серёжа.
2-ая точка сбора – оз. Парковое (г. Н. Новгород, Автозаводский район). Создано искусственно на месте выемки песка для жилого массива. Расположено в парковой зоне и находится под воздействием рекреационной нагрузки. Водоохранная зона хорошо озеленена. Вода озера мало минерализованная, относится к гидрокарбонатному классу. Класс качества воды III (умеренно-загрязненная) [3]. Количественный химический анализ пробы воды, отобранной в период сбора лягушек, был выполнен в Отделе мониторинга за состоянием окружающей среды (нач. отдела Д. Л. Губанов) Комитета охраны окружающей среды и природных ресурсов г. Нижнего Новгорода.
3-ья точка – территория дачного пос. Афонино (г. Нижний Новгород, Нижегородский район). Территория подвержена интенсивной антропогенной нагрузке, находится на территории коллективных садов.
Дифференцированный подсчет клеток костного мозга (в %) проводили по окрашенным по Романовскому – Гимзе препаратам, под микроскопом с иммерсионной системой при общем увеличении х1500. Дополнительно для каждой особи рассчитывали интегральный индекс миелограммы, как отношение суммы клеток миелоидного ростка (миелобласты + промиелоциты + миелоциты+ метамиелоциты) к сумме клеток эритроидного ростка (эритробласты + пронормоциты + нормоциты базофильные + нормоциты полихроматофильные). Проверка данных на соответствие нормальному распределению проводилась с применением критериев Колмогорова – Смирнова, Лиллиефорса и Шапиро-Уилко. Первичные данные не соответствовали нормальному распределению, поэтому дальнейший статистический анализ осуществляли с помощью непараметрических критериев Крускала – Уоллиса и Данна. Критический уровень значимости (р) принимали = 0,05.
Результаты и их обсуждение
Известно, что общее количество клеток паренхимы костного мозга составляет 98–99%, причем в их число входят как морфологически нераспознаваемые родоначальные элементы, так и морфологически распознаваемые, начиная с бластных (миелобластов, эритробластов и др.) и кончая зрелыми клетками. Все ростки кроветворения начинаются с бластных элементов, продолжаются промежуточными формами созревания и заканчиваются зрелыми клетками [9].
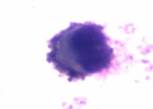
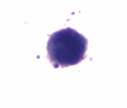
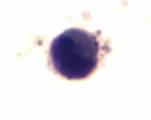
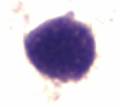
Среди клеток миелоидного ряда в приготовленных мазках дифференцировали: миелобласты, промиелоциты, миелоциты и метамиелоциты. Миелобласты – это родоначальные клетки гранулоцитарного ряда, чаще круглой, реже полигональной формы, отличаются нежной структурой ядер. Ядро содержит 2–5 ядрышек, окрашенных в синий или голубой цвет. Голубая цитоплазма окружает ядро небольшим пояском, содержит умеренное количество неспецифической азурофильной зернистости, имеющей переходные оттенки от красного до фиолетового цвета (рис. 1а). Промиелоциты – ядро фиолетовое, круглое или овальное с эксцентричным или центральным положением, тонкая ядерная мембрана. Цитоплазма голубая. Гранулы азуро-, эозинофильные (рис. 1б). Миелоциты – ядро красно – фиолетовое, овальное или с небольшой выемкой с эксцентричным положением. Неотчетливая ядерная мембрана. Голубовато-розовая цитоплазма (рис. 1в). Метамиелоциты – ядро фиолетовое, толстое, подковообразное или с выемкой с эксцентричным или центральным положением. Ядерная мембрана присутствует (рис. 1г).
|
|
|
|
|
|
а. Миелобласт |
б. Промиелоцит |
в. Миелоцит |
г. Метамиелоцит |
Рис. 1. Клетки миелоидного ростка костного мозга (а, б, в, г)
Среди клеток эритроидного ряда в приготовленных мазках дифференцировали: эритробласты, пронормоциты, базофильные и полихроматофильные нормоциты.
Эритробласты – являются морфологически различными родоначальными клетками элементов эритроидного ростка. Это большие круглые клетки диаметром 15–25 мкм или около 20 мкм и более, имеют большое овальное или круглое ядро, занимающее большую часть клетки, окрашивающееся в темный красно-фиолетовый цвет. Цитоплазма имеет различные размеры, насыщенно-синий цвет с фиолетовым оттенком, с зоной просветления вокруг ядра в некоторых клетках (рис. 2а). Пронормоциты – морфологически близки к эритробластам, но отличаются от них меньшей величиной (12–18 мкм), более грубой структурой ядра. Форма клетки круглая или овальная. Цитоплазма значительной величины, базофильная, окрашивается в синий цвет (рис. 2б). Базофильные нормоциты обычно имеют размеры 10–18 мкм. Ядро круглое, плотное, не содержит нуклеол. Структура ядра более грубая, чем у пронормоцита, с четким разделением на базихроматин и оксихроматин, в результате чего ядро имеет колесовидную структуру. Цитоплазма базофильная, темно- или светло-синяя (рис. 2в). Полихроматофильные нормоциты по размеру меньше базофильных – 9–12 мкм. Форма круглая или овальная. Ядро плотное. Цитоплазма клеток, накапливая гемоглобин, воспринимает кислые краски и в зависимости от степени насыщения гемоглобином при окрашивании приобретает цвет от серовато-синего до серовато-розового – полихроматофилия (рис. 2г).
|
|
|
|
|
|
а. Эритробласт |
б. Пронормоцит |
в. Нормоцит базофильный |
г. Нормоцит полихроматофильный |
Рис 2. Клетки эритроидного ростка костного мозга (а, б, в, г)
При дифференцированном анализе миелограмм выявлено изменение долей клеток разных ростков костного мозга в зависимости от вида лягушек и места их обитания (табл. 1). Так, у озерных лягушек, обитающих в оз. Парковое (г. Н. Новгород, Автозаводский район) наблюдался сдвиг миелограммы в сторону возрастания числа клеток эритроидного ряда (табл.1), что выражалось в увеличении количества незрелых предшественников эритроцитов в 1,7 раз (Z1-2=2,37, р=0,05), пронормоцитов – почти в 2 раза (Z1-2=2,77, р=0,017), базофильных нормоцитов – в 2,2 раза (Z1-2=3,03, р=0,007) по сравнению с особями, обитающими в оз. Свято Пустынского заказника. Известно, что главным поставщиком незрелых эритроидных клеток у амфибий является костный мозг [1]. И с ростом урбанизации у амфибий наблюдается увеличение в периферической крови незрелых форм эритроцитов, что свидетельствует об активации процессов кроветворения [7], обеспечивающего выживание амфибий при постоянном обитании в загрязненной среде.
Таблица 1
Миелограмма амфибий урбанизированной территории
|
Показатели, % |
Pelophylax ridibundus |
Rana temporaria |
Статистические показатели: кр. Крускала –Уоллиса (Н), кр. Данна (Z) |
|
|
1. Оз. Парковое (г.Н. Новгород, Автозаводский район) |
2. Оз. Свято (Нижегородская обл., Арзамасский район) |
3. Пос. Афонино (г. Н.Новгород, Нижегородский район) |
||
|
Клетки миелоидного ряда |
||||
|
Миелобласты |
15,00 ± 2,31 |
28,50 ± 2,84 |
19,20 ± 2,90 |
Н=20,78, p<0,001; Z1-2=4,50, р=0,00002; Z1-3=1,41, р=0,47; Z2-3=3,23, р=0,0036 |
|
Промиелоциты |
6,13 ± 1,12 |
9,30 ± 1,71 |
7,00 ± 0,81 |
Н=5,24; p=0,72; Z1-2=2,26, р=0,70; Z1-3=0,91, р=1,00; Z2-3=1,45, р=0,44 |
|
Миелоциты |
12,13 ± 1,22 |
19,70 ± 3,09 |
29,06 ± 2,57 |
Н=27,73, p<0,001; Z1-2=1,93; р=0,158; Z1-3=5,24, р<0,001; Z2-3=2,75, р=0,018; |
|
Метамиелоциты |
8,53 ± 0,63 |
11,50 ± 2,90 |
9,66 ± 0,87 |
Н=5,38, p=0,67; Z1-2=2,30, р=0,065; Z1-3=1,28, р=0,76; Z2-3=1,14, р=0,60; |
|
Клетки эритроидного ряда |
||||
|
Эритробласты |
21,20 ± 2,54 |
14,20 ± 1,92 |
20,80 ± 1,80 |
Н=6,37, p=0,04; Z1-2=2,37, р=0,05; Z1-3=0,31, р=1,00; Z2-3=2,10, р=0,10; |
|
Пронормоциты |
12,93 ± 1,21 |
6,7 ± 0,32 |
4,67 ± 0,61 |
Н=22,7, p<0,001; Z1-2=2,77, р=0,017; Z1-3=4,64, р<0,00001; Z2-3=1,38, р=0,5; |
|
Нормоциты базофильные |
17,33 ± 1,46 |
7,7 ± 0,67 |
6,53 ± 0,44 |
Н=16,61, p=0,0002; Z1-2=3,03, р=0,007; Z1-3=3,78, р=0,0005; Z2-3=0,35, р=1,00; |
|
Нормоциты полихроматофильные |
4,20 ± 0,56 |
2,3 ± 0,12 |
2,33 ± 0,12 |
Н=2,51; p=0,285; Z1-2=1,33, р=0,55; Z1-3=1,32, р=0,56; Z2-3=0,15, р=1,00; |
|
Интегральный индекс миелограммы |
0,81 ± 0,41 |
2,40 ± 1,17 |
2,01 ± 1,17 |
Н=24,87; р<0,001; Z1-2=4,52, р=0,000018; Z1-3=3,89; р=0,00029; Z2-3=1,03, р=0,89. |
Преобладающими по численности клетками в миелограммах озерных лягушек оз. Свято оказались наименее дифференцированные клетки миелоидного ряда – миелобласты, доля которых возрастала в 1,9 раза (Z1-2=4,50, р=0,00002) по сравнению с озерными лягушками оз. Парковое. Сдвиг миелограммы амфибий в сторону миелоидного роста мог быть вызван либо паразитарными инвазиями, характерными для естественных мест обитаний [7], либо интегральной ответной реакцией организма на особенности водного режима оз. Свято: природного карстового происхождения, непроточного, с высоким содержанием гуминовых кислот.
Статистически значимые различия в клеточном составе миелограмм выявлены у лягушек исследованных видов, обитающих на городской территории. Так, в эритроидном ростке костного мозга озерных лягушек количество пронормоцитов (Z1-3=4,64, р=0,00001) и базофильных нормоцитов (Z1-3=3,78, р=0,0005) почти в 3 раза превышало численность аналогичных клеток в костном мозге травяных лягушек, что свидетельствовало об усилении процессов кроветворения у особей озерных лягушек, обитающих в оз. Парковое (г. Н. Новгород, Автозаводский район). Результаты количественного химического анализа вод оз. Парковое в период отлова лягушек подтвердили превышение ПДК для водоемов рыбохозяйственного назначения по содержанию железа (1,98 ПДК) и марганца (2,22 ПДК), меди (2,7 ПДК), нефтепродуктов (6,6 ПДК). Полученные данные свидетельствовали о специфике адаптивных реакций амфибий двух видов к интегральному воздействию окружающей среды: природным и антропогенным факторам (рис. 3).
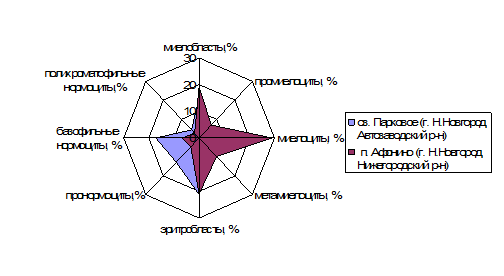
Рис. 3. Различия клеточного состава миелоидного и эритроидного рядов костного мозга озерных и травяных лягушек урбанизированной территории
Миелограммы травяных лягушек урбанизированной территории отличались и от миелограммы озерных лягушек природоохранной зоны, изменением соотношения клеток миелоидного ряда. Так, если у озерных лягушек (оз. Свято) отмечена большая доля миелобластов, то у травяных этот показатель в 1,5 раза ниже (Z2-3=3,23, р=0,0036). И, наоборот, если озерные лягушки природоохранной территории характеризовались небольшой долей миелоцитов в составе костного мозга, то для травяных урбанизированной территории этот показатель был в 1,7 раза выше (Z2-3=2,75, р=0,018) (рис. 4). Рядом работ показано [6, 7], что высокий уровень миелоцитов и клеток эритроидного ряда обуславливает усиление адаптивного потенциала и устойчивость амфибий к условиям урбанизированных ландшафтов, а также способствует освоению новых мест обитаний за пределами естественного ареала.
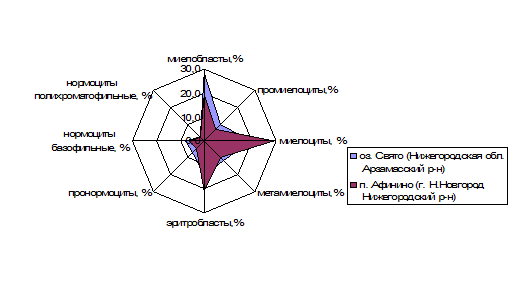
Рис. 4. Различия клеточного состава миелоидного и эритроидного рядов костного мозга озерных лягушек природоохранной зоны и травяных лягушек урбанизированной территории
Интегральный индекс миелограммы свидетельствовал о напряженности компенсаторных процессов в организме амфибий. Снижение этого показателя могло быть связано в самом простом случае с активацией эритроидного ростка гемопоэза, а повышение – с возрастанием доли незрелых клеточных элементов миелоидного ростка. Установлено, что данный показатель имел наименьшее значение у популяции озерных лягушек, обитающих в загрязненном городском оз. Парковое, статистически значимо отличаясь от аналогичного показателя озерных лягушек оз. Свято (Z1-2=4,52 р=0,000018) и травяных урбанизированной территории пос. Афонино (Z1-3=3,89 р=0,00029) (рис. 5). Полученные результаты свидетельствуют о разных возможностях гемопоэтической системы двух видов при загрязнении среды обитания.
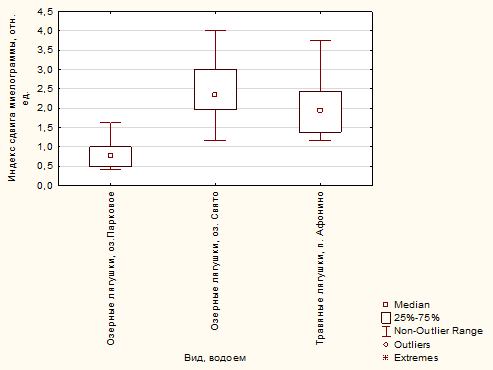
Рис. 5. Интегральные индексы миелограмм амфибий
Подводя итог проведенным исследованиям, можно заключить, что костный мозг, являясь органом гемопоэза и иммунной системы амфибий, активно реагирует на изменение качества условий среды, активацией клеток миелоидного (травяные лягушки) и эритроидного (озерные лягушки) рядов. Выявленные изменения в миелограммах изученных видов определялись как онтогенетическими особенностями, так и спецификой среды обитания, накладывающей отпечаток на физиологическое состояние амфибий.