В настоящее время существует потребность в фундаментальных исследованиях, раскрывающих молекулярные механизмы основных процессов жизнедеятельности, ключевыми из которых являются межмолекулярные взаимодействия. Клеточная сигнализация является решающей практически во всех основных биологических процессах, в частности, проводником между компонентами клетки для поддержания процессов синтеза и распада, трансдукции сигнала, инициации репликации ДНК, транскрипции, трансляции, пролиферации, дифференцировки и адаптации, что определяет актуальность изучения. В то время как многие биохимические взаимодействия ранее были представлены как реакция между белком, ферментом и их субстратами и продуктами, нам известно очень мало о том, как малые молекулы и естественные метаболиты на системном уровне регулируют функции белка. В последнее десятилетие изучение взаимодействий белка с малыми молекулами, в частности, метаболитами было запаздывающим по сравнению с изучением других типов взаимодействий, таких как белок-белковое, белок-ДНК и белок-РНК [7]. На новом этапе изучения проблемы, благодаря научным и технологическим достижениям, мы начали изучать влияние малых молекул на межмолекулярные взаимодействия и получили новые данные, имеющие важное значение в нашем понимании межклеточного взаимодействия. В прикладном отношении в практике клинико-диагностической лаборатории учитывать отклонения в фонде метаболома [1, 6]. На протяжении длительного времени изучения истории метаболизма лактат был рассмотрен лишь как тупиковый метаболит анаэробного катаболизма глюкозы [10]. Однако его колебание в жидких средах организма типично для многих синдромов. Заряд и кислые свойства этого соединения – фактор воздействия на структуру и функцию белков. Актуальным является изучение роли естественных интермедиатов в процессах белок-лигандного взаимодействия. С этой целью применяется молекулярное моделирование и метаболическое зондирование с использованием биогенных молекул низкой молекулярной массы.
Материалы и методы
Метод компьютерного моделирования PASS (Prediction of Activity Spectra for Substances) представляет собой компьютерную программу, позволяющую прогнозировать большое число вероятных видов биологической активности вещества на основе его структурной формулы с использованием единого описания химической структуры и универсального математического алгоритма установления зависимостей «структура-активность». Спектр биологической активности описывается качественным образом: оценивается вероятность наличия (Pa) и вероятность отсутствия (Pi) каждой активности, имеющие значения от 0 до 1. Оптимальным значением вероятности наличия активности мы приняли Pa более 0,5 [3, 9].
Объектом исследования являлась молекулярная модель АВ0 системы с последующим изучением влияния малой молекулы лактата на антиген-антительное взаимодействие (патент на изобретение №2484480 от 10.06.2013) [4]. Определение группы крови системы АВ0 проводилось с использованием моноклональных антител Анти-А, Анти-В методом прямой агглютинации на плоскости с балльной оценкой интенсивности агглютинации по W. Marsh [8], а также на автоматическом анализаторе для проведения иммуногематологических исследований «Хемос СП II» фирмы BIO-Rad. В качестве контроля брали среднее значение времени (в секундах) и степени агглютинации антигенов А и В (по шкале) II, III, IV групп крови с моноклональными антителами. Для изучения биологического действия малых молекул на агглютиногены А, В, изоагглютинины анти-А и анти-В группы крови по системе АВ0 и моноклональные антитела анти-А и анти-В перед постановкой реакции гемагглютинации эритроциты инкубировали с раствором лактата.
Статистический анализ данных проводили в среде статистического пакета прикладных программ SPSS 12.0 и в программе MS EXCEL 2007. Полученные данные были описаны с использованием таких статистических характеристик, как медиана (Ме), средняя арифметическая (М), стандартная ошибка от средней арифметической (m), максимум и минимум, 95 % интервал. Для оценки формы распределения исследуемых показателей использовался графический метод (визуальная оценка гистограмм распределения), оценивались показатели скошенности и крутизны, отражающие асимметрию распределения, тесты на нормальность с помощью критерия Колмогорова – Смирнова с поправкой Лилиефорса и Шапиро – Уилки. Для показателей, имеющих значительные выбросы, при которых некорректно применять классический ANOVA, использовался тест Манна – Уитни (для парных сравнений) с поправкой Бонферони. Критическое значение уровня значимости принимали равным 0,05.
Результаты и их обсуждение
Анализ результатов молекулярного моделирования показал, что у лактата существует вероятность наличия 318 фармакологических эффектов из 501 возможных, 2108 механизмов их реализации из 3295. Выявлено 52 из 57 возможных побочных и токсических эффектов, 177 метаболически опосредованных действий. Нами отмечены 863 биологических эффекта: 52 фармакологических, 756 молекулярных механизмов действия, 25 возможных токсических эффектов и 30 метаболически опосредованных действий (рис. 1 и таблица).

Рис. 1. Спектр прогнозируемых биологических эффектов лактата
Обращает на себя внимание наличие способности у лактата проявлять антацидное действие (Pa 0,932), влиять на процессы созревания клеток: стимулировать лейкопоэз (Pa 0,803) и эритропоэз (Pa 0,673), оказывать иммуномодулирующее (Pa 0,811), противовоспалительное (Pa 0,614), противовирусное влияние в отношении арбовирусов (Pa 0,753), риновирусов (Pa 0,623), пикорнавирусов (Pa 0,558) и папилломавирусов (Pa 0,542). Противовирусная активность лактата предположительно связана с pH-зависимыми перестройками в структуре вируса: при уменьшении pH среды вирус теряет инфекционную активность, при этом связь рибонуклеопротеина с белковым матриксом возрастает, что препятствует процессу репликации [2]. Интересными представляются данные о способности лактата оказывать защитное действие на мембраны клеток организма (Pa 0,544) и кровеносные сосуды (Pa 0,681). Вероятно, реализация данного эффекта возможна путем непосредственного влияния на нейрогенный тонус кровеносных сосудов [5]. Указывается способность лактата проявлять фибринолитическое (Pa 0,716), антитоксическое (Pa 0,559) действия. Возможность лактата оказывать такие биологические эффекты, предположительно, связана с имеющейся в составе гидроксильной группой, выполняющей роль заместителя и обуславливающей способность вступления соединения в реакции нуклеофильного замещения.
Принимая во внимание вышеописанные биологические эффекты лактата, следующей задачей было поставлено изучение молекулярной основы их реализации. Перечень молекулярных механизмов действия лактата представлен в таблице.
Возможные молекулярные механизмы действия лактата
|
Молекулярный механизм действия |
Шифр фермента |
Ра |
Рi |
|
Ингибитор лактат-2-монооксигеназы |
ЕС 1.13.12.4 |
0,935 |
0,001 |
|
Ингибитор фосфоенолпируват фосфотрансферазы |
EC 2.7.3.9 |
0,922 |
0,001 |
|
Ингбитор 1,4-лактоназы |
ЕС 3.1.1.25 |
0,921 |
0,002 |
|
Ингибитор нуклеозид-трифосфотазы |
EC 3.6.1.15 |
0,922 |
0,008 |
|
Ингибитор IgA-специфичной металлоэндопептидазы |
ЕС 3.4.24.13 |
0,898 |
0,003 |
|
Ингибитор L-лактатдегидрогеназы |
EC 1.1.2.3 |
0,892 |
0,001 |
|
Ингибитор пируватдегидрогеназы |
EC 1.2.4.1 |
0,892 |
0,002 |
|
Ингибитор серин-3-дегидрогеназы |
EC 1.1.1.276 |
0,886 |
0,001 |
|
Ингибитор глюкозооксидазы |
EC 1.1.3.4 |
0,889 |
0,006 |
|
Ингибитор НАДФ·Н метилентетрогидрофолатредуктазы |
EC 1.5.1.20 |
0,884 |
0,011 |
|
Ингибитор ацилглицероллипазы |
EC 3.1.1.23 |
0,866 |
0,004 |
|
Ингибитор НАДН цитохром С редуктазы |
EC 1.6.2.5 |
0,862 |
0,004 |
|
Ингибитор аланинтрансаминазы |
EC 2.6.1.2 |
0,83 |
0,003 |
|
Ингибитор Ацил-КоА синтазы |
EC 2.3.1.86 |
0,804 |
0,005 |
|
Ингибитор транскетолазы |
EC 2.2.1.1 |
0,798 |
0,002 |
|
Ингибитор галактозоксидазы |
EC 1.1.3.9 |
0,792 |
0,003 |
|
Ингибитор малатдегидрогеназы |
EC 1.1.1.37 |
0,78 |
0,002 |
|
Ингибитор глициндегидрогеназы |
EC 1.4.1.10 |
0,768 |
0,003 |
|
Ингибитор транс-2-еноил-КоА-редуктазы |
EC 1.3.1.38 |
0,773 |
0,013 |
|
Ингибитор инозитол-трифосфат-3-киназы |
EC 2.7.1.127 |
0,756 |
0,002 |
|
Ингибитор IgA-специфической сериновой эндопептидазы |
EC 3.4.21.72 |
0,754 |
0,005 |
|
Ингибитор орнитинциклодезаминазы |
EC 4.3.1.12 |
0,693 |
0,004 |
|
Ингибитор инсулиназы |
EC 3.2.1.7 |
0,733 |
0,004 |
|
Ингибитор супероксиддисмутазы |
EC 1.15.1.1 |
0,639 |
0,009 |
|
Ингибитор пируваткиназы |
EC 2.7.1.40 |
0,633 |
0,004 |
|
Промотор инсулина |
0,616 |
0,022 |
|
|
Ингибитор триптофантрансаминазы |
EC 2.6.1.27 |
0,551 |
0,005 |
|
Ингибитор фенилаланин-4-гидроксилазы |
EC 1.14.16.1 |
0,544 |
0,004 |
|
Ингибитор цитохром b5 редуктазы |
EC 1.6.2.2 |
0,548 |
0,019 |
Приведенные данные свидетельствуют о том, что лактату присущи различные механизмы влияния на активность факторов, регулирующих внутри- и межклеточные взаимодействия. Отмечается участие лактата в белковом, углеводном и липидном обменах. Широко известно влияние лактата на процессы углеводного обмена, в частности ингибирующее влияние на L-лактатдегидрогеназу (Pa 0,892), пируватдегидрогеназу (Pa 0,892). Однако показано, что кроме этого, молочная кислота оказывает ингибирующее действие и на следующие ферменты: лактат-2-монооксигеназа (Pa 0,935), фосфоенолпируват фосфотрансфераза (Pa 0,922), 1,4-лактоназа (Pa 0,921), глюкозооксидаза (Pa 0,889), транскетолаза (Pa 0,798), галактозооксидаза (Pa 0,792), малатдегидрогеназа (Pa 0,78), инозитол-трифосфат-3-киназы (Pa 0,756), пируваткиназа (Pa 0,633). Интересными стали данные, что лактат является промотором синтеза инсулина (Pa 0,66), ингибирует инсулиназу (Pa 0,77), тем самым, очевидно, поддерживая необходимое количество этого гормона в крови.
Подтверждением участия лактата в регуляции белкового обмена являются факты выявления ингибирующего влияния на ряд ключевых ферментов: нуклеозид-трифосфатазу (Ра 0,922), серин-3-дегидрогеназу (Ра 0,886), аланинтрансаминазу (Ра 0,83), глициндегидрогеназу (Ра 0,768), орнитинциклодезаминазу (Ра 0,693), триптофантрансаминазу (Ра 0,551), фенилаланин-4-гидроксилазу (Ра 0,544). Указывается участие молочной кислоты в процессе ингибирования НАДФ·Н метилентетрагидрофолатредуктазы (Pa 0,88). Таким образом, отмечается влияние лактата не только на процессы катаболизма белка, но и на процессы его синтеза.
Интересным представляется тот факт, что лактат может изменять метаболизм липидов, проявляя ингибирующее влияние на транс-2-еноил-КоА-редуктазу (Pa 0,773), принимающую участие в элонгации жирных кислот в митохондриях и биосинтезе ненасыщенных жирных кислот, на цитохром b5 редуктазу (Pa 0,548), десатуразу, которая участвует в образовании полиненасыщенных жирных кислот, это может служить мощным патогенетическим механизмом нарушений структурных образований в связи с дефицитом полиеновых жирных кислот.
Кроме того, нами было отмечено влияние лактата на состояние антиоксидантных систем организма, в частности на фермент супероксиддисмутазу (Pa 0,639). Являясь ингибитором данного фермента, лактат способен замедлять процесс защиты клеток от реакций свободно-радикального окисления, постоянно протекающих в организме, создавая условия для окислительного стресса, повреждения молекул и структур.
Лактату присуще влияние на процессы тканевого дыхания – ингибирование НАДН цитохром С редуктазы (Pa 0,862), вероятно, тем самым снижая поток электронов по пути окислительного фосфорилирования в митохондриях.
Обращает на себя внимание иммуномодулирующий эффект (Pa 0,811) лактата, реализуемый посредством ингибирования IgA-связанных протеаз: IgA-специфической металлоэндопептидазы (Pa 0,898), IgA-специфической сериновой эндопептидазы.
Изучив in silico потенциальные возможности лактата, мы приступили к серии модельных экспериментов. Оценку влияния естественного метаболита лактата на антиген-антительные комплексы АВ0 системы проводили с учетом изменения степени и скорости наступления агглютинации. Выявлено, что наиболее подвержен воздействию лактата гликопротеин А второй группы крови – время наступления агглютинации увеличилось на 40 %. Гликопротеин В третьей группы крови менее подвержен воздействию внешнего стимула (рис. 2). Антигенные детерминанты А и В четвертой группы крови по разному взаимодействовали с моноклональными антителами: время агглютинации гликопротеина А увеличилось на 51 %, гликопротеина В на 35 %. Степень агглютинации гликопротеинов II–IV групп крови осталась неизменной по сравнению с контрольной и составила 4+. Эритроциты А (II) и АВ (IV) группы, на поверхности которых присутствует гликопротеин А, медленнее вступали во взаимодействие с моноклональными антителами, чем эритроциты В(III) и АВ (IV) групп крови, на мембране которых располагается антигенная детерминанта агглютиногена В.
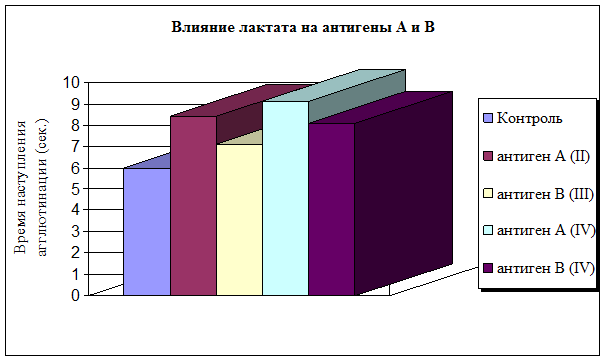
Рис. 2. Влияние лактата на антигены АВ0 системы
Несколько другой эффект вызывает контакт лактата с естественными антителами (рис. 3). Показано, что действие этого метаболита на систему цельной крови вызывает модификацию иммуноглобулинов плазмы человека Полнота взаимодействия с анти-А антителами выше, чем с анти-В антителами, при этом происходит уменьшение степени агглютинации на 41 % и 60 % соответственно по сравнению с исходными значениями.
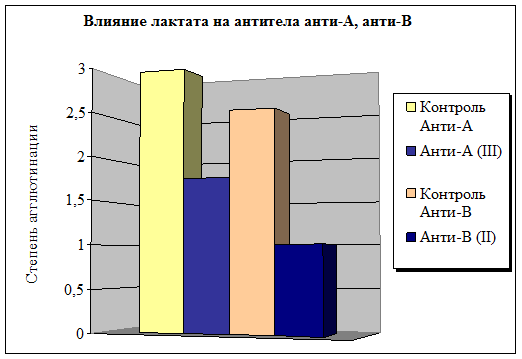
Рис. 3. Влияние лактата на естественные антитела АВ0 системы
Три серии модельных экспериментов по изучению влияния интермедиата на изолированные белки – антигены А и В, моноклональные и естественные антитела показали, что введение лактата в систему антиген-антитело вызывает увеличение времени наступления агглютинации гликопротеина А с соответствующим антителом и снижение ее степени у естественных анти-В антител. По-видимому, выявленные отличия во взаимодействии гликопротеинов с антителами обусловлены особенностями их строения.
Установлено, что преинкубация лактата с моноклональными антителами обуславливает ухудшение узнавания моноклональных антител антигенными детерминантами А и В II–IV групп крови, замедляет время образования антиген-антительных комплексов, а также выраженность степени агглютинации на 75 %. Время взаимодействия эритроцитов А(II) и В(III) группы крови с моноклональными анти-А и анти-В антителами, проинкубированными с лактатом, увеличилось в 20 и 15 раз соответственно. Аналогично влияние лактата на моноклональные антитела с антигенными детерминантами эритроцитов АВ(IV) группы (рис. 4). Исходя из полученных данных, можно предположить, что инкубация с лактатом приводит к структурно-функциональным изменениям благодаря высокой химической активности данной гидроксикислоты, наличию отрицательного заряда. Реально предположить модифицирующее действие на белок за счет неферментативного взаимодействия.
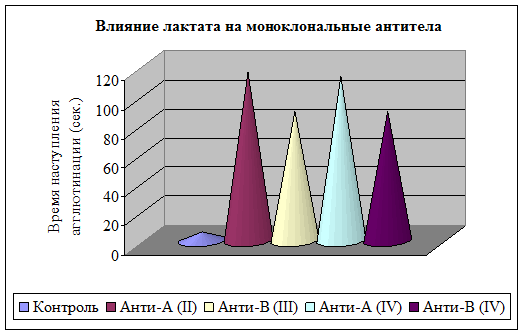
Рис. 4. Влияние лактата на моноклональные антитела
Заключение
Полученные результаты методом компьютерного прогнозирования показывают вероятность влияния лактата на межмолекулярные процессы поддержания метаболического баланса путем регуляции белкового, углеводного, липидного обменов, антиоксидантных процессов, тканевого дыхания. Серия проведенных экспериментов отчетливо показала активное влияние лактата на белок-лигандные взаимодействия антигена с антителом, что является результатом суммарных модификаций, вызванных этим метаболитом и регистрируемых по скорости и полноте процесса агглютинации. Полученные результаты свидетельствуют о возможности использования естественных интермедиатов, в частности лактата, в качестве молекулярных зондов и перспективности использования гликопротеинов А и В, презентированных на мембране эритроцитов, в качестве молекулярной модели для изучения межмолекулярных взаимодействий. В целом, молекулярное моделирование и прогнозирование позволяет углубить фундаментальные знания об известных свойствах малых молекул и предсказать возможные биологические эффекты и молекулярные механизмы их реализации в процессах сложных взаимодействий между лигандами и их мишенями.



