Самую распространенную группу доброкачественных опухолей яичников представляют поверхностные эпителиально-стромальные опухоли, которые составляют приблизительно треть образований яичника и половину его доброкачественных опухолей [1, 2]. К ним относят серозные, муцинозные, эндометриоидные, чистоклеточные, переходные клеточные опухоли [9]. Наиболее распространенными эпителиальными цистаденомами яичников являются серозные и муцинозные. Серозные цистаденомы встречаются в репродуктивном возрасте в 11–15 % случаев среди всех опухолей яичников [1, 2]. Аналогичную распространенность имеют и муцинозные цистаденомы, встречаемость которых у женщин репродуктивного возраста составляют 6,6–14,7 % от всех опухолей яичников [4].
Доброкачественные эпителиальные опухоли развиваются на фоне окислительной дизрегуляции, окислительного стресса и дисфункции восстановления ДНК [2, 8, 10].
Химически окисление определяется как удаление электронов и их редукция, так и прирост электронов [4]. Общий смысл термина оксидант – это окислитель. В реакциях свободный радикал может выступать в качестве окисляемого агента, принимая один электрон из других веществ, или в качестве восстанавливающего агента – при донации одного электрона другим веществам [5]. Термин прооксидант точно не определен; как правило, считается, что прооксидант представляет собой любое вещество, которое может генерировать реакционноспособные частицы или частицы, способные индуцировать окислительный стресс. Тем не менее антиоксидантом считается любое вещество, которое присутствует в низких концентрациях по сравнению с такими окисляемого субстрата, значительно задерживает или предотвращает окисление этого субстрата [6].
Недавние данные свидетельствуют о том, что нарушение окислительно-восстановительной сигнализации, то есть окислительная дизрегуляция, является важным аспектом окислительного стресса, иногда более важным, чем прооксидантно-антиоксидантный дисбаланс или повреждение тканей, вызванное таким дисбалансом [7]. Поэтому новое определение окислительного стресса было предложено в качестве «дисбаланса между оксидантами и антиоксидантами в пользу оксидантов, что приводит к нарушению окислительно-восстановительной сигнализации и контроля и / или молекулярным повреждениям» [7]. Последствия окислительного стресса может быть от едва улавливаемых до очень серьезных (в том числе и окислительное повреждение биомолекул, нарушение передачи сигнала, мутации и гибель клеток) в зависимости от баланса между генерацией активных форм и антиоксидантной защиты [6].
Важно отметить, что окислительный стресс или внутриклеточное окислительно-восстановительное состояние участвует в активации ядерного фактора-kB (NF-kB); в частности, Н2О2 активирует NF-kB, а антиоксиданты блокируют активацию NF-kB [3]. Активация NF-kB приводит к интенсификации процессов пролиферации, ангиогенеза и замедлению процессов апоптоза.
Работы, посвященные изучению вопросов окислительной дизрегуляции у женщин с эпителиальными цистаденомами неэдометриоидного происхождения, единичные. Поэтому целью исследования стало изучение уровней некоторых оксидантов и антиоксидантов у пациенток с эпителиальными цистаденомами неэдометриоидного происхождения.
Материал и методы исследования
Обследовано 220 пациентов репродуктивного возраста: 40 пациентов с фолликулярными кистами яичников (группа сравнения Ф), 60 – с серозными цистаденомами (группа С), 60 – с муцинозными цистаденомами (группа М), а также 30 условно соматически и гинекологически здоровых пациенток контрольной группы (группа К).
Критерии включения в исследуемые группы: репродуктивный возраст; гистологически подтвержденный диагноз фолликулярной кисты, серозной цистаденомы, муцинозной цистаденомы, цистаденокарциномы неэндометриоидного происхождения. Критерии исключения: перекрут и разрывы кистозных образований; предварительный прием гормональных препаратов накануне оперативного вмешательства; эндометриоз; метастазы первичных опухолей другого происхождения; предшествующая химиотерапия; эндокринные заболевания; сахарный диабет; системные заболевания; сопутствующие воспалительные заболевания.
Забор крови для проведения исследований осуществляли в раннюю фолликулиновую фазу после окончания менструации. Оценку состояния систем свободнорадикального окисления и антиоксидантной защиты проводили с помощью спектрофотометрических (на спектрофотометре СФ-46, Россия) и фотоэлектрокалориметрических методик (на фотоэлектрическом фотометре КФК-2, Россия).
Изучали содержание таких оксидантов, как диеновые конъюгаты (ДК) ненасыщенных жирных кислот в плазме, малоновый диальдегид (МДА) в эритроцитах крови, перекисный гемолиз эритроцитов (ПГЭ). Содержание в плазме крови ДК ненасыщенных жирных кислот исследовали при величине пика поглощения конъюгированных диеновых структур гидроперекисей липидов при длине волны 233 нм. Экстинкцию МДА в эритроцитах крови регистрировали при длине волн 532 нм и 590 нм. Перекисный гемолиз эритроцитов (ПГЭ) определяли калориметрически по экстинкции внеэритроцитарного гемоглобина при сравнении спонтанного лизиса эритроцитарных мембран, вызванного водой и пероксидным окислением липидов кислородом воздуха, оценивали при длине волны 540 нм.
Для оценки состояния АОС исследовали общую антиокислительную активность (ОАОА) плазмы крови, активность ферментов супероксиддисмутазы (СОД) и каталазы (Ка)). Резервы антиоксидантной защиты крови в целом оценивали по показателям ОАОА плазмы методом Г. И. Клебанова и соавт. (1988), который основан на способности плазмы крови, которая анализируется, тормозить накопление активных продуктов тиобарбитуровой кислоты в суспензии желточных липопротеидов, взятой в качестве модельной системы свободнорадикального окисления. Экстинкцию регистрировали при длине волны 532 нм. Определение активности СОД проводили методом Fridovich в модификации О. П. Макаревича и соавт. (1983), который основан на способности фермента тормозить реакцию аутоокисления адреналина в адренохром при рН 10,2. Экстинкцию регистрировали при длине волны 540 нм. Принцип использованного в работе метода спектрофотометрического измерения активности Ка в сыворотке крови основан на способности перекиси водорода образовывать при взаимодействии с раствором молибдена аммония стойкий окрашенный комплекс желтого цвета. Экстинкцию раствора измеряли при длине волны 410 нм.
Определяли индекс баланса окислительной и антиоксидантной систем (И) по формуле:
И = МДА плазмы / ОАОА эритроцитов крови.
Все пациентки с образованиями яичников были прооперированы, диагноз во всех случаях был подтвержден гистологически.
Статистическую обработку полученных данных проводили с помощью программы Excel.
Результаты исследования и их обсуждение
Возраст обследованных пациентов с серозными цистаденомами составил в среднем 30,10 ± 0,51 лет, с муцинозными цистаденомами – 30,17 ± 0,47, с фолликулярными кистами – 30,43 ± 0,57, контрольной группы – 30,00 ± 0,45 и достоверно между группами не отличался.
Средний диаметр кистозных образований был наибольшим при муцинозных цистаденомах – 11,97 ± 0,81 см. При серозных цистаденомы он равнялся 9,06 ± 0,60 см, при фолликулярных кистах – 7,19 ± 0,26 см.
Изучение состояния оксидантного гомеостаза показало, что при образованиях яичников происходит накопление продуктов свободнорадикального окисления (табл. 1), при этом уровень ДК ненасыщенных жирных кислот в плазме крови при серозных цистаденомах (2,82±0,04 Ед/мл) по сравнению с контрольной группой был выше в 1,35 (p<0,01) раза, при муцинозных цистаденомах (2,91±0,04 Ед/мл) – в 1,39 (p<0,01), при фолликулярных кистах (2,52±0,05 Ед/мл) – в 1,21 (p<0,01); МДА в эритроцитах крови – соответственно в 1,84 (12,96±0,28 мкмоль/г белка, p<0,01); в 1,86 (13,12±0,28 мкмоль/г белка, p<0,01); в 1,54 (10,84±0,35 мкмоль/г белка, p<0,01), что приводило к усилению ПГЭ при серозных цистаденомах – в 1,47 (6,62±0,31, p<0,01); при муцинозных цистаденомах – в 1,53 (6,86±0,35, p<0,01); при фолликулярных кистах – в 1,30 (5,83±0,35, p<0,01).
Таблица 1
Характеристика некоторых показателей свободнорадикального окисления у женщин обследованных групп, M±m
|
Группа |
ДК, Ед/мл |
МДА, мкмоль/г белка |
ПГЭ, % |
|
С, n=41 |
2,82±0,04 к,ф |
12,96±0,28 к,ф |
6,62±0,31 к |
|
М, n=47 |
2,91±0,04 к,ф |
13,12±0,28 к,ф |
6,86±0,35 к,ф |
|
Ф, n=43 |
2,52±0,05 к,с,м |
10,84±0,35 к,с,м |
5,83±0,35 к,м |
|
К, n=30 |
2,09±0,02 ф,с,м |
7,05±0,20 ф,с,м |
4,49±0,13 ф,с,м |
|
Норма |
1,5-2,5 |
4-8 |
до 10 % |
Примечание. к, ф, с, м – разница статистически достоверна относительно показателей в группах К, Ф, С, М (p<0,05).
Концентрация ДК ненасыщенных жирных кислот в плазме крови была выше нормы у пациенток с серозными цистаденомами в 85,00 % случаев, с муцинозными цистаденомами – в 96,67 %, с фолликулярными кистами – в 50,00 %. Накопление МДА в эритроцитах крови превышало нормативные показатели у 100,00 % с серозными и муцинозными цистаденомами и у 87,50 % с фолликулярными кистами. ПГЭ был повышен относительно референтных значений у 15,00 % в группе С, у 16,67 % – в группе М, у 5,00 % – в группе Ф.
Полученные данные свидетельствуют о том, что как функциональные кистозные образования яичников, так и кистозные доброкачественные эпителиальные опухоли сопровождаются повышением накопления в крови продуктов свободнорадикального окисления, более выраженного при кистомах яичников. Накопление МДА в эритроцитах крови при образованиях яичников происходит более интенсивно, чем ДК ненасыщенных жирных кислот в плазме крови.
Анализ состояния антиоксидантной системы показал, что снижение активности Ка плазмы крови относительно показателей контрольной группы при серозных цистаденомах (13,69±0,51 мкат/л) было больше в 1,25 (p<0,01) раза, при муцинозных цистаденомах (13,47±0,54 мкат/л) – в 1,27 (p<0,01), а при фолликулярных кистах (16,73±0,45 мкат/л) достоверно не отличалось. Активность СОД соответственно была снижена в группе С в 1,17 (0,081±0,004 Ед/мг белка, p<0,01) и в группе М - в 1,23 (0,077±0,004 Ед/мг белка, p<0,01) раза; в группе Ф (0,098±0,005, Ед/мг белка) не имела достоверной разницы с группой К. В результате было зарегистрировано достоверное снижение ОАОА при серозных цистаденомах в 1,19 (41,98±0,56 %, p<0,01) раза и при муцинозных цистаденомах – в 1,19 (41,68±0,61 %, p<0,01) и недостоверное при фолликулярных кистах – в 1,13 (44,08±0,88 %, p>0,05).
Таблица 2
Активность ферментных компонентов антиоксидантной системы и уровень ОАОА плазмы у обследованных женщин в раннюю фолликулиновую фазу, M±m
|
Группа |
Каталаза, мкат/л |
СОД, Ед/мг белка |
ОАОА плазмы,% |
|
С, n=41 |
13,69±0,51 к,ф |
0,081±0,004 к,ф |
41,98±0,56 к |
|
М, n=47 |
13,47±0,54 к,ф |
0,077±0,004 к,ф |
41,68±0,61 к,ф |
|
Ф, n=43 |
16,73±0,45 с,м |
0,098±0,005 с,м |
44,08±0,88 к,м |
|
К, n=30 |
17,14±0,37 |
0,095±0,004 |
49,80±0,38 |
|
Норма |
10,6-23,0 |
0,050-0,150 |
45-55 |
Примечание. к, ф, с, м – разница статистически достоверна относительно показателей в группах К, Ф, С, М (p<0,05).
Оценка распределения пациенток в зависимости от смещения показателей уровня активности ферментных компонентов антиоксидантной системы и ОАОА плазмы в раннюю фолликулиновую фазу (рис.1) относительно их референтных норм показала снижение активности Ка плазмы крови ниже нормы у 23,33 % женщин с серозными цистаденомами, у 33,33 % – с муцинозными цистаденомами и у 2,50 % c фолликулярными кистами; СОД – соответственно у 10,00 %, 15,00 % и 2,50 %; ОАОА – у 75,00 %; 75,00 % и 10,00 %. У отдельных пациенток зарегистрирована активизация ферментных антиоксидантов и ОАОА (рис. 1).
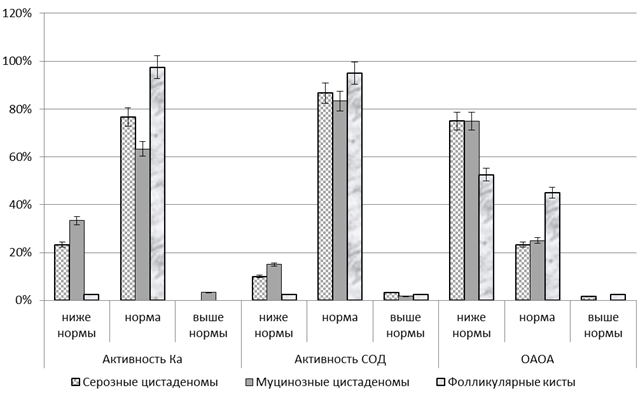
Рис. 1. Распределение пациенток в обследованных группах в зависимости от уровня активности ферментных компонентов антиоксидантной системы и ОАОА плазмы в раннюю фолликулиновую фазу
При определении индекса баланса оксидантной и антиоксидантной систем было подтверждено, что при образованиях яичников имел место выраженный дисбаланс между указанными системами с накоплением первичных и вторичных продуктов окисления и снижением активности ферментных антиоксидантов и ОАОА в крови (рис.).
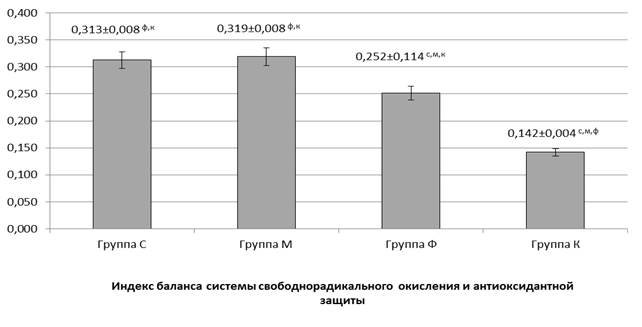
Рис.2. Индекс баланса систем свободнорадикального окисления и антиоксидантной защиты у обследованных женщин в раннюю фолликулиновую фазу. Примечание. ф, с, м – разница статистически достоверна относительно показателей в группах Ф, С, М (p<0,05)
Выводы
Доброкачественные эпителиальные цистаденомы неэндометриоидного происхождения развиваются на фоне окислительной дизрегуляции, накопления продуктов свободнорадикального окисления и снижения активности ферментных антиоксидантов и резервов общей антиокислительной активности крови.



