Бруцеллез – бактериальная инфекционно-аллергическая болезнь, относящаяся к группе зоонозов и занимающая особое положение среди других инфекционных болезней из-за своеобразия возбудителя. Этиопатогенетические особенности бруцеллеза определяют большую склонность заболевания к хроническому течению с длительной персистенцией патогена. Фактор времени не играет абсолютной роли в определении формы или стадии болезни, так острый процесс может развиваться на фоне латентного бруцеллеза, а хроническое течение может развиваться с самого начала болезни. Как правило, после консультации инфекциониста для исключения возможного бруцеллеза кровь пациента тестируют только в реакциях Хеддельсона и Райта, обладающих, по информации ряда авторов, невысокой чувствительностью (35–64 %). Из современных серологических методов диагностики бруцеллеза иммуноферментный анализ (ИФА) является наиболее доступным и распространенным [2, 3, 4]. Явные преимущества этого теста – простота и быстрота выполнения, высокая чувствительность, стабильность реагентов, возможность количественного учета реакции, обработка большого количества проб, автоматизация процесса и объективность инструментального учета результатов [5]. Метод иммуноферментного анализа находится в постоянном развитии. С одной стороны, расширяется число объектов исследования, с другой – углубляются и совершенствуются методы самого анализа [7]. Специфичность и чувствительность ИФА зависит от качества используемых иммунореагентов и оптимизации постановки теста.
Целью настоящей работы стало изучение возможности выявления антител в сыворотках крови людей при хроническом течении бруцеллеза в иммуноферментном анализе.
Проведя анализ полученных результатов, нами была сконструирована экспериментальная тест-система диагностическая для выявления специфических антител в сыворотках крови больных острым и хроническим бруцеллезом в непрямом методе постановки иммуноферментного анализа (нИФА).
Материалы и методы
В качестве сенсибилизирующего агента был апробирован поливалентный бруцеллезный водорастворимый антиген (Аг-в/р), извлеченный по методу Е. Н. Афанасьева из смеси бакмасс Brucella (B.)abortus19ABB. melitensisRev-1, B. suis61, обеззараженных охлажденным до минус 20 оС ацетоном [1].
Для получения кроличьей сыворотки против Ig G человека проводили гипериммунизацию по схеме, разработанной И. С. Тюменцевой с соавторами [6]. Схема основана на подборе оптимальной комбинации интактных и полимеризованных Ig G, выделенных из нормальной сыворотки крови человека, а также иммуномодуляторов тималина и циклофосфана. В качестве доноров антивидовых IgG были взяты кролики породы «Шиншилла», массой 3–3,5 кг. Гипериммунизацию проводили с соблюдением видоидентичности антигенов и вида продуцентов, используя IgG, выделенные из нормальной сыворотки крови человека, и иммуномодуляторы тималин и циклофосфан.
Конъюгацию кроличьих Ат против Ig G человека с индикаторным ферментом – пероксидазой хрена (ПХ) (тип VI-А, Rz: ~3.0 с активностью 1550 units/mg (Sigma)) проводили по методу перйодатного окисления по P. K. Nakane, A. Kawaoi (1974) в модификации M. B. Wilson, P. K. Nakane (1978).
Результаты ИФА регистрировали с помощью фотометра «Multiskan FC», измеряя оптическую плотность (ОП), используя фильтр с длиной волны 450 нм. По результатам ОП рассчитывали значение критической оптической плотности (ОПкрит.) по формуле 1:
ОПкрит. = ОПср К- + 0,2 (1),
где ОПсрК- – среднее значение ОП для отрицательного контрольного образца.
Для интерпретации результатов исследования применяли коэффициент позитивности (КП):
КП = ОПиссл. сыв./ ОПкрит. (2).
При КП < 1,0 результат оценивается как отрицательный.
КП ≥ 1,0 – результат положительный.
Для определения диагностической ценности сконструированной тест-системы использовали сыворотки крови больных и здоровых людей.
В качестве твердой фазы – полистироловые планшеты фирмы «Costar» (USA).
Результаты и обсуждение
Основные параметры ИФА, а именно чувствительность, точность и воспроизводимость, могут существенно изменяться при варьировании условий проведения эксперимента (температура, ионная сила и рН реакционной среды, концентрационные соотношения компонентов и продолжительность их взаимодействия). Это определяет необходимость оптимизации каждой стадии анализа, для чего использовали эмпирический подбор параметров постановки теста.
При создании диагностического теста важным моментом является определение его антигенной композиции и условий адсорбции на твердой фазе, т. е. установление оптимальной концентрации антигена (Аг), состава сенсибилизирующего буфера, условий отмывания не связавшихся компонентов, времени и температуры связывания Аг с поверхностью полистироловых планшетов. Оптимальную сенсибилизирующую дозу бактериального агента определяли в серии опытов с сыворотками крови больных бруцеллезом и здоровых людей против иммуноглобулинового пероксидазного коньюгата. В экспериментах испытывали различные концентрации Аг в интервале 10÷300 мкг/мл. Процесс адсорбции Аг оценивали по интенсивности реакции с контрольными сыворотками крови людей. Наиболее оптимальный уровень насыщения поверхности планшет достигался при концентрации белка, равной 100 мкг/мл, при этом сыворотки здоровых людей реагировали отрицательно.
Для определения оптимальных условий сенсибилизации планшета Аг-в/р оценивали интенсивность реакции при инкубации в термостате (37±1) °С в течение (3, 2, 1 ч) и с использованием термошейкера при той же температуре (250 об./мин), а также 18 ч при температуре 4 °С (рисунок 1). Установлен оптимальный режим – при температуре 37 °С в течение 2 ч или в условиях термошейкера в течение 1 ч, в то время как при остальных значениях выдержки адсорбционная способность Аг-в/р, а также специфичность реакции несколько ниже. Инкубация при температуре 4 оС возможна при определенных условиях расчета времени постановки реакции без потери чувствительности и специфичности.
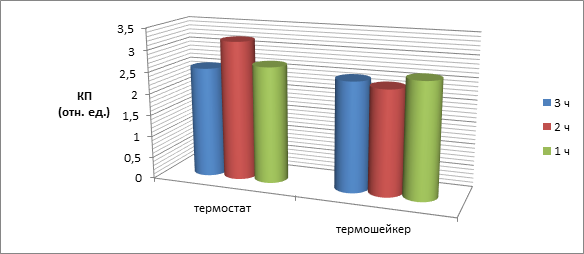
Рис.1. Зависимость КП от изменения условий инкубации
Чтобы исключить неспецифическую реакцию на иммунный комплекс Аг-Ат, были проведены исследования по уменьшению «фоновых помех» с использованием бычьего сывороточного альбумина (БСА) и казеина в концентрации 0,05–1,0 % в буфере для разведения сывороток крови людей и иммуноглобулинового пероксидазного конъюгата. Установлено, что блокирование свободных центров связывания целесообразно проводить 0,1 % раствором БСА на ФСБ рН 7,2±0,2 с добавлением неионного детергента Твин 20 до 0,05 %.
Далее были изучены особенности взаимодействия опытных сывороток крови с иммобилизованным на поверхности полистирола специфическим Аг-в/р с в интервале от 15 до 90 мин при температуре 37 оС и иммунопероксидазным конъюгатом (15; 30 и 40 мин). Как показано на графике (рисунок 2), оптимальное время инкубации сывороток – 60 мин, аинкубацию иммунопероксидазного конъюгата – 30 мин. В более короткий срок – не происходит эффективного взаимодействия компонентов реакции, а увеличение продолжительности инкубации не только удлиняет время постановки реакции, но и способствует появлению фонового окрашивания.
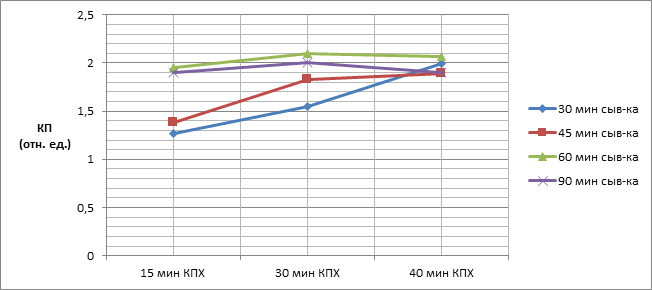
Рис. 2. Зависимость показаний КП от времени инкубации сыворотки и иммуноглобулинового пероксидазного конъюгата
Важным для проведения ИФА является определение кинетики связывания и концентрации пероксидазного конъюгата. В опытах максимальные значения были констатированы при рабочем разведении конъюгата 1:3000 при его взаимодействии с испытуемыми сыворотками – 30 минут при температуре 37 оС.
При испытании чувствительности тест-системы использовали различные разведения (от 1:10 до 1:100) сывороток крови больных острым и хроническим бруцеллезом, которые вносили в лунки планшет сенсибилизированных Аг-в/р. Постановка реакции осуществлялась согласно отработанным параметрам. Чувствительность выявления специфических антител оценивали по средней величине КП. Среднее значение КП при разведении сыворотки 1:10 составляет 2,140±0,129 при разведении сыворотки 1:100 – 2,658±0,221. Число степеней свободы (f) = 13. Парный t-критерий Стьюдента = 3689. Критическое значение t-критерия Стьюдента при данном числе степеней свободы составляет 2,16. tнабл. >tкрит., изменения признака статистически значимы (р<0,05).
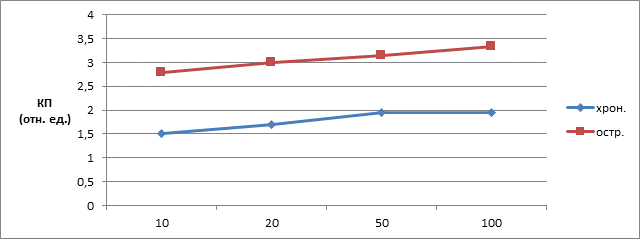
Рис. 3. Зависимость показаний коэффициента позитивности от разведения сыворотки
Проведенные исследования позволили сконструировать диагностический набор реагентов тест-систему диагностическую для выявления антител к возбудителю бруцеллеза в нИФА (экспериментальные серии). В состав набора входят следующие компоненты: положительный контроль (инактивированный) – 1 ампула (0,1 мл); конъюгатпероксидазныйиммуноглобулиновый сухой – 1 ампула (0,1 мл); антиген бруцеллезного микроба (полигрупповой) в концентрации 10,0 мг/мл сухой 1 ампула (0,25 мл); фосфатно-солевой буфер (ФСБ), сухая навеска – 1 флакон; бычий сывороточный альбумин (БСА), сухая навеска – 1 флакон; твин 20 – 1 флакон; тетраметилбензидин (ТМБ) – 2 флакона; 4 N раствор серной кислоты (стоп-реагент) – 1 флакон; планшет полистироловый для ИФА однократного применения с объемом лунки 0,4 мл – 1 шт.; скарификатор дисковый ампульный керамический – 1 шт.
Способность тест-системы выявлять антитела к возбудителю бруцеллеза при различных формах заболевания была показана в нИФА с 24 сыворотками больных бруцеллезом людей (рисунок 4). Значения КП при острой форме бруцелеза в основном более 2,0 (средняя арифметическая – 2,86±0,22), при хронической форме значения лежат в диапазоне от 1,0 до 2,0 (средняя арифметическая – 1,53±0,10). Значения t-критерия Стьюдента: 5,50. Различия статистически значимы (р<0,05). Число степеней свободы f=23. Критическое значение t-критерия Стьюдента = 2,069.
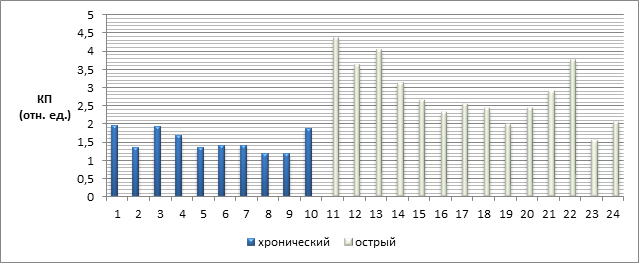
Рис. 4. Значения КП при различных формах бруцеллеза (1–10 – сыворотки крови больных хронической формой бруцеллеза; 11–24 – сыворотки крови больных острой формой)
При испытании разработанная тест-система позволяла выявлять антитела к возбудителю бруцеллеза при различных формах заболевания. При этом отмечали отрицательную реакцию с сыворотками крови здоровых людей.
Выводы
В результате проведенных исследований разработана тест-система для выявления специфических антител к возбудителю бруцеллеза на основе непрямого метода иммуноферментного анализа.
Установлены оптимальные параметры и условия постановки ИФА с разработанной тест-системой: сенсибилизация планшет раствором поливалентного бруцеллезного водорастворимого Аг в 0,1М ФСБ, рН 7,2±0,2 с концентрацией белка 100 мкг/мл в течение 2 ч при температуре 37 °С или 1 ч в условиях термошейкера (250 об/мин; 37 оС); блокировка свободных сайтов связывания – буферным растворомс 0,1 % БСА в присутствии неионного детергентадо 0,05 %; взаимодействие сывороток со специфическим Аг – 60 мин при 37 °С; время экспозиции с иммунопероксидазным конъюгатом – 30 мин при температуре 37 °С.
Таким образом, результатом проведенных исследований стала разработка тест-системы для выявления специфических антител к возбудителю бруцеллеза, позволяющая в течение 3–4 часов (включая предварительную сенсибилизацию) определить наличие их антител в сыворотках крови больных острой и хронической формой бруцеллеза.
В результате испытаний установлены высокая активность и специфичность тест-систем для выявления специфических антител к возбудителю бруцеллеза в сыворотках крови людей, что позволяет предложить их в качестве альтернативного теста в лабораторной диагностике бруцеллеза.



