Современная концепция лечения раневой инфекции основана на проведении радикальной хирургической обработки очага инфекции, дополненной общей и местной антимикробной терапией, но применение антибиотиков может препятствовать заживлению раны, подавляя воспалительную реакцию и угнетая иммунитет. Быстрый рост устойчивости микроорганизмов не только к антибиотикам, но и ко многим антисептикам, является сложной проблемой, которая на сегодняшний день приобрела социально-экономическую значимость в масштабах государства [6].
В России преобладающими возбудителями гнойно-воспалительных осложнений в травматологии и ортопедии являются грамположительные кокки. Штаммы E. coli, выделенные у пациентов с патологией опорно-двигательного аппарата, характеризуются высоким уровнем резистентности к антимикробным препаратам, обусловленной продукцией бета-лактамаз расширенного спектра [4].
Наночастицы металлов являются одним из перспективных претендентов на создание нового класса антибактериальных средств, так как обладают пролонгированным бактерицидным, фунгицидным и регенеративным действиями [1, 3]. Наночастицы серебра и меди обладают более выраженным антимикробным эффектом, чем профильные антибиотики. Антибактериальный эффект наночастиц металлов обусловлен нарушением барьерной функции клеточной мембраны микроорганизма [2, 7,8].
Актуальным представляется оценка антибактериального влияния местного применения наночастиц меди и серебра в комплексе с порошковой основой. В состав уже применяемых порошкообразных препаратов входят антибиотики, поэтому не исключено возникновение всех перечисленных негативных последствий – селекции антибиотикорезистентных штаммов, местных аллергических реакций, и как следствие, нарушения полноценной репаративной регенерации ран [5].
В состав предлагаемого препарата были включены наночастицы серебра и меди, что может обеспечить высокую антимикробную эффективность, значительно уменьшить возможность развития гнойных осложнений и оптимизировать процесс репаративной регенерации ран мягких тканей.
Целью работы является разработка комплексного препарата, состоящего из наночастиц меди, серебра и порошкообразной основы, обладающего антибактериальным действием и предназначенного для санации условно-асептических и гнойных ран, и выяснение уровня и спектра антибактериальной активности препарата на клинических штаммах грамположительных и грамотрицательных микроорганизмов.
Материалы и методы исследования
Разработан препарат для регенерации мягких тканей с антибактериальным эффектом, имеющий порошкообразную форму и содержащий наночастицы меди с дисперсностью 30–40 нм, наночастицы серебра с дисперсностью 30–70 нм, порошкообразный стерильный крахмал. Использованы наночастицы меди и серебра (ТУ 1733-056-00209013-2008), синтезированные на плазмохимическом комплексе филиала ФГУП РФ «Государственный научно-исследовательский институт химии и технологии элементоорганических соединений» (г. Москва).
Антимикробную активность препарата изучали на 40 антибиотикорезистентных штаммах микроорганизмов, выделенных из раневого отделяемого пациентов травматолого-ортопедического профиля с посттравматическими и послеоперационными осложнениями, находящимися на лечении в ФГБУ «СарНИИТО» Минздрава России, 20 из которых относятся к E. coli, 20 – к S. aureus. Штаммы микроорганизмов, используемые в работе, коллекционировали и хранили в соответствии с СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I–IV групп патогенности».
Выделение и идентификацию микроорганизмов осуществляли по общепринятой методике (Приказ МЗ СССР, № 535). Забор материала проводили в асептических условиях стерильными тампонами Transportswabw/omedium (Citoswab, China) и высевали на селективные и дифференциально-диагностические питательные среды. Микроорганизмы идентифицировали на микробиологическом анализаторе BD BBL™ Crystal™ AutoReader (BectonDickinson, США) с применением панелей CrystalTMEnteric/NonfermenterIDKit (BectonDickinson, США), CrystalTMGram-PositiveIDKit (BectonDickinson, США). Для пробоподготовки использовали Densi-La-Meter (Pliva-LachemaDiagnostika, Чехия), предназначенный для определения мутности разведения микроорганизмов в единицах по МакФарланду (от 0,0 до 15). 1 МакФарланд эквивалентен 3·108 КОЕ/мл.
С каждым выделенным штаммом микроорганизмов проведены две серии экспериментов: 1-я серия (группы сравнения) – с взвесью кукурузного крахмала в концентрациях 0,1; 0,5; 1,0; 3,0 мг/мл в 0,9%-ном растворе хлорида натрия (рН 7,2-7,4); 2-я серия (опытные группы) – с взвесью комплексного порошкообразного препарата в концентрациях 0,1; 0,5; 1,0; 3,0 мг/мл в 0,9 % растворе хлорида натрия (рН 7,2-7,4).
Изучение антибактериальной активности наночастиц металлов проводили в соответствии с МУК 1.2.2634-10 «Микробиологическая и молекулярно-генетическая оценка воздействия наноматериалов на представителей микробиоценоза».
Для приготовления бактериальной взвеси использовали чистую суточную культуру микроорганизмов в стерильном 0,9 %-ном растворе хлорида натрия. На нефелометре доводили плотность бактериальной взвеси до 0,1 ЕД по стандарту Мак-Фарланда, что соответствует 3·107 КОЕ/мл. По 100 мкл бактериальной взвеси вносили во все опытные и контрольную пробирки, конечная концентрация составляла 3·105 КОЕ/мл.
Полученную взвесь инкубировали 30, 60, 90 и 120 минут в термошейкере SkyLineST-3 (ELMI, Латвия) при температуре 37 °С и встряхивании 100 об/мин, после чего по 100 мкл каждого образца высевали на чашки Петри с питательной средой Agarnutrient (BectonDickinson, США) и помещали в термостат при 37 °С на 24 часа. На следующий день производили подсчет выросших колоний.
Статистический анализ позволил подтвердить достоверность полученных результатов. Проверку нормальности распределения количественных показателей выполняли с использованием критерия Колмогорова – Смирнова, коэффициентов асимметрии и эксцесса. Оценку различий между выборками проводили с использованием t-критерия Стьюдента, так как переменные соответствовали нормальному распределению.
В анализе использованы следующие статистические показатели: n – число наблюдений; M – среднее арифметическое значение; m – среднеквадратическая ошибка; p – коэффициент достоверности. Достоверным считали результаты при р<0,05, что соответствует требованиям, предъявляемым к медико-биологическим исследованиям.
Результаты исследований
При культивировании клинических штаммов E. coli на агаризованных питательных средах количество микроорганизмов после воздействия комплексного препарата во всех вариантах опыта меньше, чем в контроле. Результаты исследований представлены в табл. 1. Действие препарата в концентрации 0,1 мг/мл во всех временных экспозициях вызывало существенное уменьшение количества колоний изучаемого микроорганизма: экспозиция 30 минут способствовала сокращению количества жизнеспособных бактерий до 54,82±2,36 % (p<0,001), 60 минут – до 68,70±6,34 % (p<0,001), 90 минут – до58,81±4,91% (p<0,001), 120 минут – до28,27±4,56 % (p<0,001).
Концентрация 0,5 мг/мл при экспозициях 30, 60, 90 минут способствовала снижению количества бактериальных клеток до 22,97±6,25 % (p<0,001),.17,04±3,55% (p<0,001) и 8,7±1,12 % (p<0,001) соответственно. Инкубация в течение 120 минут приводила к незначительному росту количества микроорганизмов – 0,2±0,8 % (p<0,001).
Дальнейшее повышение концентрации препарата до 3 и 5 мг/мл при всех экспозициях приводило к отсутствию роста микроорганизмов на плотных питательных средах.
Таблица 1
Антибактериальное действие комплексного порошкообразного
препарата на штаммы E. coli
|
Время воздей-ствия, мин. |
Количество колоний на агаризованных питательных средах (КОЕ), M±m |
|||||
|
Контрольнаягруппа, n=20 |
Опытные группы, n=20 |
|||||
|
0,1 мг/мл |
0,5 мг/мл |
1 мг/мл |
3 мг/мл |
5 мг/мл |
||
|
30 |
1256,34±18,21 |
689,74±19,27p<0,001 |
288,31±18,56p<0,001 |
116,33±8,50 p<0,001 |
Роста нет |
Роста нет |
|
60 |
1156,14±22,31 |
756,68±35,64 p<0,05 |
197,59±23,11 p<0,001 |
54,07±8,11 p<0,001 |
Роста нет |
Роста нет |
|
90 |
987,56±19,25 |
577,31±26,48 p<0,001 |
79,16±12,05 p<0,001 |
8,12±1,26 p<0,001 |
Роста нет |
Роста нет |
|
120 |
1145,07±27,34 |
329,45±27,11 p<0,001 |
7,27±3,14 p<0,001 |
2,03±0,37 p<0,001 |
Роста нет |
Роста нет |
Примечание: M – среднее арифметическое значение; ±m – среднеквадратическая ошибка; р – показатель достоверности различий опытной группы по сравнению с группой контроля; n – количество наблюдений.
Полученные данные продемонстрированы в виде диаграммы (рис. 1).
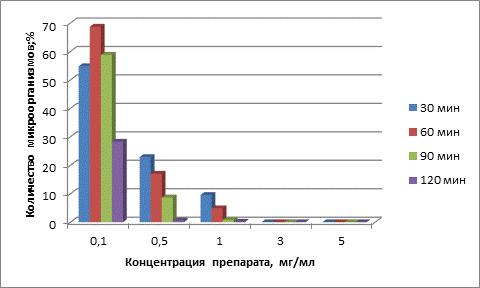
Рис.1. Антибактериальная активность комплексного препарата по отношению к штаммам E.coli
Таким образом, установлена высокая антибактериальная активность комплексного порошкообразного препарата в отношении антибиотикорезистентных штаммов E. coli. Увеличение концентрации препарата и времени воздействия приводит к усилению его антибактериальной активности, что свидетельствует о время- и дозозависимом характере их действия. Использование препарата в концентрациях 3 и 5 мг/мл приводило к бактерицидному эффекту при всех используемых экспозициях.
Оценено антибактериальное действие порошкообразного препарата в концентрациях 0,1;1;3;5мг/мл на 20 штаммах S. aureus при различном времени воздействия. При культивировании микроорганизмов на плотной питательной среде их количество после воздействия препарата во всех вариантах опыта было меньше, чем в контроле. Результаты исследований представлены в табл. 2.
Концентрация препарата 0,1 мг/мл при экспозициях в 30, 60, 90 минут приводила к снижению количества жизнеспособных клеток до 28,37±7,61 % (p<0,001) по отношению к контролю. При пролонгировании инкубации до 120 минут происходило полное отсутствие роста изучаемых микроорганизмов.
Таблица 2
Антибактериальное действие порошкообразного комплексного препарата на штаммы S. aureus
|
Время воздей-ствия, мин. |
Количество колоний на плотных питательных средах (КОЕ), M±m |
|||||
|
Контрольная группа, n=20 |
Опытные группы, n=20 |
|||||
|
0,1 мг/мл |
0,5 мг/мл |
1 мг/мл |
3 мг/мл |
5 мг/мл |
||
|
30 |
1264,38±29,18 |
349,54±26,37 p<0,001 |
56,49±4,37 p<0,001 |
Роста нет |
Роста нет |
Роста нет |
|
60 |
1340,15±21,08 |
71,18±9,65 p<0,001 |
4,31±1,08 p<0,001 |
Роста нет |
Роста нет |
Роста нет |
|
90 |
1171,39±32,62 |
7,40±2,36 p<0,001 |
Роста нет |
Роста нет |
Роста нет |
Роста нет |
|
120 |
1055,81±19,79 |
Роста нет |
Роста нет |
Роста нет |
Роста нет |
Роста нет |
Примечание: то же, что и в табл. 1.
Применение препарата в концентрации 0,5 мг/мл приводило к более выраженной антибактериальной активности: количество жизнеспособных клеток при времени воздействия 30 минут составило 4,66±0,38 % (p<0,001), при инкубации в течение 60 минут жизнеспособными оставалось лишь 0,31±0,07 % клеток (p<0,001). Дальнейшее увеличение концентрации препарата вызывало полную элиминацию микроорганизмов при всех сроках инкубации. Полученные данные представлены в виде диаграммы (рис. 2).
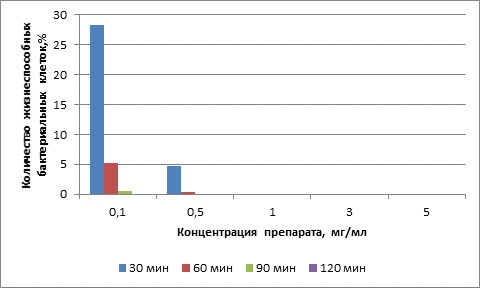
Рис. 2. Антибактериальная активность препарата на основе наночастиц меди и серебра по отношению к штаммам S. Aureus
В результате проведенных исследований выявлен выраженный антибактериальный эффект порошкообразного комплексного препарата на основе наночастиц меди и серебра в отношении антибиотикорезистентных штаммов S.aureus при их применении в низких концентрациях. Установлен дозозависимый характер его действия. Выявлена прямо пропорциональная зависимость антибактериального действия препарата от времени воздействия.
Выводы
Разработанный препарат создает оптимальные условия для реализации основных лечебных компонентов – наночастиц меди (как средства, обладающего антибактериальным и регенерирующим действием) и серебра (как антибактериального средства), позволяет предотвратить вторичное инфицирование раны, в отличие от известных аналогов осуществить купирование имеющихся гнойных процессов в ране, завершить процесс регенерации в более короткие сроки.



