Актуальность проблемы. Хроническая болезнь почек (ХБП) является серьезным осложнением таких заболеваний, как сахарный диабет (СД) 2 типа и артериальная гипертония (АГ) [1,2,7]. У каждого второго-третьего пациента с СД 2 типа в течение 5–7 лет от начала заболевания развивается диабетическая болезнь почек. Примерно 35 % пациентов, нуждающихся в заместительной терапии – диализе или трансплантации почек, составляют пациенты с СД 1 и 2 типа. Диабетическая нефропатия представляет собой глобальную медицинскую, социальную и экономическую проблему современного общества [7].
Вторая по частоте встречаемости причина ХБП – АГ. Все многообразие патоморфоза гипертонического поражения почек у больных АГ, поражения органа-мишени, формирования почечной дисфункции является одним из звеньев кардиоваскулярного/кардиоренального континуума, обусловливающего высокий риск развития сердечно-сосудистых катастроф [3,4,6].
Общепризнанные критерии нарушения функционального состояния почек – протеинурия и повышение уровня креатинина сыворотки – обычно свидетельствуют уже о поздних этапах патологического процесса в почках (нефроангиосклероза), который, в свою очередь, способствует как развитию хронической почечной недостаточности, так и указывает на высокий риск развития осложнений и кардиоваскулярной смертности [9]. Важным требованием к современной антигипертензивной терапии является ожидание её позитивного влияния на компоненты метаболического синдрома (избыточный вес, объем жировой ткани, повышенный уровень холестерина и триглицеридов, нарушения углеводного обмена, инсулинорезистентность) и ожирения, которые в популяции в целом и среди пациентов с АГ приобретают характер «неинфекционной эпидемии». Если рассматривать спектр современных антигипертензивных препаратов с этой позиции, то становится совершенно очевидным, что между представителями одного и того же класса и практически в каждом из них можно выделить как минимум два поколения (генерации). Причем представители новых поколений имеют ряд важных клинически значимых отличий, и можно говорить о том, что многие из них являются бифункциональными антигипертензивными средствами, которые помимо снижения АД оказывают положительное влияние на патогенетические механизмы нарушения обмена углеводов, липидов, ожирения и неинфекционного воспаления [8].
Нефропротекция, обусловленная влиянием сартанов, связана с прицельной дилатацией, стойко спазмированной при АГ и диабетической нефропатии, выносящей артериолы почечного клубочка, последующем восстановлении оттока, разрешении внутриклубочковой гипертензии и восстановлении функции почек. Скорость клубочковой фильтрации, являющаяся реальным отражением состояния почечной функции, улучшается при назначении сартанов [1,3,5]. Наличие у пациента СД 2 типа вносит определенный вклад в развитие АГ и наоборот. Улучшение выживаемости пациентов с данной коморбидной патологией можно достичь за счет корректного лечения сахарного диабета, артериальной гипертензии и внедрения эффективной системы нефропротекции [7].
Цель исследования. Изучение антигипертензивной и нефропротективной эффективности Азилсартана у коморбидных пациентов с артериальной гипертензией, сахарным диабетом 2-го типа, осложненных хронической болезнью почек.
Материал и методы исследования. В соответствии с поставленной целью программа диагностики и лечения данного коморбидного состояния включала два этапа: на первом этапе был проведен скринг всех больных с артериальной гипертензией в сочетании с СД 2-го типа, с выявлением ХБП различной тяжести, а на втором этапе (клинический) нашей программы исследования включено клиническое, лабораторно-инструментальное обследование больных, до и после лечения.
Для включения в исследование пациенты соответствовали следующим критериям: имели в анамнезе сахарный диабет 2-го типа, артериальную гипертензию (I и II стадии) и ХБП различной длительности; клинические признаки данного коморбидного состояния, и пациенты имели желание и письменное информированное согласие на исследование. Исключали пациентов с любыми заболеваниями, требующими неотложной терапии, онкологическими, инфекционными болезнями, застойной сердечной недостаточностью, другими тяжелыми заболеваниями; принимающих иммуносупрессанты; имеющих признаки стеноза почечной артерии, а также злоупотребляющих алкоголем.
Всем больным проводилось суточное мониторирование артериального давления (СМАД) вначале исследования и в конце на аппарате MeditechCard(X)Plore, Венгрия, по стандартному протоколу [12]. Регистрация артериального давления днем (6–24 ч) проводилась через 15 мин, ночью (24–6 ч) – через 30 мин. Средние значения систолического артериального давления (САД), диастолического артериального давления (ДАД) и частоты сердечных сокращений (ЧСС) рассчитывали за 24 часа, периоды бодрствования (с 6 до 24 часов) и сна (с 24 до 6 часов).
Частота повышения АД при мониторировании («нагрузка давлением») оценивалась по индексу времени, определяемому как процент измерений АД, во время которых величина АД превышала пороговые значения: 140/90 мм рт. ст. для периода бодрствования и 120/80 мм рт. ст. для ночного времени. В качестве показателя вариабельности артериального давления (ВАД) рассчитывали стандартное отклонение САД и ДАД за 24 ч и отдельно для дневного и ночного времени. Суточный профиль артериального давления (СПАД) оценивали по перепаду АД «день-ночь» и степень ночного снижения (СНС) артериального давления, которая определяется как отношение разницы между средними величинами артериального давления в период бодрствования и сна к средним дневным значениям артериального давления, выраженное в процентах. За нормальную СНС артериального давления принимали значения более 10 и менее 20 %.
Степень выраженности поражения почек оценивались путем определения скорости клубочковой фильтрации (СКФ). Для оценки СКФ применялись значения этого показателя, полученные на основании расчетной формулы CKD-EPI 2009 г., модифицированной в 2011 г.
Тяжесть СД 2 типа оценивались путем определения уровня показателей гликемии натощак (ммоль/л) и глюкозо-толерантного теста (ГТТ). Учитывались результаты обследования при первом приеме больного и через 12 месяцев.
Во время исследования пациенты навещали лечащего доктора в течение 6 месяцев не реже 3–5 раз за этот период с целью контроля адекватности лечения АГ и СД 2 типа. На промежуточных визитах, кроме общеклинического осмотра, измерялось артериальное давление, определялся уровень глюкозы в крови.
Программа лечения. Для выполнения данной цели всем пациентам во время первого визита был назначен Азилсартан в дозе 40 мг в день за один прием «сверху» проводимой антигипертензивной терапии, под контролем АД. Если же пациент до назначения Азилсартана получал и АПФ, то он был отменен (рекомендации ESH/ESC 2013). В течение 1–2 месяцев терапии доза Азилсартана была увеличена до 80 мг у всех участников под контролем артериального давления.
Лечение сахароснижающими таблетированными средствами также проводилось строго в соответствии с рекомендациями EASD\ESC 2013 (под контролем эндокринолога).
Первичной точкой эффективности было изменение АД по сравнению с начальным через 6 мес терапии. Лечение считали успешным при одновременном снижении САД <140 мм рт. ст. и ДАД <85 мм рт. ст. Вторичной конечной точкой было улучшение клубочковой фильтрации.
Результаты и обсуждения. Всего в исследование было включено 40 пациентов (22 мужчин, 18 женщин). Средний возраст пациентов составлял 56,7±10,7 лет. Клиническое среднее САД/ДАД на начало исследования было 154,9±14,6/91,8±8,1 мм рт. ст. Средняя длительность АГ составила 11,3±6,8 лет. У 26 пациентов была АГ I степени и у 14 АГ II степени, согласно классификации ESH/ESC.
До включения в исследование 48 % пациентов получали один антигипертензивный препарат; 35,0 % – 2 препарата; 17,5 % – 3 препарата для лечения АГ. Ингибиторы АПФ получали 82,5 % пациентов, антагонисты кальция – 42,5 %, β-адреноблокаторы – 55,0 %, диуретики – 32,5 %, центральные агонисты имидазолиновых рецепторов – 17,5 %.
Сравнительный анализ показателей суточного мониторирования артериального давления до и после лечения Азилсартаном показал следующее (рисунок) – на фоне лечения наблюдалось уменьшение САД суточного и дневного АД на 13,1 % (р<0,01) по сравнению с исходным, ночного АД на 10,9 % (р<0,01). Аналогично отмечено снижение ДАД суточного и дневного АД на 20,0 % и 23,8 % (р<0,01) соответственно, в то же время как ночной уровень ДАД снижался на 15,4 % (р<0,01) по сравнению с исходным.
При этом ВАД как систолического (ВСАД), так и диастолического (ВДАД) и пульсового артериального давления (ПАД) была более значительна в ночное время, ее уменьшение в ночное время для систолического составило 5,5 % (р=2,66) и диастолического 3,9 % (р = 0,25). Эти изменения сопровождались уменьшением количества больных с суточным типом САД non-dipper на 37,5 % увеличением больных с профилем dipper на 45,0 %, уменьшением night-peaker на 10,0 % и увеличением over-dipper на 7,5 %.
Таким образом, назначение Азилсартана привело к достоверному (р<0,001) снижению САД и ДАД через 6 мес терапии (рисунок).
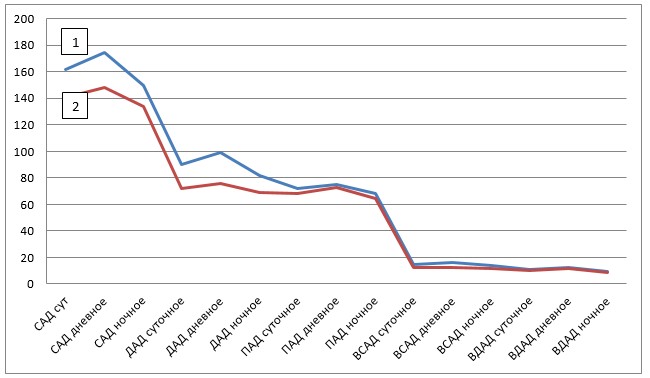
Примечание: 1 – До лечения Азилсартаном, 2 – После лечения Азилсартаном.
Динамика показателей СМАД на фоне гипотензивной терапии (М±m,%)
Результаты суточного мониторинга АД показали, что САД и ДАД более выражено снижались в ночное время, что позволило приблизить колебания АД к физиологическим. Азилсартан, по данным клинического измерения и СМАД, эффективно снижал АД до целевых значений у больных с данной коморбидной патологией.
Среднее значение уровня гликемии натощак вначале исследования составил 8,72 ммоль\л, на фоне применения препарата оно составило 6,87 ммоль\л, что демонстрирует благоприятное воздействие на гликемический профиль, за счет повышения чувствительности тканей к инсулину. У исследуемых больных, в начале исследования, СКФр распределилась по стадиям следующим образом: I стадию (СКФ ≥90 мл/мин/1,73 м2) имели 21 (52,5 %), II стадию (СКФ от 60 до 89) – 10 (25,0 %), а III стадию (СКФ от 30 до 59) – 9 (22,5 %) человек из 40. На фоне проводимого лечения, через 6 мес отмечалось улучшение клубочковой фильтрации, что отразилось в миграции пациентов из тяжелых стадий в более легкие. В I стадию, после 6 мес лечения имели 29 (72,5 %), II стадию – 15 (37,5 %), а III стадию – 4 (10,0 %).
Улучшение клубочковой фильтрации косвенно свидетельствует об органопротективных свойствах Азилсартана.
Азилсартан очень хорошо переносился. Диспепсические явления наблюдались у 2 (5,0 %) пациентов, аллергических реакций, аритмий отмечено не было.
Таким образом, представитель сартанов, Азилсартан, эффективно и безопасно снижал артериальное давление, продемонстрировал благоприятное воздействие на гликемический профиль и скорость клубочковой фильтрации у пациентов с артериальной гипертензией, сахарным диабетом и хронической болезнью почек.



