Мезенхимальные стромальные клетки (МСК) представляют большой интерес для регенеративной медицины благодаря способности к самоподдержанию и мультилинейной дифференцировке. МСК выделены из разнообразных источников: фетальных и неонатальных тканей, а также из материала взрослых организмов – периферической крови, костного мозга, жировой ткани, надкостницы, печени, скелетных мышц, волосяного фолликула и т.д. [7]. Хотя история изучения мультипотентных клеток насчитывает уже четыре десятилетия, многие вопросы их биологии остаются нерешенными. Интерпретация данных, полученных в разных лабораториях, затрудняется морфологической, фенотипической и функциональной гетерогенностью МСК, которая обусловлена как неоднородностью популяций стволовых клеток в живом организме, так и методическими особенностями их выделения, культивирования и селекции in vitro [6].
Выделение МСК подразумевает ферментативную обработку биологического материала с последующей селекцией клеток, обладающих адгезией к культуральному пластику [9]. При использовании столь неспецифического подхода свойства поверхности субстрата не только предопределяют клеточный состав первичных культур, но и детерминируют морфологические особенности популяций в ходе дальнейшего пассирования. По наблюдениям ряда исследователей, через 3-4 субкультивирования популяции МСК приобретают однородность [3, 5], другие авторы обнаруживают гетерогенность клеточных линий и на более поздних пассажах [6]. Одно из вероятных объяснений подобных противоречий заключается в использовании культуральной посуды с разными адгезивными свойствами. В связи с этим целью настоящей работы стала сравнительная оценка морфологических особенностей популяций МСК, выращенных на культуральном пластике разных производителей.
Материалы и методы. Выделение МСК производили по методу Zuk et. al. [9] из подкожного жира пациентов, прооперированных по поводу варикозной болезни вен нижних конечностей. Все пациенты дали письменное добровольное информированное согласие на участие в научно-исследовательской работе, на проведение которой получено положительное решение локального этического комитета ГБОУ ВПО «Тверской ГМУ» МЗ РФ. Образцы ткани измельчали ножницами и инкубировали с раствором коллагеназы I типа (200 ед/мл) в DMEM (среда Игла в модификации Дульбеко) со стептомицином и пенициллином (100 ед/мл) при 370C в течение 60 минут при постоянном встряхивании. После инактивации фермента эквивалентным объемом среды DMEM («Invitrogen», США), содержащей 10% фетальной телячьей сыворотки («Gibco», США), клетки осаждали центрифугированием. Осадок отбирали, ресуспендировали в 0,5 мл среды и подвергали гемолизу в течение 2 минут в дистиллированной воде. Изотоничность восстанавливали добавлением 10-кратного фосфатно-солевого буфера. Клетки повторно осаждали центрифугированием, пропускали через сито 100 мкм и высевали в чашки Петри. Инкубацию проводили в DMEM с антибиотиком и 10% фетальной телячьей сывороткой при 37 0С в атмосфере 5% СО2. На следующий день для удаления неприкрепившихся клеток питательную среду заменяли свежей. В дальнейшем среду меняли каждые 2-3 сут. При достижении субконфлюентного состояния клетки снимали трипсином-ЭДТА («ПанЭко», Россия) и пересевали в новые чашки. В работе использовали клетки четвертого пассажа.
Для основного эксперимента были отобраны две линии МСК существенно различающиеся по своей пролиферативной активности. Клетки высаживали в многолуночные полистироловые планшеты с обработанной поверхностью производства Greiner bio-one (кат. номер 662160) или Jet Biofil (кат. номер 011006). Плотность посадки составляла 400 кл/см2. Культивирование продолжалось в течение 4 сут, после чего клетки фиксировали и окрашивали по Романовскому-Гимза. Оценку морфологических характеристик МСК проводили с помощью программы ToupView при анализе фотографий случайно выбранных полей зрения, полученных с использованием светового инвертированного микроскопа (Микромед), оснащенного камерой ToupCam. Для каждой популяции подсчитывали среднюю плотность клеток, относительный прирост биомассы, долю делящихся и многоядерных клеток. Среднюю скорость роста за время культивирования относили к единице площади. Определяли такие морфометрические показатели, как длину короткой оси (В), отношение длинной и короткой осей (А/В), ядерно-цитоплазматическое отношение (ЯЦО). Статистическую обработку результатов проводили с использованием программ «MS Excel» и «Statistica». В качестве характеристик полученных выборок использовали среднее, стандартное отклонение, стандартную ошибку среднего, объем выборки. Достоверность различий между группами данных оценивали с помощью непараметрического критерия Манна-Уитни (для малых и средних выборок, n≤30) или критерия Стьюдента (для больших выборок, n>30).
Результаты и их обсуждение. Кинетика роста обеих изученных линий МСК обнаруживала зависимость от свойств культурального пластика (табл. 1). Линия 1 демонстрировала примерно пятикратный прирост клеточной массы в планшетах обоих исследованных производителей. Тот же показатель для клеток линии 2 отличался в 1,5 раза. Не менее значимыми оказались различия в средней скорости роста: на пластике производства Greiner клетки линии 2 росли практически вдвое быстрее, чем при использовании других планшетов. В целом пластик производства Greiner обеспечивал более высокие кинетические характеристики, причем преимущество перед планшетами Biofil оказалось более существенным для клеток с высоким пролиферативным потенциалом.
Таблица 1
Кинетические характеристики культур МСК (M±m, n=50)
|
Линия 1 |
Линия 2 |
|||
|
Greiner |
Biofil |
Greiner |
Biofil |
|
|
Плотность клеток (кл/см2) |
2577 ± 89 |
1987 ± 57* |
5471 ± 164 |
2985 ± 88* |
|
Относительный прирост биомассы |
5,12 ± 0,21 |
4,98 ± 0,18 |
11,99 ± 0,39 |
7,96 ± 0,26* |
|
Средняя скорость роста, (кл/см2 сут) |
539 ± 22 |
413 ± 14* |
1262 ± 41 |
664 ± 22* |
* – достоверно при p<0,01 по сравнению с ростом той же линии на культуральном пластике другого производителя.
Культивируемые in vitro мезенхимальные стромальные клетки человека в течение пятого пассажа сохраняли гетерогенность. В популяциях были выделены шесть морфологических типов клеток.
1. Крупные широко распластанные клетки полигональной, округлой или неправильной формы с множественными короткими отростками. Длина малой оси не менее 100 мкм, но могла превышать 200 мкм. Отношение большой оси к малой (А/В) около 2,5. Четко очерченное ядро располагалось по центру клетки; ядерно-цитоплазматическое отношение (ЯЦО) составляло примерно 0,03. Оптически более плотная эндоплазма овальной или веретеновидной формы. Периферическая часть цитоплазмы прозрачная, иногда зернистая (рис. 1А). Нередко фиксировались делящиеся и многоядерные клетки.

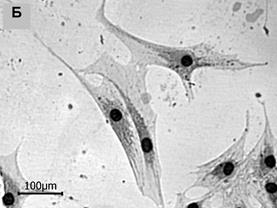
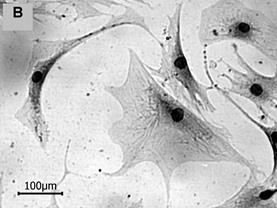
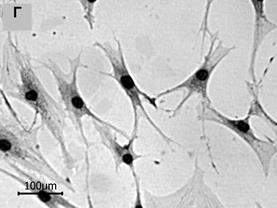
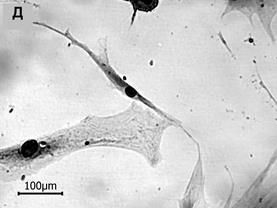
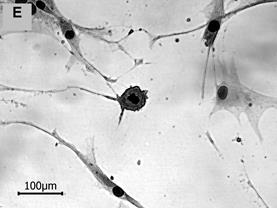
Рис. 1. Морфологические типы в популяциях МСК человека (об. 20х)
2. Клетки фибробластоподобной формы с более или менее неравномерной по плотности цитоплазмой, хорошо заметным крупным ядром. Длина короткой оси варьировала в диапазоне 50–100 мкм, А/В около 3,5; ЯЦО в интервале от 0,04 до 0,06. Такие клетки активно пролиферировали, перекрывая друг друга участками цитоплазмы (рис. 1Б).
3. Клетки полулунной формы, ядро и плотный околоядерный участок цитоплазмы которых смещены к вогнутому краю. Размер короткой оси 40–80 мкм (иногда более 100 мкм); длинная ось превышает короткую в 4–6 раз; ЯЦО в диапазоне 0,05–0,07 (рис. 1В).
4. Некрупные клетки звездчатой формы с тонкими длинными отростками. Цитоплазма этих клеток характеризовалась равномерной оптической плотностью, эндоплазма часто не определялась (рис. 1Г). Размер малой оси лежал в пределах 30–50 мкм, тогда как соотношение осей было близко к 6, ЯЦО составляло 0,06–0,07.
5. Клетки веретеновидной формы. Короткая ось редко превышала 40 мкм, соотношение А/В составляло 8 и более. Ядро и приядерный объем цитоплазмы хорошо идентифицировались. Из всех выделенных морфологических типов эти клетки имели самое большое ядерно-цитоплазматическое отношение – около 0,09 (рис. 1Д).
6. Округлые клетки малого диаметра (до 30 мкм) с четким ядром. Встречались крайне редко (рис. 1Е).
Хотя перечисленные морфологические типы присутствовали во всех популяциях, их соотношение сильно варьировало в зависимости от линии МСК и производителя культурального пластика (табл. 2). Если в популяциях с высоким пролиферативным потенциалом (линия 2) преобладали фибробластоподобные и веретеновидные клетки, то для популяций с низкой скоростью роста (линия 1) клетки с веретеновидной морфологией были менее свойственны. Здесь шире представлены крупные пластающиеся, а также звездчатые клетки. Характерно, что при культивировании в планшетах Greiner обеих изученных линий на долю пластающихся форм (морфотипы 1-3) в клеточных популяциях приходилось 70–80%, тогда как при использовании планшетов Biofil этот показатель составлял лишь 55–60%.
Таблица 2
Процентное соотношение клеток разных морфологических типов в популяциях МСК
(M±m, n=20)
|
Линия 1 |
Линия 2 |
|||
|
Greiner |
Biofil |
Greiner |
Biofil |
|
|
Морфотип 1 |
15,6 ± 2,7 |
13,3 ± 1,6 |
7,3 ± 1,1 |
8,0 ±1,2 |
|
Морфотип 2 |
49,6 ± 4,2 |
27,8 ± 2,8** |
48,7 ± 3,8 |
34,6 ± 3,9* |
|
Морфотип 3 |
11,4 ± 1,0 |
16,8 ± 1,7* |
10,7 ± 2,6 |
19,3 ± 2,5* |
|
Морфотип 4 |
11,8 ± 2,4 |
21,5 ± 3,3* |
1,4 ± 0,7 |
9,8 ± 1,7** |
|
Морфотип 5 |
10,6 ± 1,5 |
20,1 ± 1,7** |
31,4 ± 3,8 |
28,3 ± 2,6 |
|
Морфотип 6 |
1,0 ± 0,5 |
0,4 ± 0,3 |
0,6 ± 0,3 |
0,0 ± 0,0 |
|
Делящиеся клетки |
4,3 ± 1,0 |
6,3 ± 1,5 |
4,6 ± 1,3 |
4,6 ± 0,8 |
|
Многоядерные клетки |
1,4 ± 0,3 |
1,2 ± 0,6 |
1,2 ± 0,3 |
0,9 ± 0,3 |
* – достоверно при p<0,05 по сравнению с ростом той же линии на культуральном пластике другого производителя; ** – достоверно при p<0,01 по сравнению с ростом той же линии на культуральном пластике другого производителя.
Использование планшетов разных производителей влияло на морфометрические показатели клеток, особенно в популяциях с низкой пролиферативной активностью. Так, при выращивании на пластике Biofil клетки полулунной и веретеновидной формы не только встречались чаще, чем при культивировании в планшетах Greiner, но и имели больший линейный размер, а среди крупных пластающихся форм гигантские клетки (В>200 мкм) были многочисленнее (рис. 2). Отмеченные изменения длины короткой оси сопровождались соответствующими сдвигами отношений А/В и ЯЦО (данные не приводятся).
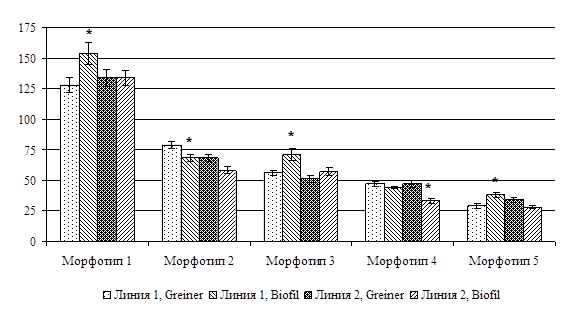
Рис. 2. Длина малой оси клеток разных морфологических типов (мкм).
* – достоверно при p<0,05 по сравнению с ростом той же линии на культуральном пластике другого производителя, n=50.
Полученные нами данные о гетерогенности популяций МСК жировой ткани (МСК-ЖТ) человека совпадают с описанными ранее. Так, Мусина Р.А. с коллегами отмечали, что МСК-ЖТ разнородны как по размерам, так и по форме. В прикрепленном к пластику виде диаметр клеток варьируют от 10 до 300 мкм, при этом встречается несколько характерных форм клеток: тонкие веретеновидные, типичные фибробластоподобные, плащевидные [4]. По другим данным в популяциях МСК-ЖТ присутствуют треугольные или звездчатые клетки (40-60 мкм), веретеновидные клетки (60-100 мкм) и очень крупные (до 200 мкм) клетки с большим количеством отростков [8]. Наконец, имеются сведения, о том, что популяциям МСК-ЖТ человека и крупных млекопитающих помимо фибробластоподобных и веретеновидных клеток свойственны небольшие (20 мкм) темные округлые клетки [2]. Проведенный нами морфологический анализ позволил выявить одновременное присутствие в популяциях МСК-ЖТ человека не трех, как отмечают многие авторы, а большего числа клеточных типов. Среди пластающихся форм были обнаружены крупные широко распластанные клетки, фибробластоподобные клетки и клетки полулунной формы. Клетки малого и среднего размера были представлены звездчатыми, веретеновидными и округлыми формами. Столь широкое морфологическое разнообразие ранее было обнаружено в популяциях МСК костного мозга [1].
В литературе высказываются две точки зрения, объясняющие гетерогенность культур МСК. Неоднородность популяций МСК может отражать особенности их строения на разных этапах клеточного цикла. Это мнение подкрепляется наблюдениями за сменой доминирующих форм в ходе монослойного культивирования [4], а также морфологической гетерогенностью клеток в пределах одиночных колоний [3]. С другой стороны, морфологическая разнородность может быть обусловлена неодинаковым положением клеток в гистогенетическом ряду, что свидетельствует о сложной иерархической структуре популяций МСК [5]. Считается, что веретеновидные клетки имеют более высокую скорость пролиферации по сравнению с плоскими (видимо, самой зрелой субпопуляцией МСК), а наибольшая скорость роста характерна для очень мелких округлых клеток [5]. Отмеченные закономерности хорошо согласуются с полученными нами результатами. Популяции МСК, демонстрирующие высокие кинетические показатели (линия 2), богаты веретеновидными клетками, и, напротив, в популяциях МСК с невысоким пролиферативным потенциалом (линия 1) широко представлены пластающиеся формы. Примечательно, что адгезивные свойства культурального пластика производства Greiner обеспечивают доминирование в популяциях МСК фибробластоподобных клеток, в то время как физико-химические особенности поверхности планшетов Biofil способствуют распространению клеток полулунной и звездчатой форм. Пролиферативная активность и потенциал дифференцировки таких клеток на настоящий момент остаются не охарактеризованными.
Заключение. Проведенные исследования подтвердили гетерогенность популяций МСК, выделенных из жировой ткани человека. Морфологическое типирование позволило выделить шесть клеточных форм, одновременно присутствующих в культурах МСК вне зависимости от пролиферативного потенциала изучаемой линии и производителя культурального пластика. Адгезивные свойства пластика влияют на кинетические характеристики популяций, соотношение в них разных морфологических форм, морфометрические показатели клеток. В работе со стволовыми клетками следует уделять особое внимание подбору культурального пластика с учетом как обеспечиваемой им скорости клеточного роста, так и морфологического разнообразия формирующихся популяций.



