Ожоговая болезнь продолжает привлекать внимание патофизиологов и клиницистов, что обусловлено высокой частотой термических повреждений, тяжестью медицинских и социальных последствий. Число умерших пациентов на разных стадиях ожоговой болезни продолжает оставаться стабильно высоким, занимая одно из первых мест среди всех больных хирургического профиля [6].
Термическое воздействие на ткани с распространённым поражением поверхности тела вызывает у пострадавшего шок с последующим формированием комплекса компенсаторно-приспособительных процессов, которые зачастую приобретают патологический характер и создают условия для развития угрожающих жизни осложнений [4, 5]. Известно, что основными участниками экстренной и отсроченной регуляции постоянства внутренней среды организма при различных критических состояниях являются нервные, иммунные и гемостатические компоненты гомеостаза. Нарушение гемокоагуляционного баланса крови и развитие ДВС-синдрома вносят существенный вклад в развитие синдрома полиорганной недостаточности, который возникает у 30–50 % тяжелообожженных, до 80–90 % из которых погибают в различные периоды ожоговой болезни [1, 8].
Важнейшей задачей является оценка риска развития ДВС-синдрома у пациентов с термической травмой в каждом конкретном случае, возможность своевременно и адекватно его предупреждать, а при возникновении – купировать [2, 3, 7]. Однако до сих пор нет единого мнения об объективных критериях прогнозирования риска ДВС-синдрома у пациентов с тяжелыми термическими поражениями. Дальнейшее изучение и уточнение изменений в системе гемостаза, как важнейших факторов ДВС-синдрома и, как следствие, синдрома полиорганной недостаточности при ожоговой травме, является одним из актуальных и перспективных направлений в комбустиологии.
Целью исследования является анализ динамики показателей свертывающей и антикоагулянтно-фибринолитической активности плазмы крови в зависимости от исхода ожоговой болезни.
Объекты и методы исследования. В основу работы положен анализ обследования 37 мужчин с ожогами кожных покровов IIIБ-IV степени тяжести, в возрасте от 21 до 45 лет, находившихся на лечении в ГУЗ «Городская клиническая больница № 7» г. Саратова. Все пациенты разделены на две группы в зависимости от исхода ожоговой болезни. В I группу вошли 26 пациентов, выживших после термической травмы, средний возраст которых составил 37,3 года. Во II группу включили 11 пациентов, умерших на фоне ожоговой болезни, средний возраст – 40,8 лет. Во II группе 4 тяжелообожженных умерли в течение первой недели, 4 пострадавших – во вторую неделю, 3 пациента – на третьей неделе. Группу сравнения (К) составили 25 мужчин без ожоговых поражений, средний возраст – 36,5 лет.
Пострадавшие получали стандартное лечение в соответствии со степенью тяжести термической травмы. Всем пациентам проводилось определение протромбинового времени (ПВ), активированного частичного тромбопластинового времени (АЧТВ), тромбинового времени (ТВ), концентрации фибриногена, определение растворимых фибринмономерных комплексов (РФМК), активности антитромбина-III (АТ-III) и XIIа-зависимого фибринолиза (XIIа-ЗФ). Исследование проводилось на 1-е, 3-и, 7-е, 14-е и на 21-е сутки после ожога.
Результаты и их обсуждение. При поступлении в стационар у тяжелообожженных отмечались различные изменения в системе гемостаза в зависимости от исхода заболевания.
В группе выживших после термической травмы на 1-е, 3-и и 21-е сутки нахождения в стационаре не выявили достоверного изменения активности плазменных факторов свертывания крови по сравнению с группой сравнения. Только на 7-е и 14-е сутки после получения ожога отмечалось удлинение протромбиного времени, что свидетельствует о снижении активности факторов внешнего пути свертывания крови (p<0,05) (табл. 1).
Таблица 1
Показатели плазменного звена системы гемостаза у тяжелообожженных (I, II гр.) и лиц группы сравнения (К) (M+m)
|
Показатели |
Группы |
1-е сутки |
3-и сутки |
7-е сутки |
14-е сутки |
21-е сутки |
|
ПВ (сек) |
I |
95,2+2,55 |
93,5+2,42 |
76,6+1,27* |
81,6+1,55* |
88,7+1,42 |
|
II |
78,0+1,39*0 |
66,3+1,46*0 |
60,4+2,36* |
35,7+1,18*0 |
33,3+1,24*0 |
|
|
К |
92,7+0,93 |
|||||
|
АЧТВ (сек) |
I |
31,0+1,39 |
34,7+1,27 |
28,3+1,22 |
30,8+1,15 |
31,7+0,37 |
|
II |
41,5+1,72*0 |
56,3+1,42*0 |
47,9+1,37*0 |
51,8+1,75*0 |
77,7+1,61*0 |
|
|
К |
29,3+0,55 |
|||||
|
ТВ (сек) |
I |
17,2+0,65 |
16,6+0,42 |
17,6+0,22 |
16,5+0,72 |
17,4+0,93 |
|
II |
19,0+2,05*0 |
22,3+1,37*0 |
22,9+1,65*0 |
28,4+1,42*0 |
35,3+1,79*0 |
|
|
К |
16,8+0,86 |
|||||
Примечание: К – группа сравнения.
* – p<0,05 – достоверность по отношению к данным группы сравнения.
0 – p<0,05 – достоверность по отношению к данным I группы.
АЧТВ-тест, характеризующий активность факторов внутреннего пути свертывания крови, и ТВ-тест, отражающий конечные этапы свертывания крови, на протяжении всего исследования не имели достоверных отличий от значений в группе сравнения. Подобная динамика показателей коагулограммы пациентов, выживших после тяжелой ожоговой травмы, является адекватной реакцией системы гемостаза в ответ на проводимое лечение, включающее антикоагулянтные препараты.
В группе пациентов, умерших после получения термической травмы, показатели свертывающей системы характеризовались резким снижением активности плазменных факторовкак внешнего, так и внутреннего пути свертывания крови (табл. 1). Средняя величина ПВ в 1-е сутки после получения термической травмы по сравнению с показателями в группе сравнения снизилась на 14,7 %, АЧТВ – на 41,8 %, ТВ – на 13,1 %. При дальнейшем развитии ожоговой болезни выявилось нарастающее угнетение всех факторов свертывания, особенно выраженное непосредственно перед смертью. В последний день жизни тяжелообожженных среднее значение ПВ удлинилось до 24,4+1,06 сек, АЧТВ – до 65,2+2,37 сек, ТВ – до 31,2+1,53 сек, что значительно превышает данные показатели в группе сравнения (p<0,05). Степень нарастающего дефицита плазменных факторов свертывания крови у пациентов II группы отражает глубину гемостазиологических нарушений и тяжесть развивающегося ДВС-синдрома.
Показатели концентрации фибриногена и РФМК были различными у обожженных в группах I и II в различные периоды болезни и имели достоверное отличие в каждой группе от показателя лиц группы сравнения (p<0,05) (табл. 2).
Таблица 2
Концентрация фибриногена и РФМК у тяжелообожженных (I, II гр.) и лиц группы сравнения (К) (M+m)
|
Показа-тели |
Группы |
1-е сутки |
3-и сутки |
7-е сутки |
14-е сутки |
21-е сутки |
|
Фибри-ноген (г/л) |
I |
3,4+0,66 |
4,6+1,01* |
4,9+0,99* |
4,5+0,75* |
3,6+0,71 |
|
II |
5,4+1,22*0 |
4,7+1,36*0 |
4,2+1,14*0 |
2,9+1,66*0 |
2,4+0,45*0 |
|
|
К |
3,2+0,64 |
|||||
|
РФМК (мг/л х10-9) |
I |
95,5+8,77* |
186,4+12,84* |
200,3+13,52* |
175,2+11,69* |
111,8+11,34* |
|
II |
131+9,23*0 |
222+13,65*0 |
240+12,92*0 |
270+13,37*0 |
282+13,83*0 |
|
|
К |
0 |
|||||
Примечание: К – группа сравнения.
* – p<0,05 – достоверность по отношению к данным группы сравнения.
0 – p<0,05 – достоверность по отношению к данным I группы.
В плазме здоровых людей (К) гиперфибриногенемия и растворимые фибринмономерные комплексы отсутствовали, но определялись в разные сроки в плазме крови у пациентов в обеих группах, пострадавших от ожога. У пациентов I группы в 1-е сутки после получения травмы среднее значение концентрации фибриногена в плазме было стабильным и статистически значимо не отличалось от группы сравнения (M+m=3,4+0,66 г/л против 3,2+0,64 г/л). В дальнейшем содержание фибриногена сначала увеличивалось, достигая максимума к 7-м суткам, составляя в среднем 4,9+0,99 г/л, затем снижалось к 14-м суткам и возвращалось к исходному значению на 21-е сутки после получения термической травмы. Гиперфибриногенемия, незначительно возрастающая в течение первых двух недель после получения ожога, объясняется развитием умеренного воспалительного ответа на термическую травму. Отсутствие гиперфибриногенемии в более поздние стадии ожоговой болезни свидетельствует об адекватном характере защитно-приспособительных реакций организма и меньшем риске возникновений осложнений, угрожающих жизни.
Динамика содержания в плазме крови продуктов паракоагуляции на протяжении периода наблюдения также указывает на благоприятное течение ожоговой болезни у лиц I группы. В группе выздоровевших пациентов концентрация РФМК в первые сутки достигала в среднем 95,0 мг/л, затем постепенно нарастала на 7-e сутки до 200,0 мг/л и возвращалась к исходному уровню к 21-м суткам нахождения в стационаре. Среднее значение содержания РФМК у данных пациентов на протяжении всего времени нахождения в стационаре составило 134,3+12,83 мг/л.
У пациентов II группы уровень фибриногена в ранний период после травмы был статистически значимо повышен, составляя в среднем 5,4+1,22 г/л, но снижался в более поздние сроки и особенно выраженно (в 1,5–2 раза) непосредственно перед смертью (табл. 2). Подобная динамика фибриногена на фоне дефицита плазменных факторов свертывания крови свидетельствует о высоком риске развития диссеминированного внутрисосудистого свертывания крови. Кроме того, тяжелообожженные II группы в 1-е сутки после получения травмы имели уровень РФМК на 40 % выше, чем пострадавшие первой группы (р>0,05). В последующие сутки отмечали динамическое нарастание содержания продуктов паракоагуляции с максимальными значениями этого показателя непосредственно перед смертью. Средняя концентрация РФМК составила 248,0+13,56 мг/л. Нарастание концентрации фибринмономерных комплексов свидетельствует о расширении пула фибриногена и активации внутрисосудистого свертывания крови. Фибринмономерные комплексы блокируют ряд плазменных факторов, чем и объясняется у данных пациентов тенденция к снижению концентрации фибриногена и угнетение как внешнего, так и внутреннего путей свертывания крови.
Нами проведен анализ изменений показателей антикоагулянтной и фибринолитической активности плазмы крови у здоровых людей и ожоговых пациентов (рис. 1, 2).
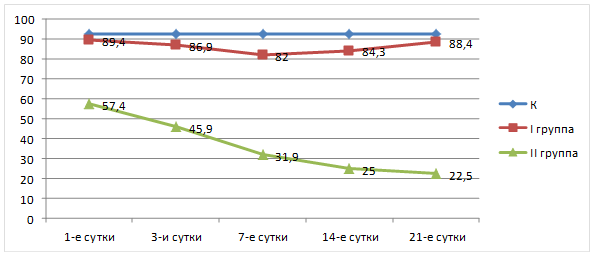
Рис. 1. Изменение активности антитромбина-III (%) у тяжелообожженных (I, II гр.) и лиц группы сравнения (К)
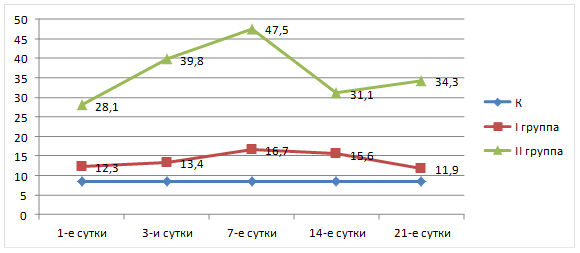
Рис. 2. Изменение времени XIIа-зависимого фибринолиза (мин) тяжелообожженных (I, II гр.) и лиц группы сравнения (К)
При исследовании антикоагулянтной и фибринолитической активности плазмы крови нами получены результаты с достоверным отличием показателей умерших пациентов от результатов людей в группах сравнения (К) и выживших после термической травмы (I группа). В плазме здоровых людей активность АТ-III составила в среднем 92,4+8,75 %, время XIIа-зависимого фибринолиза – 8,5+2,13 мин.
При сравнении результатов тяжелообожженных I группы с показателями группы сравнения угнетение фибринолитической способности и незначительное снижение активности АТ-III ниже 80 % (до 77,2 %) отметили только в 50 % наблюдений. У половины пациентов на 3-и сутки наблюдения выявили ускорение времени эуглобулинового фибринолиза более чем на 30 % и возвращение к исходным показателям на 14-е и 21-е сутки. Время фибринолиза статистически значимо увеличивалось только на 7-е сутки наблюдения (M+m=16,7+4,5 мин), возвращаясь к исходным значениям на 21-е сутки наблюдения. Активность АТ-III в этой группе сохранялась на исходном уровне на протяжении всего периода наблюдения и не имела достоверного отличия от группы сравнения (p<0,05).
Анализ показателей противосвертывающего механизма системы гемостаза у погибших пациентов выявил выраженный дефицит АТ-III и плазминогена, являющего пусковым фактором эуглобулинового фибринолиза (p<0,05). В 1-е сутки после термической травмы у всех пациентов активность основного эндогенного антикоагулянта снижалась на 35 %, а время XIIа-ЗФ увеличивалось более чем в три раза (M+m=28,1+3,8 мин), по сравнению с группой сравнения (К). При последующих исследованиях зафиксировано дальнейшее нарастание антитромбиновой и фибринолитической недостаточности, с максимальным их дефицитом перед смертью. В последний день жизни пациентов среднее значение АТ-III составило 21,6+3,28 %, время XIIа-ЗФ – 39,22+7,64 мин. Продолжающееся падение активности АТ-III у пациентов, вероятно, связано с развитием ДВС-синдрома, а увеличение времени лизиса эуглобулинового сгустка свидетельствует о нарушении согласованности работы различных механизмов системы гемостаза [2, 4, 8]. Как известно, одним из звеньев патогенеза ДВС-синдрома является образование микросгустков крови и блокада микроциркуляции в органах-мишенях (мозг, надпочечники, почки, печень, желудок и кишечник) с развитием дистрофических и деструктивных нарушений в них, которые, вероятно, и приводят к синдрому полиорганной недостаточности.
Заключение. Таким образом, сравнительное исследование системы гемостаза у тяжелообожженных пациентов позволило установить зависимость исхода ожоговой болезни от выраженности и динамики изменений показателей системы гемостаза. У пациентов с благоприятным исходом ожоговой болезни в период ожогового шока выявилось умеренное повышение концентрации фибриногена и продуктов паракоагуляции, с тенденцией к нарастанию изменений к 7–10 суткам после получения травмы при сохранении активности АТ-III на уровне не менее 70 % на всем протяжении заболевания. В группе пациентов с летальным исходом уже в ранний период ожоговой болезни выявлялась значительная гиперфибриногенемия, сменяющаяся выраженной тенденцией к снижению концентрации фибриногена, дефицит АТ-III и глубокое угнетение фибринолиза. Снижение активности АТ-III менее 70 % и трехкратное увеличение времени XIIа-зависимого фибринолиза на фоне дефицита плазменных факторов свертывания крови является, по нашему мнению, прогностическим предиктором развития жизненно опасных осложнений в системе гемостаза при ожоговой болезни.



