Скорость деструкции органических соединений в водоемах и водотоках представляет значительный интерес в связи с исследованием процессов трансформации веществ и механизма самоочищения, а также в связи с изучением отдельных звеньев круговорота биологически важных элементов в природных водах. В литературе имеются лишь отдельные сведения о возможных путях, механизме и скорости распада органических соединений естественного происхождения в зависимости от условий среды [2-4].
Изучение динамики содержания органических соединений в натурных условиях не позволяет получить однозначную и достаточно надежную информацию о происходящих процессах, так как в этих условиях одновременно могут проходить как деструкция, так и поступление соединений из различных источников (донных отложений, прижизненные выделения гидробионтов, разложение клеток отмерших организмов и т.д.). Кроме того, на происходящие в водоеме процессы одновременно влияет ряд факторов, часто противодействующих друг другу.
В связи с этим опыты по определению влияния температуры и степени кислородного насыщения воды на скорость деструкции растворимых белков как начальных продуктов распада клеток гидробионтов является новым научным направлением в гидробиологии и требует доказательства в лабораторных условиях.
Материалы и методика исследования
Использован метод добавок [3,5], так как естественное содержание белков в природных водах недостаточно для того, чтобы с помощью существующих методов анализа получить надежные и достаточно четкие результаты.
В качестве добавок использовали бычий альбумин. Замена растительного белка животным, как нам представляется, не должна существенно влиять на ход физико-химических процессов, так как эти белки имеют сходную структуру.
Исследование проводили с использованием дистиллированной и природной воды, взятой с прудовых хозяйств II и V эколого-фенологической зоне. Воду предварительно выдерживали в течение 10 суток, после чего определяли содержание ряда химических ингредиентов, а также некоторых физиологических групп бактерий. Периодически в течение опытов устанавливали (по обще принятым в гидрохимической практике методикам) величину рН, содержание О2, минерального азота, карбонатов, аминокислот, растворимого белка [1], бихроматную окисляемость с улавливанием летучих органических соединений [6], а также общее количество бактерий и численность гетеротрофов, в том числе обладающих протеолитическими свойствами [5]. Опыты проводили в колонках из оргстекла емкостью 10 л. Содержание растворенного в воде кислорода регулировали, периодически продувая воздух через колонки. Анаэробные условия создавали добавлением рассчитанного количества сульфата натрия или продуванием азота.
Результаты лабораторных исследований
Опыты проводили с использованием дистиллированной воды и воды с рыбоводных прудов V эколого-фенологической зоны в аэробных и анаэробных условиях при температуре 200С. Во все колонки в начале опыта добавляли альбумин, в расчете 200 мг на литр. Ниже приведены данные по содержанию основных ингредиентов в исходной воде (V эколого-фенологическая рыбоводная зона) (табл. 1), динамике деструкции белка в процессе опыта, а также изменение общей численности микроорганизмов и гетеротрофных бактерий, в том числе обладающих протеолетическими свойствами (рис.1).
Таблица 1
Химический состав воды из рыбоводного пруда V эколого-фенологической зоны и динамика содержания некоторых ингредиентов в процессе опытов
|
Ингредиенты |
Природная вода |
Дистиллированная вода |
||||||||||||||||||
|
8 мг О2/л |
0 мг О2/л |
8 мг О2/л |
0 мг О2/л |
|||||||||||||||||
|
Время снятия показаний после начала опытов, сут. |
||||||||||||||||||||
|
0 |
4 |
8 |
17 |
26 |
0 |
4 |
8 |
17 |
26 |
0 |
4 |
8 |
17 |
26 |
0 |
4 |
8 |
17 |
26 |
|
|
NH4+мг/л |
1,56 |
0 |
3,1 |
5,70 |
8,6 |
1,56 |
0 |
0,90 |
0,97 |
2,20 |
1,56 |
0,3 |
0,3 |
1,20 |
0,50 |
1,56 |
0,3 |
0,4 |
0,86 |
0,77 |
|
NO3- мг/л |
0,58 |
0 |
0 |
0 |
0 |
0,58 |
0 |
0 |
0 |
0 |
0,58 |
0 |
0 |
0 |
0 |
0,58 |
0 |
0 |
0 |
0 |
|
СО32- мгС/л |
0,6 |
0 |
0 |
0 |
0 |
0,6 |
0 |
0 |
0 |
0 |
0,6 |
0 |
0 |
0 |
0 |
0,6 |
0 |
0 |
0 |
0 |
|
НСО3- мгС/л |
12,0 |
6,5 |
7,9 |
12,0 |
17,0 |
12,0 |
5,9 |
26,0 |
33,0 |
- |
12,0 |
5,9 |
5,9 |
5,80 |
7,10 |
12,0 |
6,5 |
4,1 |
1,8 |
4,40 |
|
СО2мгС/л |
0 |
1,9 |
- |
13,0 |
14,1 |
0 |
10,2 |
- |
17,8 |
24,5 |
0 |
1,7 |
- |
8,40 |
18,9 |
0 |
3,1 |
- |
27,5 |
31,5 |
Примечание: содержание белков 110, аминокислот - 40 мкг/л; Fe общ. -1,1, Са2+-50, Mg2+-11, К++Na+ -19, CI- -16, SO42-- 22мг/л, Cu2+-3,8 мкг/л.
Полученные результаты показывают, что деструкция белка в естественной воде протекает значительно быстрее, чем в дистиллированной: период полураспада белка в аэробных условиях в природной воде составляет 7 суток, в дистиллированной – 30. В анаэробных условиях скорость деструкции белка снижается и соответственно составляет 12 и 62 суток. Так как опыты проводили в нейтральных условиях, общая численность микроорганизмов в колонках с дистиллированной водой уже на восьмые сутки возросла до 25 млрд. кл/мл и все же количество бактерий в них было в два раза ниже, чем в колонках с природной водой, снижение количества микроорганизмов в течение опыта проходило аналогично во всех вариантах и к 44-му дню стало практически одинаковым. Численность гетеротрофных бактерий спустя 5-6 суток после внесения белка в колонках с дистиллированной водой превысила таковую в природной воде. Однако процент микроорганизмов, обладающих протеолитическими свойствами был значительно меньше (исключением были опыты в анаэробных условиях).
Различия в скорости распада белка в природной и дистиллированной воде можно объяснить большей активностью естественных сообществ микроорганизмов по сравнению с получившими развитие в искусственной среде (дистиллированная вода после внесения в нее белка).
Динамика содержания других ингредиентов позволяет сделать лишь предварительные выводы о происходящих процессах. Во всех случаях величина рН изменилась в пределах 6,5-8,0. Почти во всех вариантах наблюдалось увеличение содержания бикарбонатов и свободной углекислоты за счет минерализации органических веществ. Отмечено увеличение в значительной степени содержания NH4+. Это позволяет предположить, что распад аминокислот происходил преимущественно по пути дезаминирования. Концентрация нитрат-ионов в исходной воде составляла 0,6 мг/л. В дальнейшем через трое суток, в связи с развитием микрофлоры содержание нитратов снизилось до аналитического нуля и не повышалось в течение всего опыта.
Количество органического углерода, вычисленное по бихроматной окисляемости, на 26-е сутки опыта также снизилось и составляла в аэробных условиях 63% начального, в анаэробных, при использовании воды V эколого-фенологической рыбоводной зоны – 72%, дистиллированной – 80%. Содержание минеральных форм углерода увеличилось соответственно на 18,2 и 20%. Уменьшение количество органического углерода и свободной углекислоты в аэробных условиях по сравнению с анаэробными можно объяснить частичным удалением легколетучих органических соединений, СО2 при барбатировании воды воздухом.
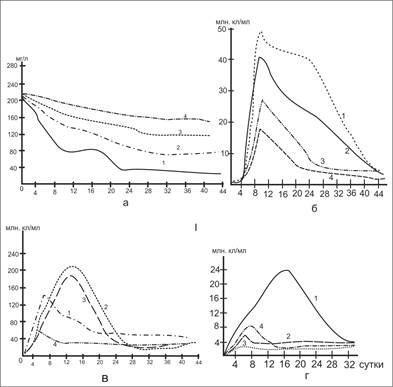
Рис.1. Деструкция белка и динамика численности микроорганизмов в природной (1,2) и дистиллированной (3,4) воде: а – белки; б – общая численность бактерий; в – численность гетеротрофов; г – микроорганизмов, обладающих протеолитическими свойствами 1,3 – содержание О2 8мг/л, 2,4 – 0 мг/л.
Более детально влияние температуры на скорость деструкции белков в аэробных и анаэробных условиях исследовали на воде IV эколого-фенологических рыбоводных зон химический состав которой приведен ниже (табл.2).
Таблица 2
Химический состав воды IV эколого-фенологической рыбоводной зоны и некоторые химические ингредиенты (мгС/л) в начале (1) и в конце (2) опытов
|
t,C0 |
O2 мг/л |
СО2 |
НСО3- |
Сумма |
|||
|
1 |
2 |
1 |
2 |
1 |
2 |
||
|
10 |
10,2 |
5 |
6,0 |
38 |
33,5 |
43 |
39,5 |
|
10 |
0 |
5 |
19,1 |
38 |
31,7 |
43 |
50,8 |
|
20 |
9,4 |
5 |
6,5 |
38 |
32,9 |
43 |
39,4 |
|
20 |
0 |
5 |
18,6 |
38 |
33,5 |
43 |
52,1 |
|
30 |
8,6 |
5 |
4,5 |
38 |
35,4 |
43 |
39,9 |
|
30 |
0 |
5 |
17,1 |
38 |
32,3 |
43 |
49,4 |
Примечание. Содержание белков - 120, аминокислот - 30 мкг/л; Fe общ. - 0,2; Са2+- 43; Mg2+ - 8,7; К+ + Na+ - 8,8; CI- - 10,3; SO42- - 17,4 мг/л; Cu2+ - 3 мкг/л. Исходное и конечное содержание СО32- равно нулю.
Температуру воды поддерживали на уровне 100, 200 и 300С. С целью приближения к естественным условиям была взята меньшая исходная концентрация белка (15 мг/л). Кроме изменения содержания белков и развития микрофлоры в процессе опытов определяли также величину рН, суммарное содержание азота, минеральных форм углерода до и после опытов и составляли их баланс (табл.2,3, рис. 2).
Таблица 3
Концентрации азотсодержащих соединений (мг/л) в начале (1) и в конце (2) опытов
|
t,0C |
O2 мг/л |
NH4+ |
NO3- |
NO2- |
Белок |
Аминокислота |
Сумма |
||||||
|
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
||
|
10 |
10,2 |
0,52 |
1,60 |
0,13 |
0,08 |
0,0007 |
0,0002 |
2,5 |
0,70 |
0,23 |
1,25 |
3,40 |
3,63 |
|
10 |
0 |
0,52 |
1,4 |
0,13 |
0,08 |
0,0007 |
0,0001 |
2,5 |
1,0 |
0,23 |
0,88 |
3,40 |
3,36 |
|
20 |
9,4 |
0,52 |
1,0 |
0,13 |
0,12 |
0,0007 |
0,0003 |
2,5 |
0,83 |
0,23 |
1,78 |
3,40 |
3,73 |
|
20 |
0 |
0,52 |
1,2 |
0,13 |
0,10 |
0,0007 |
0,0002 |
2,5 |
1,2 |
0,23 |
0,86 |
3,40 |
3,36 |
При рассмотрении данных по динамике содержания белка (рис. 2а) отчетливо проявляется влияние температуры на скорость его деструкции в аэробных условиях в начальный период опыта. Периоды полураспада составляют 1,5; 5,0 и 9,5 суток при температуре соответственно 300, 200 и 100С. Однако, по истечении определенного времени (в нашем случае около 15 суток) процесс деструкции резко замедляется и содержание белка остается почти неизменным в течение длительного времени, составляя около 5мг/л. В аэробных условиях наибольшая численность бактерий зарегистрировано при 100С. Однако, максимум в их развитии при этой температуре наступил на четверо суток позже, чем при 20 и 300С. Количество гетеротрофных бактерий (рис.2г) при 20 и 300С превышало их численность чем при 100С. К 14-му дню опыта общее содержание микроорганизмов при 20 и 300С практически сравнялось, при 100С продолжало оставаться намного выше. Стабилизация в развитии бактерии наступило на 18 сутки.
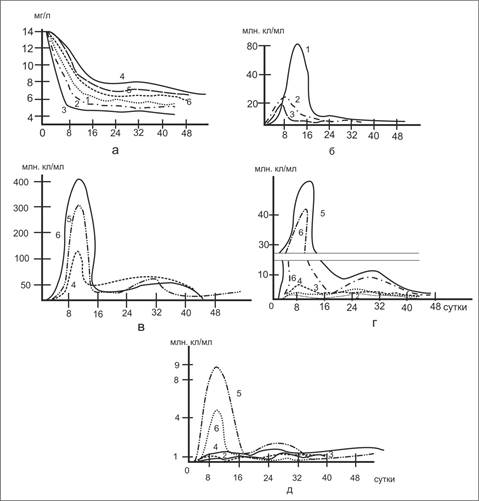
Рис.2. Влияние температуры на деструкцию белка и развитие микроорганизмов: 1-100(содержание О2 10,2 мг/л); 2-200(9,2 мг О2/л); 3-300 (8,8 мг О2/л); 4-100, 5-200, 6-300(0 мг О2/л); а - белки; б - общая численность бактерий в аэробных условиях; в - то же в анаэробных условиях; г-численность гетеротрофов; д-микроорганизмов
В анаэробных условиях динамика содержания белков носит иной характер. Кривые имеют волнообразный вид, что может быть объяснено вторичным загрязнением воды за счет белка имеющихся микроорганизмов. Процесс деструкции идет значительно медленнее - период полураспада составляет для всех случаев около 33 суток.
Интересно отметить, что в аэробных условиях по сравнению с анаэробными количество микроорганизмов значительно меньше при большей скорости деструкции белка. Это однозначно указывает на более высокую активность микроорганизмов в аэробных условиях по сравнению с анаэробными.
Мы попытались дать количественную характеристику активности микроорганизмов. Для этого по данным их развития (рис.2 г, д) рассчитали среднее количество ко времени, соответствующее половине максимального роста ( ½ млн.кл/мл). При этом исходим из того, что в начальный период развития число жизнеспособных бактерий значительно выше числа отмирающих. В связи с чем можно пренебречь количеством белка, поступающим в воду за счет распада микроорганизмов. Одновременно по кривым (рис.2а) находим количество распавшегося белка за то же время (∆С, мг/л условный коэффициент активности).
(КА) микроорганизмов рассчитывали по соотношению:
КА=![]()
Из полученных данных (табл.4) следует, что активность микрофлоры в аэробных условиях на порядок выше, чем в анаэробных. В то же время не замечено четкой зависимости между активностью микроорганизмов и температурой (в интервале 10-300С).
Для определения порядка реакции деструкции белка по начальным участкам кривых (рис.2а) построена зависимость lgC=f (t, сутки) прямолинейный ход которой (рис.3) показывает, что как в аэробных, так и анаэробных условиях в начальный период деструкция белка описывается уравнением реакции при различных условиях по уравнению:
![]() К =
К = ![]() lg
lg ![]()
где С0 - начальная концентрация белка; Сt – его концентрация через время t (сутки).
Результаты приведены в табл.5. По этим данным построена кривая изменения lgК в зависимости от температуры (рис.4).
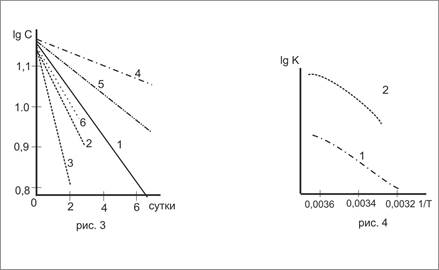
|
Рис.3. Изменение скорости деструкции белка в аэробных (1-3) и анаэробных (4-6) условиях: 1,4-100; 2,5-200; 3,6-300. |
Рис.4. Влияние температуры на константу скорости деструкции белка: 1-аэробные, 2-анаэробные условия. |
Таблица 4
Условные коэффициенты активности микроорганизмов
|
t, 0C |
O2, мг/л |
DС, мг/л×103 |
Количество микроорганизмов (N1/2)млн.кл/мл |
КА=
|
|||
|
1 |
2 |
1 |
2 |
1 |
2 |
||
|
10 |
10,1 |
5,0 |
2,5 |
0,6 |
0,05 |
8,3×10-3 |
5×10-3 |
|
20 |
9,2 |
4,0 |
7,0 |
1,5 |
0.5 |
2,7×10-3 |
14×10-3 |
|
30 |
8,8 |
8,0 |
9,5 |
1,3 |
0,2 |
6,1×10-3 |
47×10-3 |
|
10 |
0 |
1,6 |
1,5 |
1,4 |
0,7 |
11,0×10-4 |
21×10-3 |
|
20 |
0 |
1,8 |
1,8 |
6,0 |
2,5 |
3,0×10-4 |
1,2×10-4 |
|
30 |
0 |
4,0 |
4,0 |
7,0 |
2,2 |
5,7×10-4 |
18×10-4 |
Примечание. 1-гетерогенные бактерии; 2-микроорганизмы, обладающие протеолитическими свойствами.
Непрямолинейный характер полученной зависимости указывает на заметное изменение энергии активации при изменении температуры. В связи с этим провели расчеты величины энергии активации процесса деструкции белка (табл.5) для интервалов температур 10-20º и 20-30º по формуле [7].
Таблица 5
Константы скорости (К) и энергии (Е) деструкция растворимого белка под действием микроорганизмов
|
t, ºC |
К, сутки |
Интервалы температур, ºC |
Е, ккал/моль×град |
||
|
аэробные условия |
анаэробные условия |
аэробные условия |
анаэробные условия |
||
|
10 |
0,09 |
0,0023 |
10 – 20 |
9,4 |
7,2 |
|
20 |
0,159 |
0,0040 |
2 - 30 |
|
|
|
30 |
0,377 |
0,0077 |
|
15,0 |
11,8 |
E = ![]() lg
lg ![]() , где Е – энергия активации (кал/моль×град), К1 и К2 – константы скоростей реакций при абсолютных температурах Т1 и Т2.
, где Е – энергия активации (кал/моль×град), К1 и К2 – константы скоростей реакций при абсолютных температурах Т1 и Т2.
Величина Е в анаэробных условиях несколько ниже, чем в аэробных, а с повышением температуры энергия активации увеличивается. Порядок величин энергии активации (7-15 ккал/моль×град) позволяет предположить, что деструкция белков происходит в результате ферментативной реакций при участии радикалов [7].
При рассмотрении изменения состава минеральных форм углерода (табл.2) видно, что концентрация СО2 в анаэробных условиях возрастает к концу опытов частично за счет бикарбонатов, частично вследствие минерализации органических соединений. Сравнительно небольшую убыль суммарного содержания минеральных форм углерода в аэробных условиях можно объяснить удалением СО2 при аэрировании колонок воздухом. Расчеты количества минеральных и органических форм азота до и после опытов (табл.3) показывают сравнительно хороший их баланс. В аэробных условиях отмечено значительное увеличение концентрации аминокислот при соответствующем уменьшении содержания белка.
Повышение содержания минеральных форм азота происходит во всех случаях за счет аммония с одновременным уменьшением концентрации нитрит- и нитрат ионов.
Влияние содержания кислорода в воде на скорость деструкции белка проводили на свежеотобранной воде V эколого-фенологических рыбоводных прудах следующего состава:
|
|
мг/л |
|
мг/л |
|
Ca2+ |
32,0 |
CI- |
12 |
|
Mg2+ |
9,0 |
SO42- |
18 |
|
K+ + Na+ |
9,2 |
HCO2- |
80 |
|
Cu2+ |
2,2 |
CO2 |
0 |
|
Mg2+ |
13,0 |
CO32- |
2,5 |
Перед началом опытов путем продувания смеси воздуха с азотом установили требуемое насыщение воды кислородом. После стабилизации режима в колонки добавляли альбумин в количестве 13 мг/л.
Опыты проводили при температуре 20º, поддерживая во время всего эксперимента следующее содержание кислорода (мг/л): 1колонка – 10 ± 1; II – 5 ± 1; III- 2 ± 0,4; IV – около нуля. Определяли показатели: содержание кислорода, белка, общее количество бактерий, численность гетеротрофов и микроорганизмов, обладающих протеолитическими свойствами. Температура поддерживалась автоматически.
Как видно из приведенных данных (рис.5а – кривая 1 и рис.2а-кривая 2), состав воды не оказывает существенного влияния на скорость деструкции белка, однако этот процесс в значительной степени зависит от содержания кислорода. Как правило, при его уменьшении скорость деструкции снижается за счет замедленного в начальный период развития микрофлоры. Этот эффект проявляется сильнее, чем ниже содержание кислорода.
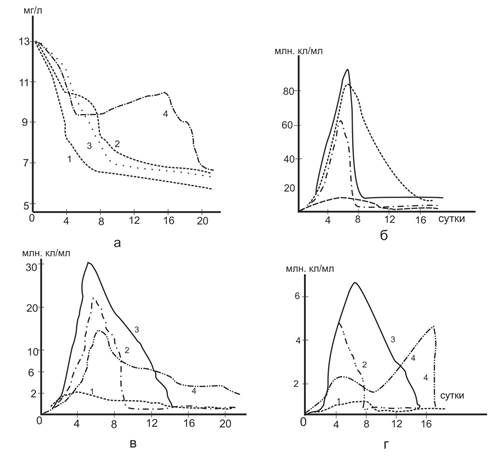
Рис. 5. Влияние содержания кислорода на деструкцию белка и развитие микроорганизмов.
1-4- содержания О2 соответственно 10,5,2 и 0 мг/л: а – белки; б – общая численность бактерий; в – гетеротрофов; г – микроорганизмов, обладающих протеолитическими свойствами.
После периода адаптации идет довольно быстрый распад белков, но уже не за счет повышения активности микрофлоры, а вследствие резкого возрастания ее численности (табл.6). Как и в предыдущем опыте, скорость деструкции уменьшается после разрушения 60-70% исходного содержания белка.
Таблица 6
Условные коэффициенты активности микроорганизмов
|
О2, мг/л |
DС, мг/л×10-3 |
Количество микроорганизмов (N1/2), млн.кл/мл |
КА=
|
|||
|
1 |
2 |
1 |
2 |
1 |
2 |
|
|
10 |
3,5 |
5,5 |
1,75 |
0,25 |
2,0 × 10-3 |
22,0 × 10-3 |
|
5 |
1,2 |
1,5 |
6,75 |
1,25 |
0,77 × 10-3 |
1,2 × 10-3 |
|
2 |
3,0 |
3,3 |
9,00 |
1,75 |
0,33 × 10-3 |
1,9 × 10-3 |
|
0 |
1,0 |
1,5 |
9,00 |
0,62 |
0,11× 10-3 |
2,4 × 10-3 |
Примечание. 1-гетеротрофные бактерии; 2-микроорганизмы, обладающие протеолитическими свойствами.
Дальнейший распад описывается другой кинетической кривой. В анаэробных условиях наблюдается увеличение содержание белка, что обусловлено вторичным загрязнением в связи с отмиранием клеток бактерий. Весьма примечателен тот факт, что снижение содержание кислорода до 50% насыщения приводит к резкому (на целый порядок) увеличению численности гетеротрофов, то есть значительному ухудшению санитарного состояния воды. Это обстоятельство необходимо учитывать при использовании воды для питьевого водоснабжения, и в местах водозабора добиваться максимального насыщения ее кислородом, путем искусственной аэрации.
Выводы:
1. В природной воде деструкция белка проходит в 2-3 раза быстрее, чем в дистиллированной.
2. Увеличение температуры (10º - 30ºС) и содержание кислорода (0-10мг/л) приводит к возрастанию скорости деструкции белка, что обусловлено главным образом повышением активности микроорганизмов и в меньшей степени ростом их численности.
3. В начальный период деструкции белка (2 - 6 суток) процесс описывается уравнением реакции первого порядка. Константы скоростей и величины энергии активации процесса деструкции колеблются в пределах 0,002-0,38 сутки-1 и 7-15 ккал/моль×град.
4. В условиях эксперимента происходит распад белка до более простых органических соединений, причем это процесс сопровождается дезаминированием.
5. Уменьшение степени кислородного насыщения воды до 50% и ниже сопровождается резким увеличением количества микроорганизмов, что приводит к ухудшению санитарного состояния воды.
Рецензенты:
Гетоков О.О., д.б.н., профессор кафедры зоотехнии КБГАУ им. В.М. Кокова, г. Нальчик;
Карашаев М.Ф., д.б.н., доцент кафедры «Ветеринарно-санитарная экспертиза» ФВМиБ КБГАУ им. В.М. Кокова, г. Нальчик.



