Проблема лечения гнойно-воспалительных заболеваний (ГВЗ) занимает одну из ведущих позиций в хирургии в силу неуклонного роста распространенности и увеличения процента их осложнений и летальности. Явная неудовлетворительность результатами лечения многих хирургических болезней определяется ростом числа послеоперационных гнойно-септических осложнений и связанной с ними летальностью [10].
Традиционное использование антибиотиков для профилактики и лечения гнойно-воспалительных заболеваний в настоящее время дает определенный сбой, что связанно с распространением агрессивной микрофлоры и резистентностью к антибиотикам, а также другим дезинфицирующим средствам. Кроме того, антибиотикотерапия может приводить к подавлению нормальной микрофлоры человека, сенсибилизирующему и токсическому эффектам [4]. Антибиотики не обладают и прямым стимулирующим действием на репарацию в ране. Есть определенные трудности и в поддержании необходимой концентрации антибиотиков в гнойной ране. Одной из важнейших причин, затрудняющих эффективную антибиотикотерапию, является динамичность раневого процесса с изменчивостью и сменой возбудителей.
Лечение гнойных инфекций осложняется как подавлением иммунной реактивности организма, вызываемым как действием патогенных микроорганизмов, так и собственно лечебных препаратов. Особые трудности лечения возникают при длительном существовании гнойных ран. У подобных больных обнаруживается снижение иммунитета, которое, является дополнительным фактором развития нозокомиальных штаммов [3,8].
Таким образом, проблема активного местного воздействия на очаги инфекции и гнойно-септические осложнения в ранах мягких тканей с целью повышения эффективности их лечения остаётся до сих пор актуальной проблемой хирургии во всем мире. Интересным представляется оценка влияния местного применения криокислородной терапии, которая сочетает в себе преимущества как классической криотерапии, так и приемов оксигенации пораженных тканей на динамику показателей некоторых интерлейкинов при лечении инфицированной раны.
Цель исследования: изучить уровень продуктов цитокинов у экспериментальных животных с гнойными ранами после использования криокислородного аэрозоля (ККА) в эксперименте.
Материалы и методы исследования. Исследование проводилось на 75 белых крысах-самцах породы «Вистар» 6-месячного возраста с массой тела 200-250 г. Животных содержали в условиях вивария при свободном доступе к воде и пище, что соответствует нормативам ГОСТа «Содержание экспериментальных животных в питомниках НИИ». Опыты на животных выполняли в соответствии с правилами гуманного обращения с животными, регламентированными «Правилами проведения работ с использованием экспериментальных животных», утвержденными Приказом МЗ СССР №742 от 13.11.84г. «Об утверждении правил проведения работ с использованием экспериментальных животных» и №48 от 23.01.85г. «О контроле за проведением работ с использованием экспериментальных животных». Все оперативные вмешательства проводили в стерильных условиях под общим обезболиванием.
Способ моделирования инфицированной раны заключался в формировании подкожного кармана размером 4х6 см, в который помещался фетровый диск, пропитанный суспензией, содержащий 0,5 мл 108 S. aureus. Данный способ обеспечивает получение модели инфицированной кожной раны с заданной бактериальной обсемененностью, которая по своим характеристикам максимально приближена к реальному клиническому течению раневого процесса.
Заражение животных проводили клиническим изолятом S. Aureus штамм 3904 MRSA (ГБУЗ НО «ГКБ № 30» г. Нижний Новгород, хирургическое отделение, трофическая язва), обладающим (на основе данных резистограммы) чувствительностью к офлоксацину, умеренной чувствительностью к пефлоксацину и ципрофлоксацину и не чувствительным к ингибитор защищенным пенициллинам, цефалоспорину, эритромицину, азитромицину, клиндамицину, линкомицину, ванкомицину, гентамицину, оксациллину, имипенему.
Лечение гнойной раны проводилось с использованием антибиотика пефлоксацина (Абактал®, рег. № 008768/01) в терапевтической дозе 8 мг/кг 1 раз в сутки в группах 1 и 2 на 1–5-е сутки, после моделирования гнойной раны.
Для обработки раны ККА использовали криогенный аппарат А.Г. Григорьева «Иней», позволяющий конденсировать газообразный кислород под заданным давлением и размером дисперсности фракционных частиц конденсированного кислорода, в зоне манипуляционного поля (патент РФ № 114837, опубликован в бюл. №11 от 20.04.2011г., ТУ 9437-001- 92371253-2011, РУ ФРС № 2012/13516 от 07.06.2012г.).
При работе данного аппарата осуществляется конденсация (сжижение) рабочего газа (воздуха, кислорода, озонированного кислорода) на аппликаторе в ране. Сжиженный рабочий газ выходит из отверстия внутреннего канала канюли аппликатора под давлением, пропорциональным давлению подаваемого рабочего газа, которое можно регулировать, что позволяет проводить активную криооксигенацию тканей.
Все животные были распределены на группы:
1 группа – животные, которым после формирования гнойной раны, применяли курсовое введение антибиотика (лечение а/б);
2 группа – животные, которым после формирования гнойной раны применяли курсовое введение антибиотика и лечение ККА на 3, 5, 14-е сутки (лечение а/б+ККА);
3 группа – животные, которым после моделирования гнойной раны, применяли лечение гнойной раны ККА (лечение ККА);
4 группа – контрольная, которым после моделирования гнойной раны, не оказывалось никакого лечения (без лечения);
5 группа – интактные.
Лечение ККА проводили в группах 2 и 3 на 3, 5, 14-е сутки после формирования гнойной раны. Забор материала проводился на 5, 10, 14-е сутки после формирования гнойной раны (абсцесса) соответственно дизайну экспериментального исследования.
В указанные временные точки животные подвергались декапитации, после чего осуществляли забор крови. Кровь центрифугировали в течение 15 минут при 250 g. Полученная плазма крови использовалась для определения ИЛ-2 и ИЛ-4. В работе для количественного определения ИЛ в плазме крови был использованы набор eBioscienceRatIL-2 PlatinumELISA (Кат. № BMS634) и eBioscienceRatIL-4 PlatinumELISA (Кат. № BMS628). Проводилось гистологическое исследование тканевых структур раны.
Полученные данные были обработаны с помощью пакета программ «Statistica 6.0». Для оценки вероятности различий между контрольными и опытными группами использовали U-критерий Манна-Уитни, независящий от формы распределения в группе. Различия считали достоверными при уровне значимости р£0,05.
Результаты исследования и их обсуждение.
В данной исследовательской работе была проведена оценка иммунного статуса экспериментальных животных при сформированном гнойно-воспалительном процессе по уровню интерлейкинов. Образование и высвобождение цитокинов происходит кратковременно и жестко регулируется. Диагностически значимой считается степень изменения их тканевых или сывороточных концентраций на фоне воспаления [7]. Для получения сведений об общих закономерностях продукции основных провоспалительных и противовоспалительных цитокинов в организме при гнойном воспалении был проведён анализ синтеза цитокинов – интерлейкинов (ИЛ) (IL-2, IL-4) в плазме крови экспериментальных животных. Цитокин секретируется Т-лимфоцитами CD4+, а также Т-клетками некоторых других субпопуляций лимфоцитов [6]. ИЛ-2 является фактором роста Т-клеток, которые принимают активное участие в антибактериальном ответе, активируя специфические лимфоциты на борьбу с микроорганизмами и вирусами.
Рецепторы ИЛ-2 найдены на T-клетках, Nk-клетках [9]. ИЛ-2 усиливает В-клеточный рост и синтез иммуноглобулинов. ИЛ-2 является важным провоспалительным цитокином, может стимулировать крупные гранулярные лимфоциты, макрофаги и В-клетки.
ИЛ-4 образовывается в основном CD4+ Т-клетками, но также и тучными клетками и базофилами. ИЛ-4 поддерживает пролиферацию активированных Т-клеток и приводит к дифференциации ТН2 клеток, поддерживающих продукцию антител в гуморальном иммунном ответе [12]. Также IL-4 стимулирует противовоспалительные эффекты. Он контролирует многочисленные молекулярные процессы, которые вызывают дезактивацию воспалительных макрофагов, подавление секреции провоспалительных цитокинов TNF-α, IL-1, и IL-8 [5, 11].
При исследовании плазмы крови у экспериментальных животных отмечалось достоверное снижение уровня IL-2 во всех экспериментальных группах по сравнению с контролем на 3-и сутки после формирования гнойно-воспалительного процесса (табл. 1). Наиболее низкая концентрация отмечалась в группе 4 (без лечения). По литературным данным, отрицательная динамика уровня IL-2 в крови соответствует прогрессированию бактериальной инфекции [1].
Таблица 1
Содержание ИЛ в сыворотке крови крыс при гнойно-воспалительном процессе (M±m)
|
Группа |
ИЛ-2, |
ИЛ-4 |
|
Интактные, n=15 |
65,51±2,2 |
0 |
|
5-е сутки |
||
|
1. Антибиотик, n=4 |
41,34±4,6* ** |
0 |
|
2. Антибиотик + ККА, n=4 |
39,33±4,0* ** |
0 |
|
3. ККА, n=4 |
47,37±5,8* ** |
0 |
|
4. Без лечения, n=4 |
27,17±4,2* |
0 |
|
10-е сутки |
||
|
1. Антибиотик, n=4 |
26,20±3,2* |
0 |
|
2. Антибиотик + ККА, n=4 |
13,88±1,8* ** |
0 |
|
3. ККА, n=4 |
19,76±3,2* ** |
0 |
|
4. Без лечения, n=4 |
27,37±6,2* |
0 |
|
14-е сутки |
||
|
1. Антибиотик, n=4 |
14,9±1,7* ** |
0 |
|
2. Антибиотик + ККА, n=4 |
45,6±4,8* ** |
0 |
|
3. ККА, n=4 |
45,8±6,1* ** |
3,5±0,4* |
|
4. Без лечения, n=4 |
23,6±2,6* |
2,4±0,3* |
* - р<0.05 по отношению к интактной группе; ** - р<0.05 по отношению к контрольной группе «без лечения»
На 10-е сутки после начала лечения отрицательная динамика по уровню ИЛ-2 сохранялась, но минимальные значения фиксировались в группах с применением криокислорода как по сравнению с интактными животными, так и контрольными значениями (группа 4). Однако на 14-е сутки после начала лечения обнаружился разнонаправленный эффект на содержание IL-2 при различных видах терапии. В группе 1 и 4 уровень цитокина продолжает снижаться, что говорит о сохранении бактериальной инфекции. Группы 2 и 3 характеризовались резким увеличением данного показателя по сравнению с контрольной группой 4 (без лечения). В.В. Будрик (2009) показал, что криогенное воздействие оказывает благоприятное влияние на организм в целом и обладает иммуностимулирующим действием [2]. Сопоставимость уровня IL-2 в группах 2 и 3 говорит о снижении гнойно-септической нагрузки и соответствует морфологической картине в тканях раны в этих группах.
При регистрации продукции IL-4 обращали на себя внимание низкий уровень базовой секреции. Однако при изучении уровня IL-4 – основного противовоспалительного цитокина – обнаружен статистически достоверный рост его содержания на 14-е сутки после лечения по сравнению с контрольными пробами групп с применением криокислородного лечения.
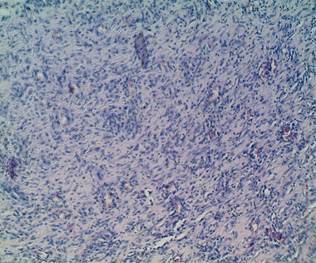
Титры IL-2, IL-4, отражающие иммунокомпетентные процессы и противовоспалительную репаративную фазу цитокинового ответа, полностью соответствуют результатам гистологического исследования операционного материала тканей раны, на 14-е сутки исследования. При гистологическом исследовании операционного материала у животных групп 2 и 3 отмечается исчезновение явлений отека, полнокровия и нейтрофильной инфильтрации. В этих же группах интенсивно формируются круглоклеточные элементы и грануляционная ткань (рис.1).
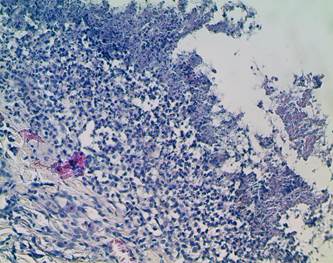
В группах 1 и 4, в которых не применялось воздействие ККА, в ранах продолжались явления некроза, отека, полнокровия, сохранялась нейтрофильная инфильтрация (рис.2).
Данные морфологического изучения биоптатов в группе животных, где гнойно-деструктивный процесс лечился традиционно, свидетельствуют о замедленном темпе течения раневого процесса, при котором альтеративно-воспалительные явления превалируют над репаративными и, как итог, грануляционная ткань длительное время остается незрелой. В группах животных, которым проводилось криокислородное лечение, течение раневого процесса протекает интенсивно.
|
|
|
|
Рис. 1. Формирование круглоклеточных элементов и грануляционной ткани. 14-е сутки. Окраска гематоксилин-эозином. х 200 |
Рис. 2. В тканевых структурах раны явления некроза, отека, полнокровия сосудов, нейтрофильная инфильтрация. 14-е сутки. Окраска гематоксилин-эозином. х200 |
Таким образом, при исследованном гнойно-воспалительном процессе динамический контроль сывороточных концентраций цитокинов позволяет прослеживать этапность развития системной воспалительной реакции. Применение криокислородной методики лечения при гнойных ранах приводит к стабилизации уровня провоспалительного интерлейкина 2 и увеличению противовоспалительного цитокина IL-4 в плазме крови экспериментальных животных.
Выводы.
1. Многократная обработка абсцесса криокислородным аэрозолем приводит к активации системы иммунитета, что способствует скорейшему заживлению раневой поверхности.
2. На фоне проводимой терапии в сыворотке крови возникает разнонаправленное изменение содержания ИЛ-2 (снижение концентрации после второго сеанса и резкое увеличение до уровня интактных животных после третьего), увеличение содержания ИЛ-4.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.